基因组重排选育Epothilone B高产菌株
2013-12-23王大红刘飞
王大红 刘飞
(1.河南科技大学食品与生物工程学院,洛阳 471023;2.南阳师范学院生命科学与技术学院,南阳 473061)
Epothilone B是由德国生物技术研究中心首次从纤维堆囊菌分离得到的十六元大环内酯类化合物[1],该物质能促进微管蛋白聚合,水溶性好,其活性是紫杉醇的2 000-3 000倍[2-4]。目前,美国、瑞士等国开始从事相关研究,而我国主要是山东大学、华南理工等机构做了一些相关研究。2007年由美国施贵宝公司开发的Epothilone B内酰胺衍生物Ixabepilone获得FDA批准在美国上市,这是第一个上市的Epothilones衍生物,每毫克大约70美元[5]。目前纤维堆囊菌So.ce 90菌的产量低,虽然在发酵过程中通过补料方式或不断更新吸附树脂可以提高Epothilones类似物的产量,但是毫克级的产量给Epothilones的开发及应用带来了很大困难[6]。因此,菌种的筛选、选育及发酵条件的探索仍然是Epothilone B研究者需要研究的重点目标之一。
基因组重排(genome shuffling)是一种基于原生质体融合,并对原生质进行递推式融合的新型体内分子育种方法。2002年,Zhang等[7]首次系统地提出了基因组重排的概念并成功地将该技术运用于快速提高弗氏链霉菌合成泰乐菌素的能力。随后,Gendy等[8]采用基因组重排技术选育绫霉素的产生菌Nocardia sp. ALAA 2000,选育后绫霉素比起始菌株提高了19倍。Xu等[9]利用该技术使Trichoderma viride产纤维素酶的能力提高了1.97倍。随着基因组重排技术的不断发展和成熟,通过基因组重排提高代谢产物产量的例子不断出现,表明该项技术作为新代谢产物开发的途径具有一定的应用前景。本研究旨在采用基因组重排技术改良Epothilone B产生菌,选育出高产Epothilone B的优良变异菌株,研究结果具有一定的理论和实际意义。
1 材料与方法
1.1 材料
1.1.1 菌株 亲本菌株SC4-14和SC4-56是由纤维堆囊菌AHB125(S. cellulosum AHB125)经过紫外诱变和2%乙酸钠抗性筛选出来并保存的Epothilone B高产菌株[10]。
1.1.2 培养基和溶液 斜面培养基、种子培养基和发酵培养基参见参考文献[10]。
再生固体培养基(g/L):蔗糖171.5,MgCl24.273,酪胨3.0,酵母浸膏1.0,CaCl21.0,琼脂粉16.0,pH7.2-7.4。
HEPES缓 冲 液:HEPES 20 mmol/L,MgCl220 mmol/L,蔗糖0.5 mol/L,pH6.8,灭菌备用。
溶菌酶溶液:称取0.1 g溶菌酶,加入HEPES缓冲液溶解并定容至10 mL,过滤除菌,4℃保存,使用时稀释。
35% PEG4000溶液(W/V):PEG4000定容于100 mL HEPES缓冲液。
1.2 方法
1.2.1 Epothilone B的发酵与测定 Epothilone B的发酵与测定见参考文献[10]。Epothilone B的测定采用HPLC法,通过Epothilone B的保留时间和光吸收曲线对基因组重排后的高产菌株发酵产物中的Epothilone B进行定性。
1.2.2 原生质体的制备及再生 菌体培养至对数生长期(48 h)时,加入终浓度为0.01 mol/L EDTA和1%甘氨酸,继续培养4 h,取一定量培养好的菌液,1 000 r/min离心5 min,取上清液5 000 r/min再离心10 min并收集菌体,HEPES缓冲液洗涤2次,将菌体保存在5 mL HEPES缓冲液中。然后加入溶菌酶液并混匀,使其终浓度为5 mg/mL,37℃水浴保温酶解破壁1 h,定时镜检。酶解后,3 000 r/min离心10 min并收集原生质体,用等体积的HEPES液重悬,振荡混匀,离心弃上清,再用HEPES液洗涤1次,等体积重悬,与冷却至45℃左右的上层再生固体培养基混匀,倾入已孵育过夜的再生固体培养基上,30℃培养5-7 d,观察再生情况。
1.2.3 原生质体的灭活 紫外线灭活:将原生质体溶液移入无菌培养皿中,置于已预热稳定的15 W紫外灯下,垂直距离为30 cm,分别照射60、70、80、90、100、110和120 s进行灭活,经HEPES缓冲液10倍系列稀释后,涂布于再生平板上,30℃避光培养5-7 d,检查灭活效果。
热灭活:将原生质体溶液置于无菌离心管中,置于温度分别为55、60、65和70℃水浴锅中,保温10、15、20、25和30 min进行灭活,经HEPES缓冲液10倍系列稀释后,涂布于再生平板上,30℃避光培养5-7 d后,观察结果,检查灭活效果。
1.2.4 基因组重排 对亲本株SC4-14的原生质体进行热灭活,对亲本株SC4-56的原生质体进行紫外灭活,将灭活的原生质体用35% PEG4000(含0.02 mol/L CaCl2)在37℃条件下随机融合20 min。然后用5倍体积的HEPES缓冲液稀释,并3 000 r/min离心5 min,收集原生质体后稀释并涂布于再生培养基上再生,30℃培养3-7 d,全部再生菌落即为F1代融合菌群;将生长旺盛的融合子菌落转接到液体培养基中,培养24 h,检测发酵液中Epothilone B的含量,产量提高的突变株为第1轮融合株F1,再将产量较高的优良菌株(F1)进行下一轮原生质体制备、灭活、融合与筛选,所得突变株即F2。如此反复进行4 轮循环原生质体融合、再生,不同融合子代标记为F1、F2、F3和F4,同时以原始菌株做对照。
1.2.5 突变菌株遗传稳定性的测定 将生产能力较高的几株菌接种至固体培养基中传代10次并进行发酵试验,检测Epothilone B的含量,选择遗传稳定性较好、产量稳定的重组菌株作为高产重组菌株。
1.2.6 发酵过程曲线的测定 将亲本菌株与基因重排后的菌株种子液以10%接种量接种于发酵培养基,分别于发酵的第1、2、3、4、5、6、7和8天取样,分别测定其菌体生长曲线和EpothiloneB含量,绘制其发酵过程曲线。其中生长曲线采用分光光度计测定在OD600下的吸光值,EpothiloneB含量测定采用HPLC法。
2 结果
2.1 原生质体的制备和再生
在试验过程中需要对原生质体制备的影响条件进行考察。经过前期的研究确定溶菌酶最终质量浓度为4 mg/mL、酶解温度为37℃、酶解时间为60 min,在此条件下原生质体的形成率和再生率最高。
2.2 原生质体灭活
2.2.1 热灭活原生质体 从表1 可见,当菌株SC4-14原生质体在70℃恒温水浴中处理20 min 时,原生质体致死率达到100%。但当温度超过65℃时,原生质体容易黏结成团,不利于原生质体的融合。因此,本试验确定60℃、处理25 min 作为Epothilone B产生菌原生质体热灭活的条件。

表1 热灭活时间和温度对SC4-14原生质体致死率的影响
2.2.2 紫外线灭活原生质体 从图1可以看出,当紫外线照射SC4-56的原生质体时间为110 s 时,原生质体致死率为100%。因此,选用紫外线照射110 s 作为Epothilone B产生菌原生质体紫外灭活的处理时间。

图1 紫外线灭活时间对SC4-56原生质体致死率的影响
2.3 基因组重排
为获得更多重排的正突变基因组合,选用两个亲株SC4-14和SC4-56作为基因重排的出发亲本,这2个亲本是由S. cellulosum AHB125经过紫外诱变和2%乙酸钠抗性筛选而获得的。经过4轮基因组重排试验后,获得62株生长速度较快的菌株,对得到的重排菌株进行产量测定,得到8株产量相对较高的重组菌株。从图2中可以看出,原始菌株S. cellulosum AHB125 Epothilone B的产量为8.2 mg/L,制备原生质体的两株亲本菌株SC4-14和SC4-56的Epothilone B产量分别为13.6 mg/L和14.5 mg/L。获得的8株高产菌株其Epothilone B的产量都是SC4-14和SC4-56菌株的2倍以上,并且菌落形态和颜色与起始菌株相比没有发生明显变化。其中F4-13(58.8 mg/L) 和F4-28(67.4 mg/L)的产量最高,Epothilone B的产量是SC4-14菌株产量的4.3倍和5.0倍,是SC4-56菌株产量的4.1倍和4.6倍,是原始菌株纤维堆囊菌AHB125 Epothilone B产量的8倍。

图2 基因组重排筛选结果
2.4 遗传稳定性试验
将筛选出的8株高产菌株连续传代10次后,进行摇瓶发酵试验,以摇瓶的产量作为筛选的指标,结果(表2)显示,传代后的菌株发酵产量没有明显下降,表明筛选到的重排菌株的高产性状遗传特性较稳定。F4-6、F4-45和 F4-56的产量有明显下降,其遗传稳定性差;而其它5株的遗传性稳定性较好,其中F4-28的产量最高,Epothilone B的产量一直稳定在67 mg/L左右。

表2 重组菌株的Epothilone B产量(mg/L)
2.5 菌株SC4-56和F4-28在10 L发酵罐中的发酵过程比较
将亲本菌株之一SC4-56和重排菌株F4-28在10 L发酵罐上分别进行发酵试验,其发酵过程曲线如图3所示。两种菌株在发酵过程中的生长曲线大致相似,都在第3天达到菌体的最大值,但重排菌株F4-28的细胞密度要大于亲本菌株,并提前进入衰亡期。在Epothilone B积累过程中,两者在发酵罐中的产量都比在摇瓶中要高约10%,SC4-56在第6天产物达到最大值(18.5 mg/L),而F4-28在发酵的第5天达到最大值(75.2 mg/L),比亲本菌株的发酵周期要短1 d。因此,重排菌株F4-28在发酵生产上更易于提高发酵罐的利用效率。
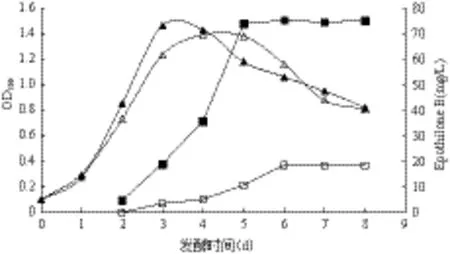
图3 SC4-56和F4-28在10 L发酵罐中的发酵过程曲线
3 讨论
采用物理、化学方法来提高Epothilone B产量的传统诱变育种方法存在诱变效率低、筛选工作量大、周期长、重复诱变过程造成一些无关的或负向突变的积累等缺点,很难大幅度提高Epothilone B产量;而由于黏细菌的特殊性,通过基因工程提高Epothilone B的方法很少被研究[11]。基因组重排技术是一种多亲本递归式原生质体融合技术,亲本菌株在全基因组的不同位置上同时发生重组,发生多交换和多基因重组,最终使不同的正向基因重组到同一个细胞株中,因此相对容易大幅度提高目的产物的产量,是改善工业微生物表型的直接而有效的方法[12]。另外,尤其适用于微生物的代谢途径、编码生物合成酶的基因以及基因表达调控的机制不清楚的代谢产物。与传统的理化诱变方法相比,基因组重排技术可更快速、高效地筛选出表型优良的菌株,且在筛选库的建立过程中剔除了负突变,弥补了经典诱变方法负突变的缺陷[13]。
本研究中采用热灭活和紫外灭活两种方式处理原生质体,然后再融合,这样避免了同种灭活方式造成的相同部位发生损伤的缺陷,使不同菌株间染色体不同部位的致死损伤可以得到互补,从而提高了重组的效率。本研究首次尝试采用基因组重排技术改良纤维堆囊菌AHB125,获得一株遗传性能稳定的高产菌株F4-28,Epothilone B的产量达到了67.4 mg/L,是原始菌株纤维堆囊菌AHB125的8倍,是两亲本菌株SC4-14和SC4-56的5倍。因此,采用基因组重排技术是一种有效的提高Epothilone B产量的方法。虽然本研究取得了很大的进步,但是Epothilone B的产量与目前已报道菌株S. cellulosum So0157-2的产量(104 mg/L)相比还有较大差距[14]。这主要是因为本研究所用的菌株来源与其不同,纤维堆囊菌AHB125是由本实验室研究人员从自然界中分离并鉴定的,其初始产量很低,并且前期的菌种选育研究的较少,而S. cellulosum So0157-2已经过多次诱变。因此,在下一步的工作中,应该把基因组重排与其它诱变育种技术联合使用,Epothilone B的产量可能会更高。同时,本研究也再次证明了基因重排技术在菌种选育中的有效性及高效性,同时为应用该技术选育高产Epothilone B菌株和研究Epothilone B的代谢调节奠定了基础。
4 结论
采用基因组重排的方法对Epothilone B产生菌纤维堆囊菌SC4-14和SC4-56进行菌株选育,获得5株目标物质产量较高并且遗传性能稳定的变异菌株,其中最优菌株F4-28的Epothilone B产量达到了67.4 mg/L,是两亲本菌株SC4-14和SC4-56的5倍,通过比较该菌株与亲本菌株之一SC4-56的发酵过程,F4-28的Epothilone B产量在第5天达到最大值,比SC4-56的发酵周期少1 d,可以缩短发酵周期。
[1] Gerth K, Bedorf N, Hofle G, et al. Epothilones A and B:antifungal and cytotoxic compounds from Sorangium cellulosum (Myxobacteria):production, physico-chemical and biological properties [J]. Journal Antibiotics, 1996, 49(3):560-563.
[2] Whitney H, Juwen D, Quincy Q. The microtubule inhibiting agent epothilone B antagonizes glioma cell motility associated with reorganization of the actin-binding protein α-actinin 4 [J]. Oncology Reports, 2011, 25(3):887-893.
[3] Kumar A, Heise H, Blommers M, et al. Interaction of Epothilone B (Patupilone) with microtubules as detected by two-dimensional solid-state NMR spectroscopy [J]. Angewandte Chemie, 2010, 49(41):7504-7507.
[4] Danishefsky S. On the potential of natural products in the discovery of pharma leads:A case for reassessment [J]. Natural Product Reports, 2010, 27:1114-1116.
[5] Harichand-Herdt S, O’Regan RM. Identifying subsets of metastatic breast cancer patients likely to benefit from treatment with the Epothilone B analog Ixabepilone [J]. American Journal of Clinical Oncology, 2010, 33(6):561-567.
[6] Frykman S, Tsuruta H, Lau J, et al. Modulation of epothilone analog production through media design [J]. Journal of Industrial Microbiology Biotechnology, 2002, 28(1):17-20.
[7] Zhang YX, Perry KA, Vinci V, et al. Genome shuffling leads to rapid phenotypic improvement in bacteria [J]. Nature, 2002, 6872:644-646.
[8] Gendy M, Bondkly A. Genome shuffling of marine derived bacterium Nocardia sp. ALAA 2000 for improved ayamycin production [J]. Antonie van Leeuwenhoek, 2011, 99(4):773-780.
[9] Xu F, Jin H, Li H, et al. Genome shuffling of Trichoderma viride for enhanced cellulase production [J]. Annals of Microbiology, 2012, 62(2):509-515.
[10] 王大红, 原江锋, 郭文杰.产Epothilone B纤维堆囊菌的选育与发酵优化[J].生物技术, 2012, 22(3):70-72.
[11] Julien B, Shah S. Heterologous expression of epothilone biosynthetic genes in Myxococcus xanthus [J]. Antimicrobial Agents and Chemotherapy, 2002, 46(9):2772-2778.
[12] Petri R, Claudia SD. Dealing with complexity:evolutionary engineering and genome shuffling [J]. Current Opinion in Biotechnology, 2004, 15(4):298-304.
[13] 张旭, 张惠文, 徐明恺.基因组重排技术选育乳链菌肽高产菌株[J].中国生物制品学杂志, 2010, 23(10):1065-1073.
[14] Gong G, Sun X, Liu X, et al. Mutation and a high-throughput screening method for improving the production of Epothilones of Sorangium [J]. Journal of Industrial Microbiology Biotechnology, 2007, 34(9):615-623.
