不同保存方法对中麻黄基因组DNA提取效果的影响
2013-12-23朱田田陈红刚张延红高素芳
朱田田,杜 弢,晋 玲,陈红刚,张延红,高素芳
(1.甘肃中医学院,甘肃兰州730000;2.甘肃省高校中(藏)药化学与质量研究省级重点实验室,甘肃兰州730000;3.甘肃中医学院药用植物遗传育种研究所,甘肃兰州730000)
中麻黄(Ephedra intermedia)是被《中华人民共和国药典》收录的正品麻黄之一[1-2],具有发汗解表,宣肺平喘,利水消肿等功效[3]。由于近年来滥采乱挖现象严重,致使中麻黄野生资源日渐枯竭,地面覆盖逐年减少,已成为濒危药用植物[4]。甘肃省为中麻黄主要分布省份之一,野生资源破坏亦十分严重,年收购量由20世纪80年代的3 000 t减少到目前的不足400 t[5]。因此,中麻黄资源的可持续性利用和保护工作势在必行。
近年来,DNA分子标记技术已在药用植物资源利用与保护方面得到广泛应用,并成为研究热点[6-8],而分子生物学试验能否顺利进行的基础是能否提取高质量的基因组DNA。本研究通过对不同方法采集和保存下的中麻黄样品进行基因组DNA提取,并采用琼脂糖凝胶电泳和紫外分光光度计法对其完整性、纯度以及浓度进行比较,旨在确定中麻黄的最佳采集和保存方法,为能够提取出高质量的基因组DNA奠定基础,为下一步的分子生物学试验提供可靠保证。
1 材料和方法
1.1 材料
1.1.1 植物材料 供试材料为植物中麻黄(E.intermedia)地上草质茎,其采集时间、地点及保存方法如表1所示。所有样品均由甘肃中医学院中药资源教研室晋玲副教授鉴定为麻黄科(Ephedrae)植物中麻黄(E. intermedia)。

表1 不同采集及保存方法的中麻黄样品
1.1.2 仪器设备 移液枪(Eppendorf),台式高速冷冻离心机(TGL16M),恒温水浴锅(HH-S24),凝胶成像系统(BIO-RAD),紫外分光光度计(UV-1102),电泳仪(DYY-7),涡旋混合仪(WH-3)。
1.1.3 主要试剂 液氮;CTAB,EDTA,Tris,PVP(聚乙烯吡喏烷酮),β-巯基乙醇,均购于西安科昊生物工程有限责任公司;RNaseA,琼脂糖(Agarose),EB,均购于兰州科美特生物科技有限公司;其余试剂(异丙醇、氯仿、异戊醇、无水乙醇、氯化钠、乙酸钠)均为国产分析纯。
1.2 方法
1.2.1 改良CTAB法[9-15](1)称取0.1 g左右中麻黄植物组织置于洁净干燥研钵中,加入适量PVP后与液氮研成细粉,在解冻前迅速转至2 mL离心管中。(2)加入800μLCTAB提取缓冲液(2%CTAB,20 mmol/LEDTA(pH值8.0),100 mmol/L Tris-HCl(pH值8.0),1.4 mol/L NaCl,2%β-巯基乙醇),涡旋混匀后放入65℃水浴中温浴50 min,期间每隔15 min颠倒混匀一次。(3)冷却至室温后加入等体积氯仿/异戊醇(24∶1),轻轻颠倒混匀后静置5 min,12 000 r/min离心10 min,用切尖枪头仔细吸取上清液于新离心管中,重复此步骤2~3次,直到分界层无白色物质为止。(4)吸取上清液于新离心管中,加入4μL RNaseA(10 mg/mL),37℃温浴1 h;加入2/3体积的异丙醇,1/10体积的5 mol/L乙酸钠轻轻混匀,于-20℃放置30 min沉淀DNA;12 000 r/min离心10 min,小心倒掉上清液,保留DNA沉淀于管底,加入70%乙醇700μL洗涤沉淀2~3次。(5)室温干燥后加入130μLTE缓冲液溶解DNA沉淀并且保存于4℃冰箱中备用(-20℃进行长期保存)。
1.2.2 琼脂糖凝胶电泳法检测DNA完整性 取5μL基因组DNA样品与1μL上样缓冲液混匀后点样于0.8%琼脂糖凝胶孔,电泳缓解液为1×TBE溶液,电压80 V条件下电泳1 h左右,EB(10 mg/mL)染色20 min,用凝胶成像系统照相,保存。
1.2.3 紫外分光光度计法检测基因组DNA的纯度和浓度 取20μL DNA样品用无菌ddH2O稀释20倍,混合均匀后加入石英比色皿中,测定260,280 nm波长处的紫外吸收值。根据A260/A280的值判断总DNA纯度,并计算质量浓度。DNA质量浓度(μg/mL)=A260×稀释倍数×50。
2 结果与分析
2.1 基因组DNA 电泳检测结果
不同采集和保存方法提取的中麻黄基因组DNA琼脂糖凝胶电泳检测结果如图1所示。
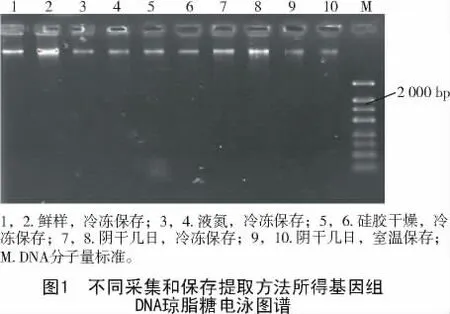
由图1可知,不同采集和保存方法的中麻黄样品的基因组DNA提取效果存在明显差异,1,2号样品条带整齐、明亮且拖尾不太明显,说明新鲜样品在采集后迅速冷冻保存,其基因组DNA降解较少,提取效果好;3,4,5,6号样品条带清晰、整齐且无拖尾,但明亮度较1,2号差,说明采集的鲜样无论置于液氮中或放入硅胶迅速干燥后冷冻保存,均能提取出高质量的基因组DNA且无降解,但提取量相对较少;7,8号样品条带有拖尾,说明采集的鲜样在阴干几天后冷冻保存会导致基因组DNA降解,影响提取质量;9,10号样品条带比较淡,且有明显拖尾,说明阴干后在室温下保存的样品,基因组DNA降解非常严重,提取的量少且质量不佳。
2.2 基因组DNA 紫外分光光度计检测结果
由表2可知,1,2号样品的A260/A280低于1.7,说明采集后迅速冷冻保存的新鲜样品所提取的基因组DNA有蛋白质、多酚杂质的污染;3,4,6号样品的A260/A280在1.7~1.8之间,说明置于液氮中或放入硅胶迅速干燥后冷冻保存的样本所提取的基因组DNA较纯净,基本无蛋白质、多糖或RNA的污染;而5号样品比值大于1.9,说明该样品的RNA未除干净;7,8,9,10号样品的A260/A280均未达到1.7,有的甚至低于1.5,说明采集的鲜样在阴干几天后无论是冷冻保存还是室温保存都会影响其提取效果,使得蛋白质或酚类杂质不易除净。因此,新鲜植物样本在采集时置于液氮或硅胶中保存,可有效防止DNA降解,且这2种方法对提取质量的影响差别不大。

表2 提取的基因组DNA 纯度及浓度检测
3 讨论
基因组DNA的有效提取是进行任何DNA下游工作的前提和基础,有效提取指的是得到的基因组DNA(或称总DNA)有足够的量,尽可能少降解和不含有影响下一步酶反应的杂质,因此,在DNA提取过程中应尽量避免使DNA断裂和降解的各种因素,以保证DNA的完整性,为后续的试验打下基础[16]。
植物材料的DNA降解速度与其新鲜程度有极大关系,如果材料不新鲜或反复冻融,其内源核酸酶的活性未很好抑制,降解速度会加快;同时,由于低温可以抑制相关酶的活性,使DNA降解速度减慢,因此,在植物样品采集时,常采用液氮保存材料,以保持其材料的新鲜度。由于液氮不便于携带且具有挥发性,因此,在较远地区或者时间较长的采样时,液氮保存具有一定的困难。有研究表明,野外采集时可将新鲜叶片或芽等用变色硅胶快速干燥,可有效防止细胞死亡过程中次生物质的释放和DNA的原位降解,因此,对DNA质量无影响,同时又可以解决携带不方便及采样量大的问题[17-18]。本试验中,通过比较以上2种采集保存方法的DNA提取效果,发现二者无论从DNA的完整性还是纯度与浓度上差别都不大,与前人的研究结果一致。
由于中麻黄多生长在气候干旱的荒漠地区,使得其地上茎木质化,可以有效地防止组织或细胞失水,延长了其脱离母体后的保鲜时间,减缓了DNA的降解速度。本试验采自兴隆山和仁寿山的样品,由于其采集地距实验室不远,采样后并未做任何处理,在当天直接带回实验室,因此,其降解程度并不严重。此外,植物材料无论以何种方式采集保存,都必须在低温环境下长期存放,否则会造成DNA迅速降解,本试验研究结果也支持此观点。
植物基因组DNA提取质量不仅与样品的采集和保存方法有关,还与植物组织新鲜度、提取方法以及操作过程相关。因此,在植物基因组DNA提取过程中要综合考虑上述因素,才能得到高质量的基因组DNA,为后续分子生物学试验提供可靠保证。
[1]中国科学院中国植物志编辑委员会.中国植物志(第七卷)[M].北京:科学出版社,1978:468-488.
[2]国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2010:300.
[3]张弦飞,晋玲,朱田田,等.麻黄研究现状概述(Ⅰ)[J].甘肃中医学院学报,2012,29(2):58-61.
[4]张永清,司建宁,何宝银.我国麻黄资源现状及开发利用对策探讨[J].世界科学技术,2002,4(4):63-68.
[5]魏建和,李先恩,高海泉,等.甘肃省甘草麻黄资源状况调查[J].中药信息与研究,2000,2(11):101-102.
[6]周延清,周鹏,郭静佩,等.DNA分子标记技术在四大怀药研究中的应用概况[J].河南农业科学,2012,41(2):21-25.
[7]李凤鸣,白玉娥.分子标记在木本油料植物种质资源和育种研究中的应用[J].天津农业科学,2010,16(4):20-25,29.
[8]廉勇,陈源闽,王勇,等.DNA分子标记技术辅助蔬菜育种研究进展[J].内蒙古农业科技,2008(5):78-79.
[9]Zhou Y Q.Application of DNA molecular markers technique to plant research[M].Beijing:Chemical Industry Press,2005.
[10]朱田田,晋玲,杜弢,等.中麻黄基因组DNA不同提取方法的比较[J].中国实验方剂学杂志,2012,40(4):316-318.
[11]杨慧珍,车丽.抗草丁膦转基因玉米不同DNA提取方法及PCR检测[J].山西农业科学,2011,39(9):925-927,1028.
[12]罗秋婷,钟君,满玉萍,等.不同因素对花生总DNA提取的影响[J].华北农学报,2009,24(增刊):16-19.
[13]魏琦超,畅丽萍,周岩,等.利用改良CTAB法提取小麦干种子总DNA[J].山西农业科学,2009,37(6):30-32.
[14]韩继成,徐平,李春敏,等.核桃叶片基因组DNA的4种提取方法比较[J].河北农业科学,2007,11(1):68-71.
[15]潘和平,晋玲,高天鹏,等.沙拐枣DNA提取方法改进及PCR扩增检测[J].草业科学,2006,23(10):28-31.
[16]刘塔斯,林丽关,龚力民,等.分子标记中植物DNA提取方法的研究进展[J].中南药学,2005,3(6):370-373.
[17]郭宝林,林生.丹参干叶片的DNA提取[J].中草药,2002,33(5):418-420.
[18]张国防,陈存及,邢建宏.樟树干叶DNA提取方法的研究[J].江西农业大学学报,2006,28(1):111-114.
