运动训练对局灶性脑缺血大鼠神经功能及Sema3A表达的影响
2013-12-23,,,
,,,
(青岛大学医学院附属医院,山东 青岛 266021 1 康复一科; 2 脑科研究所; 3 中心实验室)
脑卒中是一种具有高发病率、高死亡率、高致残率特点的疾病,其高致残性使病人不同程度丧失了运动、感觉功能,严重影响了病人的生活能力和生活质量[1-2]。目前,关于脑卒中药物治疗的研究有大量文献报道[3-4],而对于运动训练治疗脑卒中尤其是其后遗症的作用的相关研究尚少且不充分。本实验采用线栓法建立大鼠大脑中动脉阻塞再灌注动物模型,观察运动训练对大鼠神经功能改善及Sema3A-mRNA表达的影响,并探讨其可能的机制。现将结果报告如下。
1 材料和方法
1.1 分组及模型制备
健康雄性SD大鼠30只,体质量240~260 g,由青岛即墨鲁抗大鼠饲养中心提供。大鼠随机分为假手术组、对照组、训练组,每组10只。参照LONGA等[5]的线栓法制备左侧大脑中动脉阻塞2 h再灌注模型。造模成功标志:大鼠苏醒后出现左侧HORNER征,提尾悬空时右前肢屈曲、内收,爬行时向右侧转圈。按照MENZIES等[6]报道的神经功能评分法,将麻醉清醒后评分为1~4分的大鼠纳入研究。假手术组造模方法同上,但不阻塞大脑中动脉血流。
1.2 训练方法
训练组大鼠于左侧大脑中动脉缺血闭塞2 h再灌注后的24 h开始游泳训练:每只大鼠单独放于水深40 cm、宽50 cm、长60 cm的长方体透明玻璃容器中,水温29~31 ℃,水面距容器边缘50 cm,以使大鼠不能抓到容器边缘,进行游泳训练,每天1次,每次30 min,共3 d。其余组大鼠在标准笼内自由活动。3 d后处死各组大鼠。
1.3 神经行为检测方法
大鼠处死前,进行受损神经功能、抓握力情况及平衡功能评定。受损神经功能评定:采用MEN-ZIES等[6]评分法,评定大鼠受损神经功能改善情况。前肢抓握力评定:采用网屏测验法,观察大鼠抓住网屏坚持的时间,参照MACIAS等[7]评分法评估其前肢抓握力情况。平衡功能测定:采用平衡木测试法,观察大鼠在平衡木上的表现,参照FENNY等[8]评分法评价其平衡功能。
1.4 Sema3A-mRNA表达检测
采用RT-PCR法。大鼠处死后,取缺血侧大脑皮质和海马,-80 ℃保存。检测时,用Trizol RNA提取试剂盒提取组织总RNA,-80 ℃冰箱保存总RNA。cDNA第一链合成后42 ℃反转录30 min,95 ℃ 5 min灭活反转录酶,4 ℃ 5 min冷却降温,-20 ℃保存cDNA。以反转录的cDNA作为PCR模板进行扩增。上游引物为5′-AAAGTGGTTTCA-GTCCCCAAG-3′,下游引物为5′-AGTCAGTGGG-TCTCCATTCCT-3′,目的片段长度为318 bp。扩增条件为:94 ℃预变性5 min,然后94 ℃ 30 s、61 ℃ 30 s、72 ℃ 30 s循环33周期,之后72 ℃延伸 5 min。GAPDH cDNA扩增所需的上游引物为5′-TATGACAACTCCCTCAAGAT-3′,下游引物为5′-AGATCCACAACGGATACATT-3′,目的片段长度为317 bp。其扩增条件为:94 ℃预变性5 min,然后94 ℃ 30 s、58 ℃ 30 s、72 ℃ 30 s循环30周期,之后72 ℃延伸 5 min。RT-PCR产物-20 ℃保存。制备20 g/L琼脂糖凝胶,取RT-PCR产物4 μL,加6×load buffer 1 μL,120 V电压下电泳30 min,使用UVP凝胶图像成像系统拍摄并储存图像,采用Image J图像分析系统分析图像并记录结果。Sema3A-mRNA表达水平用Sema3A与GAPDH的mRNA表达之比表示。
1.5 统计学分析
采用SPSS 17.0软件进行统计学处理,多组间比较采用单因素方差分析,以P<0.05为差异有显著性。
2 结 果
2.1 各组大鼠神经行为评分比较
训练组大鼠神经功能评分低于对照组,而高于假手术组,差异有显著意义(F=177.75,q=19.49、6.00,P<0.05);训练组大鼠抓握力和平衡功能评分高于对照组,而低于假手术组,差异均有统计学意义(F=57.63、117.00,q=7.25~12.46,P<0.05)。见表1。
2.2 各组大鼠Sema3A-mRNA表达水平比较
训练组大鼠大脑皮质和海马Sema3A-mRNA表达水平均低于对照组,而高于假手术组,差异均有统计学意义(F=62.873、78.095,q=8.35~9.10,P<0.05),见表2,图1、2。
3 讨 论
本实验通过制备局灶性脑缺血大鼠,并采用神经功能评定、网屏试验和平衡测试3种评定方法,观察大鼠受损神经功能改善情况。结果显示,与假手术组比较,对照组大鼠缺血梗死后的抓握力、运动功能和平衡功能明显受限;训练组经过3 d的运动训练后,其受损肢体功能明显改善,但仍明显差于假手术组。本实验从行为学上证实,运动训练能够促进受损肢体功能的恢复。另外,可能由于训练时间较短,其受损肢体功能并未达到最好的恢复,训练强度对局灶性脑缺血大鼠受损功能的影响有待于进一步研究。
有关运动训练促进受损肢体功能恢复的机制的研究,国内外有大量的相关文献报道[9-12]。王强等[9]推测运动训练可能促进新的神经通路形成及突触再生,从而促进缺血后功能的恢复。杨敏等[10]则认为运动训练可以促进大脑相应区域的突触结构及传递的可塑性变化,促使神经系统的功能重组与代偿,从而促进脑梗死大鼠运动、学习和记忆能力的恢复。RICHARDSON等[11]研究显示,运动训练能够促进血管内皮生长因子(VEGF)表达,加速骨骼肌肉的新生血管形成,从而促进受损侧运动功能的恢复。YANG等[12]提出,运动训练联合动脉注射碱性成纤维细胞生长因子(bFGF),能够明显增加侧支循环血流量,进而提高骨骼肌肉的功能。MACIAS等[7]研究证实,运动训练能够促使脑源性神经营养因子(BDNF)表达上调,改变运动神经元的分布,加强运动神经元的支配功能,促进脊髓损伤后的神经修复与再生,从而促进肢体功能的恢复。

表1 各组大鼠神经行为评分比较(n=10,分,±s)

表2 各组大鼠Sema3A-mRNA表达水平比较
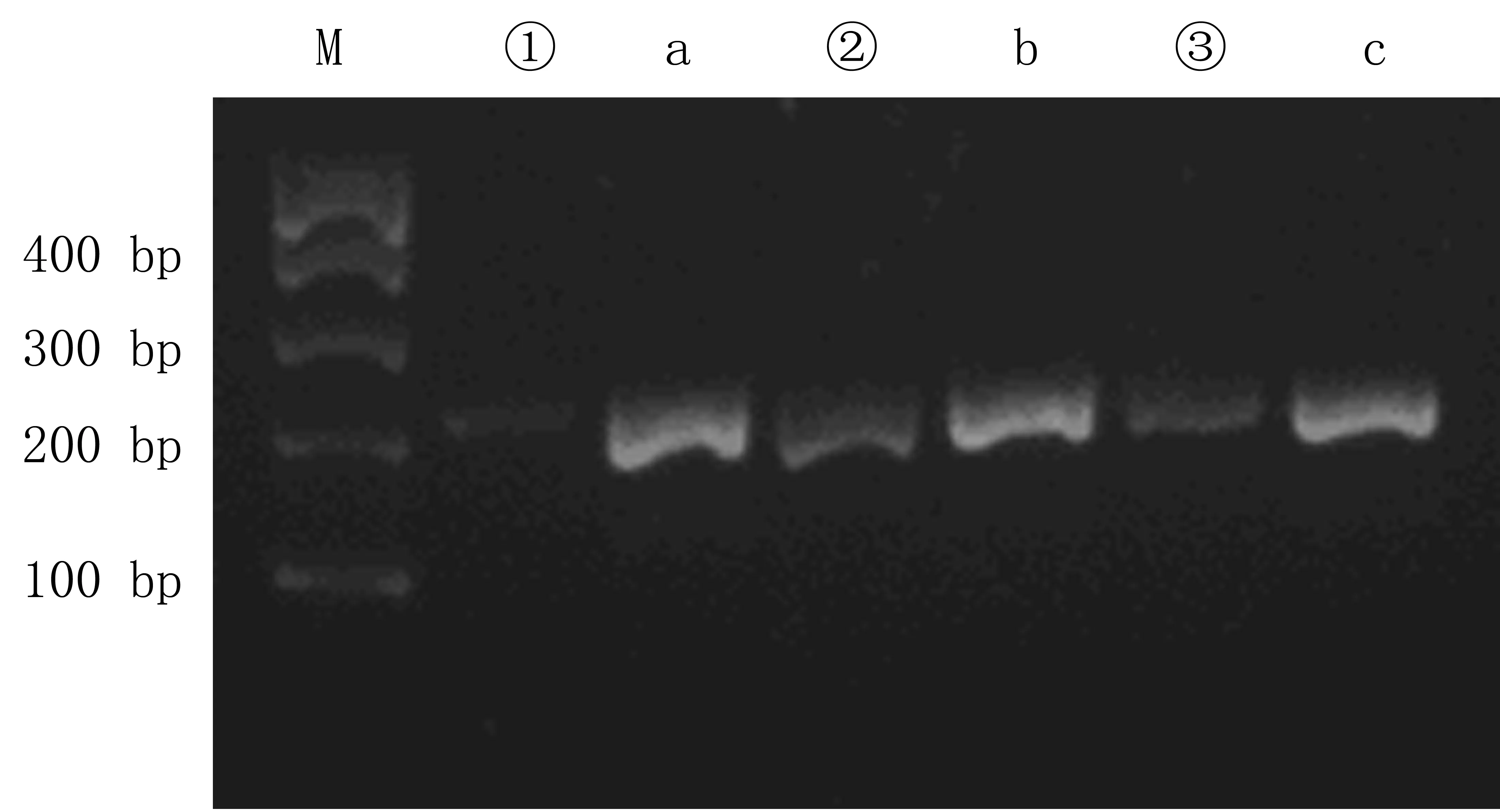
M为Marker;①、②、③为Sema3A表达水平;a、b、c为GAPDH表达水平。①、a为假手术组;②、b为对照组;③、c为训练组。

M为Marker;①、②、③为Sema3A表达水平;a、b、c为GAPDH表达水平。①、a为假手术组;②、b为对照组;③、c为训练组。
本文研究从轴突导向抑制因子方面探讨了运动训练促进受损肢体功能恢复的可能机制。Semaphorins家族是LUO等[13]在研究介导蝗虫胚胎中的轴突生长锥导向分子时发现的,它对神经细胞生长起排斥性和抑制性作用。Sema3A是该家族中研究最为充分的轴突导向因子,其N端的信号肽和免疫球蛋白样结构及氨基酸组成的Sema3A保守结构域是其功能得以发挥的重要结构基础[14]。Sema3A作为Semaphorins家族中最典型和最先被确定的神经导向因子,可以特异性地引起轴突生长锥萎缩,改变神经突起的方向,抑制其延伸,阻止轴突进入相应的靶区[15-16]。本文研究采用RT-PCR技术测定Sema3A-mRNA表达水平,结果表明,假手术组大鼠Sema3A-mRNA极少表达,可能与其参与抑制正常神经的错误延伸相关;缺血梗死后(对照组)表达量明显增高,轴突生长受到显著抑制;训练组经过3 d的运动训练后,其表达量显著减少,但仍明显高于假手术组,表明运动训练能够抑制其表达。提示运动训练能够降低Sema3A-mRNA表达水平,减弱其轴突生长抑制作用,进而促进受损神经再生和缺损功能恢复。
综上所述,运动训练能够促进脑梗死后受损肢体功能的恢复,其机制与运动训练减少Sema3A-mRNA表达有关。本实验尚存在不足之处,为期3 d的运动训练促进了脑梗死后肢体功能的恢复,但其肢体功能仍远差于正常肢体,是否延长训练时间能够取得更好的训练效果,尚有待进一步研究。
[1] MAYO N E, WOOD-DAUPHINEE S, CTÉ R, et al. Activity, participation, and quality of Life 6 months poststroke[J]. Archives of Physical Medicine and Rehabilitation, 2002,83(8):1035-1042.
[2] 王志宪,宋琳,刘淑芹. 脑卒中偏瘫病人康复护理干预的观察[J]. 青岛大学医学院学报, 2006,21(2):166.
[3] 王岭,孙俪,高焕民,等. 胡黄连苷Ⅱ对大鼠脑缺血再灌注损伤后炎症反应影响[J]. 青岛大学医学院学报, 2011,47(1):62-64.
[4] 王国峰,沈娜娜,王静云,等. 血管内皮生长因子在脑缺血耐受大鼠中的表达[J]. 青岛大学医学院学报, 2010,46(2):125-127,131.
[5] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[6] MENZIES S A, HOFF J T, BETZ A L. Middle cerebral artery occlusion in rats: a neurological and pathological evaluation of a reproducible model[J]. Neurosurgery, 1992,31(1):100-106.
[7] MACIAS M, NOWICKA D, CZUPRYN A, et al. Exercise-induced motor improvement after complete spinal cord transection and its relation to expression of brain-derived neurotrophic factor and presynaptic markers[J]. BMC Neuroscience, 2009,10:144-152.
[8] FEENEY D M, GONZALEZ A, LAW W A. Amphetamine, haloperidol, and experience interact to affect rate of recovery after motor cortex injury[J]. Science (New York, N.Y.), 1982,217(4562):855-857.
[9] 王强,王佩佩,岳寿伟,等. 强化训练对脑缺血再灌注大鼠臂板蛋白3A及神经纤毛蛋白-1表达的影响[J]. 中华物理医学与康复杂志, 2012,34(1):2-7.
[10] 杨敏,余茜,何成松,等. 运动训练对脑梗死大鼠行为学及NF200表达变化的影响[J]. 中国康复医学杂志, 2006,21(11):980-984.
[11] RICHARDSON R S, WAGNER H, MUDALIAR S R, et al. Exercise adaptation attenuates VEGF gene expression in human skeletal muscle[J]. American Journal of Physiology-heart and Circulatory Physiology, 2000,279(2):H772-H778.
[12] YANG H T, OGILVIE R W, TERJUNG R L. Exercise training enhances basic fibroblast growth factor-induced colla-teral blood flow[J]. The American Journal of Physiology, 1998,274(6 Pt 2):H2053-H2061.
[13] LUO Y, RAIBLE D, RAPER J A. Collapsin: a protein in brain that induces the collapse and paralysis of neuronal growth cones[J]. Cell, 1993,75(2):217-227.
[14] 唐卉凌,李澎涛,张玮,等. Semaphorin 3A在局灶性脑缺血大鼠脑组织中的表达特征及通络救脑注射液的保护作用[J]. 世界科学技术-中医药现代化, 2010(3):363-367.
[15] VACHKOV I H, HUANG X Y, YAMADA Y, et al. Inhibition of axonal outgrowth in the tumor environment: involvement of class 3 semaphorins[J]. Cancer Science, 2007,98(8):1192-1197.
[16] TAKAHASHI T, STRITTMATTER S M. Plexina1 autoin-hibition by the plexin sema domain[J]. Neuron, 2001,29(2):429-439.
