微生物比浊法测定妥布霉素地塞米松眼膏的效价*
2013-12-23王洪家郭福庆
王洪家,郭福庆
(1.天津市北辰区药品检验所,天津 300400; 2.天津市药品检验所,天津 300070)
妥布霉素为氨基糖苷类抗生素,妥布霉素地塞米松眼膏在国家药品标准中采用高效液相法测定其含量,本试验采用比浊法测定其效价,具有操作简便、结果精确、培养时间短等特点,可用于该制剂的质量控制。
1 仪器与试验材料
1.1 仪器 WBS -100 型微生物比浊法测定仪(北京先驱威峰技术开发公司)。
1.2 培养基 抗生素检定培养基Ⅲ号,pH 值7.0 ~7.2(北京奥博星生物技术有限公司,批号20080318);抗生素检定培养基Ⅰ号,pH 值7.8 ~8.0(青岛高科园海博生物技术有限公司,批号20060615);营养琼脂培养基(北京三药科技开发公司,批号080710)。
1.3 标准品 妥布霉素标准品(由中国药品生物制品检定所提供,批号0340 -200002,效价:880 U/mg),地塞米松对照品(由中国药品生物制品检定所提供,批号100129 -200804)。
1.4 试验菌 金黄色葡萄球菌[CMCC(B)26003]由中国药品生物制品检定所提供。
1.5 样品 妥布霉素地塞米松眼膏(由齐鲁制药有限公司提供,批号004007PF、207030TF、202009PF)。
2 方法与结果
2.1 试验用菌悬液的制备 取金黄色葡萄球菌接种于营养琼脂斜面培养基上,于37 ℃培养20 h,加灭菌生理盐水5 ml,将菌苔洗下制成菌悬液。
2.2 含试验菌培养基的制备 取试验用菌悬液约2 ml,加至400 ml 抗生素检定培养基Ⅲ号中,摇匀(此培养基培养3 ~4 h 吸光度在0.3 ~0.7 之间,剂距为1.5或2 的相邻剂量间的吸光度差值不少于0.1)。
2.3 标准品溶液的制备 精密称取妥布霉素标准品28.45 mg,置25 ml 量瓶中,加灭菌水稀释至刻度,摇匀,作为标准品储备液(1000 U/ml)。精密量取溶液5 ml,置50 ml 量瓶中,加水稀释至刻度,摇匀;再精密量取溶液5 ml,置50 ml 量瓶中,加pH 7.8 灭菌磷酸盐缓冲液稀释至刻度,摇匀,作为标准品溶液(10 U/ml)。
2.4 线性范围[1]取上述标准品溶液(10 U/ml),用pH 7.8 灭菌磷酸盐缓冲液,分别定量稀释制成每1 ml中含0.4、0.5、0.6、0.8 和1.0 U 的溶液,分别精密量取1.0 ml 于比色管中(每一浓度平行4 管,按拉丁方排列),在各比色管中精密加入含试验菌培养基9.0 ml,立即混匀,置比浊法测定仪中,37 ℃培养,于530 nm 在线测定各管吸光度,培养时间约为4 h。同时另取1 支比色管加入pH 7.8 灭菌磷酸盐缓冲液1.0 ml,精密加入含试验菌培养基9.0 ml,立即混匀,同法操作,作为细菌生长情况的阳性对照。
以浓度的对数值为横坐标,以吸光度平均值为纵坐标,进行线性回归,得回归方程:A = -0.95 log C +0.2758(r=0.9956)。结果表明,在0.4 ~1.0 U/ml 范围内浓度的对数值与吸光度呈良好的线性关系。
2.5 精密度试验 取批号为004007PF 的样品重复测定5 次,结果分别为100.4%、100.0%、99.2%、99.5%和98.9%,平均值为99.6%,RSD 为0.6%(n=5)。
2.6 回收率试验
2.6.1 供试品溶液制备 精密称取妥布霉素标准品23.68、29.27 和35.46 mg 共3 份,置25 ml 量瓶中,加水稀释至刻度,精密量取1 ml,加入含有厂家处方量辅料的50 ml 乙醚中,用水振摇提取5 次,每次15 ml,合并提取液至100 ml 量瓶中,作为供试品溶液(约为8、10 和12 U/ml)。
2.6.2 标准品溶液制备 精密称取妥布霉素标准品23.83、30.03 和35.24 mg,分别置25 ml 量瓶中,加水溶解并稀释至刻度,摇匀。精密量取上述溶液5 ml,置50 ml 量瓶中,再精密量取5 ml,置50 ml 量瓶中,加水稀释至刻度,摇匀,作为标准品溶液(约为8、10 和12 U/ml)。
2.6.3 回收率测定 取标准品溶液(约为8、10 和12 U/ml)和供试品溶液(约为8、10 和12 U/ml),分别用灭菌pH 7.8 磷酸盐缓冲液制成剂间比为1.5 的高低剂量的溶液(浓度应在线性范围),照妥布霉素“线性范围”项下方法测定,结果平均回收率为99.7%,RSD为0.9%,见表1。
2.7 专属性考查 称取妥布霉素地塞米松眼膏的辅料,按处方量配比制成不含妥布霉素的样品,按照“2.6.1”项下的方法制备阳性对照溶液。同时以1 ml pH 7.8 磷酸盐缓冲液代替被测供试液作为空白溶液。取上述两种溶液照妥布霉素“2.4”项下方法测定,结果空白对照液与阳性对照液吸光度比值分别为99.7%、100.1%、99.6%和99.5%,表明辅料对妥布霉素测定无干扰。
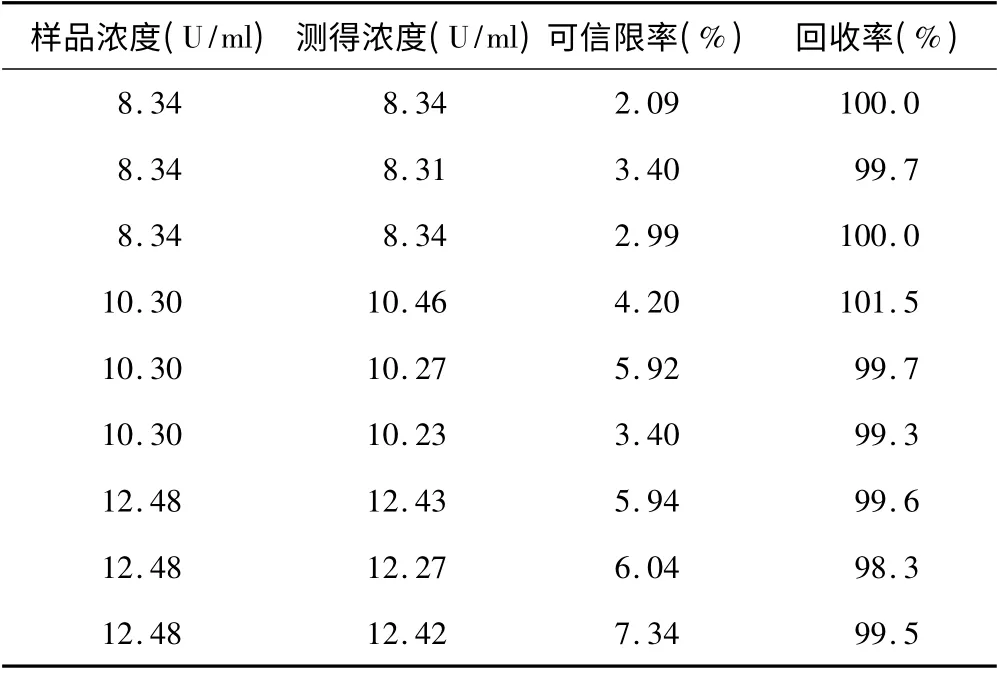
表1 回收率试验结果
3 样品测定
精密称取妥布霉素地塞米松眼膏约0.33 g,置100 ml 锥形瓶中,加入乙醚50 ml,超声使溶解,用水振摇提取5 次,每次15 ml,合并提取液至100 ml 量瓶中,摇匀,作为供试品储备液(10 U/ml)。分别精密量取供试品溶液和标准品溶液7.5 ml 和5.0 ml,置100 ml 量瓶中,用灭菌pH 7.8 磷酸盐缓冲液稀释至刻度,制成每1 ml 含0.75 U 和0.5 U 的高低剂量的溶液(剂距比为1.5∶ 1),照妥布霉素“2.4”项下方法测定,并与管碟法、HPLC 法测定结果比较,结果表明,三种方法的测定结果基本一致,结果见表2。
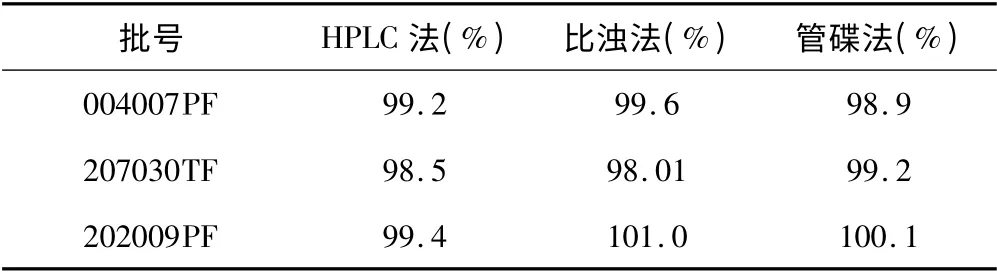
表2 比浊法与管碟法和HPLC 法测量结果比较
4 讨论
4.1 因抗生素类成分复杂,不易提纯,故比浊法较高效液相法更能客观地反映药品内在质量。
4.2 试验用菌种应保持新鲜、纯净,新制备的菌种斜面和菌悬液应在1 周内使用。如果染有杂菌,则可导致各比色管吸光度高低不一,可信限率高;如果菌种不新鲜,活力差,则可导致各比色管吸光度值极低或造成细菌停止生长。
4.3 溶液稀释用移液管应干净,避免因稀释造成的误差;比色管加入含试验菌培养基后,比色管壁上不得存有气泡,否则影响测量结果的准确性。
1 郭福庆,王洪家.微生物比浊法测定妥布霉素、硫酸妥布霉素注射液及妥布霉素滴眼液的效价[J].天津药学,2010,22(6):4
