WT1 异构体比例转变对人白血病细胞株HL-60增殖和凋亡的影响*
2013-12-23覃艳红张翠明乔爱秀李灵敏王宏伟
徐 菁, 覃艳红, 张翠明, 乔爱秀, 李灵敏, 王宏伟
(山西医科大学1病理教研室,2第二医院血液病研究所,3第二医院超声诊断科,山西 太原030001)
WT1(Wilms tumor 1)蛋白作为一种重要的转录 调控因子参与许多肿瘤特别是白血病的发生。WT1 mRNA 经过选择性剪接可以编码4 种同源异构体。在第5 外显子处,编码17 个氨基酸插入调控区与锌指区之间,可把WT1 蛋白分为17AA+及17AA-2 种异构体。在第9 外显子末端即第3 和第4 锌指结构之间插入KTS(Lys-Thr-Ser)3 个氨基酸,从而又可将WT1 表达蛋白分为KTS+和KTS-2 种异构体。通过不同的组合,可细分为4 种主要的剪接体,这4 种不同的含锌指结构的DNA 结合蛋白分别为17AA+/KTS+、17AA+/KTS-、17AA-/KTS+和 17AA-/KTS-。4 种异构体比例的严格平衡在细胞增殖、分化和凋亡的调节等方面起着重要作用[1-2]。
我们的前期工作证实人急性髓系白血病细胞系HL-60 中4 种WT1 异构体同时存在,在全反式维甲酸诱导分化前以17AA+/KTS+异构体为主,而分化后以17AA-/KTS-为主[3]。为了进一步明确WT1及其异构体在白血病中的作用,我们将WT1(17AA-/KTS-)异构体转染白血病细胞系HL-60 细胞,从而将HL-60 细胞中WT1 异构体表达的比例由17AA+/KTS+优势型转变为17AA-/KTS-优势型,探讨WT1 异构体比例的转变对HL-60 细胞增殖和凋亡的影响。
材 料 和 方 法
1 材料与试剂
PCDH1-MCS1-EF1-copGFP(简称PCDH1),全长约7.5 kb,为带有SV40 和PCMV 启动子、具有氨苄青霉素抗性基因的慢病毒质粒载体,其与大肠杆菌DH5α、白血病细胞系HL-60 细胞均为本实验室保存。三氧化二砷(As2O3)注射液购自哈尔滨伊达药业有限公司。RPMI-1640 培养液购自Gibco/BRL。限制性内切酶Xba Ⅰ、EcoRⅠ及荧光定量试剂盒等均购自TaKaRa。脂质体LipofectamineTM2000 购自Invitrogen,引物及探针为上海基康公司合成。针对WT1 蛋白C 末端的抗C-19 兔抗人多克隆抗体和羊抗兔Ⅱ抗为Santa Cruz 产品,MTT 购自Sigma,Annexin V/PI 凋亡检测试剂盒购自Coulter。
2 重组质粒PCDH1-WT1(17AA- /KTS-)的构建
根据WT1(17AA-/KTS-)异构体的全长cDNA序列,使用Primer 5.0 软件设计引物,分别在其上、下游引物5’端引入限制性内切酶EcoRⅠ和Xba I 识别位点,上游引物为5’-CCGGAATTCTCAAAGCGCCAGCTGGAG-3’,下游引物为5’-GCTCTAGAATGCAGGACCCGGCTTC-3’(下划线为引入的酶切位点);从HL-60 细胞中提取总RNA 并逆转录,以cDNA 为模板扩增全长WT1(17AA-/KTS-)基因序列,用限制性内切酶EcoRⅠ和XbaⅠ对纯化后的扩增产物和表达质粒PCDH1 进行双酶切,回收并纯化,T4 DNA 连接酶连接后转化至感受态细胞DH5α,氨苄青霉素筛选挑取单克隆菌落,扩增后提取质粒,进行酶切和测序鉴定。
3 质粒转染
采用LipofectamineTM2000 进行细胞转染,生长良好的HL-60 细胞于转染前24 h 接种到6 孔板中,待细胞总面积达到60% ~80%,取3 μg 重组质粒PCDH1-WT1(17AA-/KTS-)和空载体PCDH1 分别进行基因转染(具体操作按说明书进行),用600 mg/L G418 筛选具有抗性的细胞克隆,挑取克隆扩大培养。
4 实时荧光定量RT-PCR 检测
引物及探针自行设计,由上海基康公司合成,引物及探针序列为:总WT1 探针,5’-FAM-CGGAGCCCAATACA-MGB-3’,上游引物5’-GATAACCACACAACGCCCATC-3’,下 游 引 物 5’-CACGTCGCACATCCTGAATG-3’;17AA+探针:5’-FAM-CAGCACAGGGATCGAGA-MGB-3’,上 游 引 物 5’-TGGACAGAAGGGCAGAGCA-3’,下 游 引 物 5’-GGATGGGCGTTGTGTGGT-3’;KTS+探针,5’-FAM-TTCCGGTCCGACCA-MGB-3’,上游引物5’-CAAAAGACACCAAAGGAGACATACA-3 ’,下 游 引 物 5 ’-CTGAAGGGCTTTTCACTTGTTTTAC-3’;β-actin 探 针,5’-FAM-ATCATTGCTCCTCCTGAG-MGB-3’,上游引物5’-GCTCAAAAGACACCAAAGGAGAC-3’,下游引物 5 ’-AGCTGAAGGGCTTTTCACTTGTTT-3 ’。 将WT1/β-actin、17AA+/β-actin 和KTS+/β-actin 分别作为WT1 基因及17AA+、KTS+异构体的相对表达量。反应条件参见文献[3]。
5 Western blotting 检测蛋白表达
收集细胞各1 ×107,溶解于裂解缓冲液(PBS中含10 g/L NP40、5 g/L 脱氧胆酸钠、1 g/L SDS、1 mg/L 抑肽酶和100 mg/L PMSF),提取细胞总蛋白,Bradford 法定量蛋白,各取总蛋白45 μg 经12%SDS-PAGE 电泳,电转移至PVDF 膜,分别用WT1 抗体和β-actin 抗体(Abcam)杂交,洗膜后再与生物素化的Ⅱ抗结合,DAB 显色。采用Quantity One 软件进行图像灰度分析,计算WT1 异构体蛋白与β-actin的灰度比值以表示WT1 异构体的相对表达量。
6 MTT 实验
取对数生长期的正常HL-60 细胞、转染空质粒HL-60 细胞(以下简写为HL-60/CMV)和转染重组质粒细胞(以下简写为HL-60/WT1-/-),以1 ×104cells/well 种植于96 孔细胞培养板中,设对照组及加As2O3组(终浓度2 μmol/L),分别于培养0、24、48、72 和96 h 每孔加入5 g/L MTT 液20 μL,在37℃、5% CO2、饱和湿度下继续培养4 h 后加入DMSO 150 μL,振荡混匀。测定各孔在570 nm 的吸光度(A570),计算细胞生长抑制率,抑制率(%)=(1 -A转染组/A对照组)×100%。
7 细胞形态学观察
分对照组和加As2O3组(终浓度2 μmol/L),分别于培养24、48 和72 h 后收集细胞,涂片后瑞特-姬姆萨染色,光镜下观察细胞形态。
8 流式细胞术检测细胞凋亡
HL-60、HL-60/CMV 及HL-60/WT-/-单克隆细胞分为不加药组和加As2O3组,分别于培养24、48和72 h 后收集细胞,调整其浓度为1 ×109/L。根据Annexin V-FITC/PI 检测试剂盒说明,取100 μL 细胞悬液于试管中,依次加入Annexin V-FITC 5 μL 和PI 10 μL,混匀后于室温避光孵育30 min,在检测管中加入PBS 400 μL,上流式细胞仪检测。
9 统计学处理
应用SPSS 16.0 统计学软件处理数据。数据用均数±标准差(mean ±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD 法)。以P <0.05 为差异有统计学意义。
结 果
1 重组质粒PCDH1-WT1(17AA- /KTS-)的鉴定
重组质粒经EcoRⅠ和XbaⅠ双酶切后,进行1%琼脂糖凝胶电泳,可见样品的环状质粒样条带被酶切成2 条清晰的条带,大小分别为7 500 bp 和1 500 bp 左右,与目的片段WT1(17AA-/KTS-)(1 493 bp)和PCDH1 质粒(7 544 bp)的理论值大致相符,初步认定为所需阳性克隆构建成功,见图1。测序结果亦证实克隆出正确基因片段。

Figure 1. Identification of PCDH1-MCS1-EF1-copGFP recombinant vectors for WT1 isoforms. M:marker;1 and 2:PCR product of pCDH1;3 and 4:PCR product of pCDH1-WT1(17AA - /KTS - );3a and 4a:pCDH1-WT1(17AA - /KTS -)after enzyme digestion.图1 WT1 异构体插入慢病毒表达载体PCDH1-MCS1-EF1-copGFP 的PCR 和酶切鉴定
2 转染基因mRNA 的检测
HL-60/WT1-/-单克隆细胞中17AA-和KTS-异构体表达均增高,17AA+异构体比例由转染前的0.60 ±0.04 降到转染后的0.38 ±0.06;KTS+异构体比例由0.53 ±0.08 降至转染后96 h 的0.40 ±0.06,可见WT1 异构体表达的比例已由17AA+/KTS+优势型转变为17AA-/KTS-优势型,差异显著(P <0.05)。
3 转染基因在蛋白水平的表达
Western blotting 显示,转染WT1(17AA-/KTS-)异构体的单克隆细胞中WT1 (17AA-/KTS-)蛋白表达较对照组HL-60 和HL-60/CMV 明显增高(0.661 ±0.058 vs 0.295 ±0.070,0.661 ±0.058 vs 0.298 ± 0.025,P <0.05),阳 性 转 染 组 WT1(17AA+/KTS+)蛋白表达较对照组HL-60 和HL-60/CMV 明显降低(0.394 ±0.036 vs 0.498 ±0.039,0.394 ±0.036 vs 0.489 ±0.027,P <0.05),而对照组HL-60 和HL-60/CMV 之间差异无统计学意义(P>0.05),见图2、3。
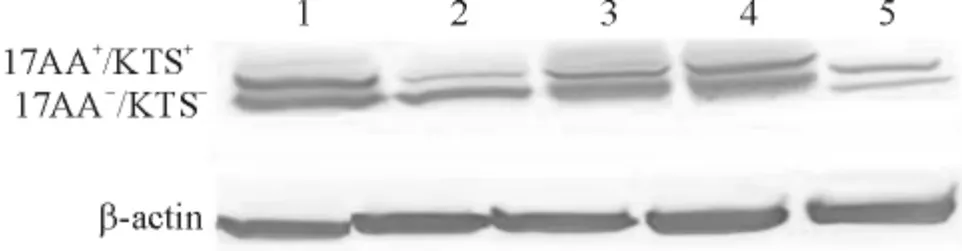
Figure 2. The expression of WT1 isoforms in HL-60 cells detected by Western blotting. 1 ~3:HL-60/WT - / -;4:HL-60;5:HL-60/CMV图2 Western blotting 检测HL-60 细胞中WT1 异构体的表达
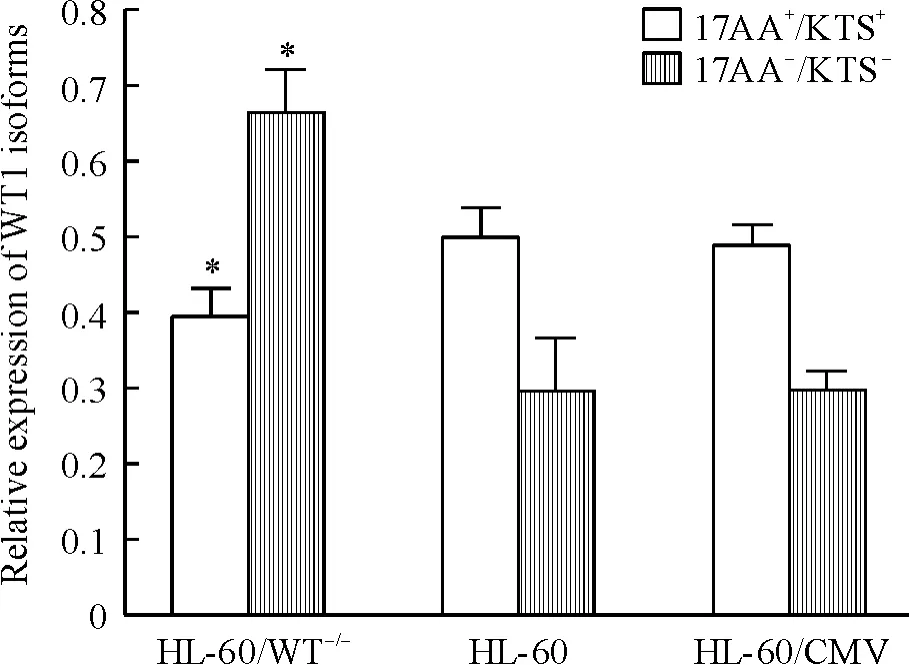
Figure 3. The relative expression of WT1 isoforms detected by Western blotting. Mean ± SD. n =3. * P <0.05 vs other groups.图3 Western blotting 检测WT1 异构体的表达水平
4 As2O3 对细胞的生长抑制作用
HL60/WT1-/-组的细胞生长抑制率均明显高于HL-60/CMV 及HL-60 组,差异显著,进一步提示转染WT1 (17AA-/KTS-)异构体能明显抑制HL-60细胞的增殖,见表1。
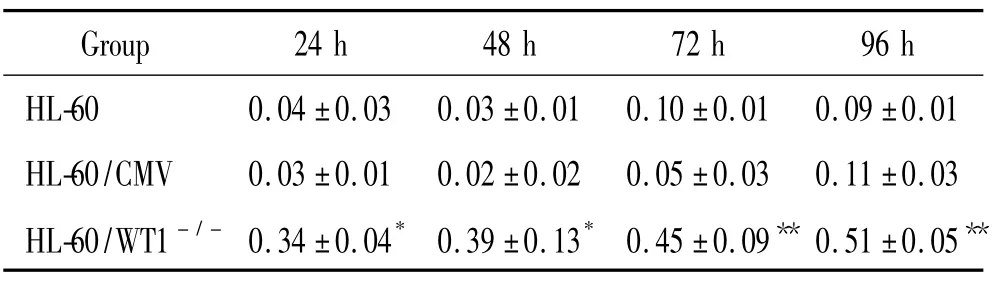
表1 MTT 法测定转染组与对照组在各时点的抑制率Table 1. Proliferation inhibitory rates at different time points measured by MTT (%.Mean±SD. n=3)
5 形态学检测
光镜下可见 HL-60、HL-60/CMV 和 HL-60/WT1-/-细胞核圆形,染色质均匀疏松。加As2O3培养24 h 形态变化不明显,处理48 h 后,各组细胞都出现了凋亡形态,细胞变形,胞膜完整,部分胞膜出现伪足样突起,核固缩,染色质凝聚于核周边,处理72 h 凋亡进一步加重;但凋亡形态改变以HL-60/WT1-/-更为明显,见图4。

Figure 4. Apoptosis of HL-60 cells shown by Wright-Giemsa staining (× 1 000). A:HL-60-cells;B:HL-60 cells treated with As2O3 for 72 h;C:HL-60/CMV cells treated with As2O3 for 72 h;D:HL-60/WT1 - / - cells treated with As2O3 for 72 h.图4 瑞特-姬姆萨染色观察HL-60 细胞的凋亡
6 细胞早期凋亡的变化
不加药物的2 组均以活细胞为主,仅有少量细胞凋亡。加As2O3(2 μmol/L)24 h 后,各组细胞Annexin V+/PI-亚群均增多,而HL-60/WT1-/-组Annexin V+/PI-亚群更明显多于HL-60/CMV 及HL-60组,差异有统计学意义(P <0.05),见图5、表2。此结果提示转染WT1(17AA-/KTS-)异构体能够增加HL-60 细胞对As2O3的敏感性,使As2O3对HL-60细胞的促凋亡作用更加明显。
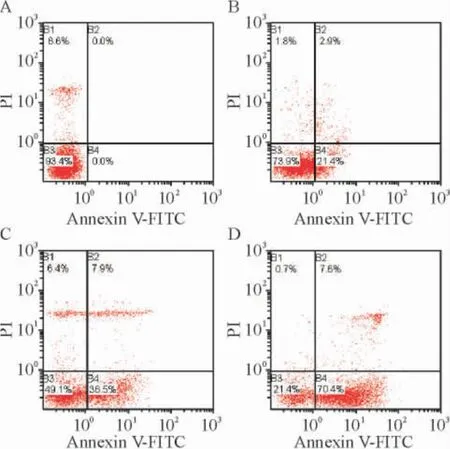
Figure 5. Early apoptotic rates of the transfected HL-60 cells analyzed by Annexin Ⅴ/PI double staining assay. A:HL-60 cells;B:HL-60 cells treated with As2O3 for 72 h;C:HL-60/CMV cells treated with As2O3 for 72 h;D:HL-60/WT1 - / - cells treated with As2O3 for 72 h.图5 AnnexinⅤ/PI 法检测转染细胞的凋亡
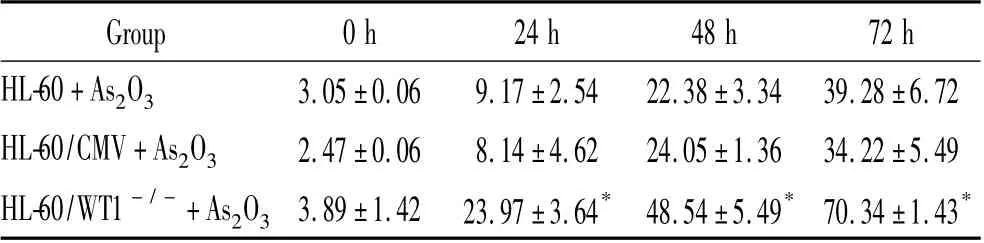
表2 As2O3 作用不同时间各组细胞的凋亡百分率Table 2. Apoptotic rates at different time points induced by As2O3(%. Mean±SD.n=3)
讨 论
WT1 为一种具有激活和抑制双重作用的转录因子,参与造血细胞增殖、分化和凋亡等过程的调控。近年来学者发现WT1 在各类白血病细胞中高表达,然而WT1 不同异构体的存在及其功能的不同使得研究变得复杂,要真正明确WT1 在白血病中的作用及其机制尚需结合异构体类型及比例作进一步深入探讨。
体外实验则表明WT1(KTS-)蛋白可通过调节一些基因如PDGFA、EGFR、PAX-2 和WT1 本身的表达而影响这些下游转录因子的活性及功能。有报道显示WT1(17AA-)既能激活也能抑制下游基因的转录,这取决于此基因上究竟有1 个还是2 个WT1 核蛋白的DNA 结合位点[4]。Richard 等[5]将WT1 的4种异构体分别转染至人胚肾293 细胞,发现仅17AA+异构体能抑制紫外线照射诱导的细胞凋亡,进一步显示了17AA+异构体在细胞凋亡中的抑制作用。Loeb 等[6]将WT1 (17AA-/KTS-)cDNA 转染鼠源性造血祖细胞32Dcl3 细胞,发现WT1(17AA-/KTS-)可以减慢细胞增殖,加速细胞分化,且减慢细胞周期。而Inoue 等[7]同样采用鼠源性32Dcl3 细胞,转染WT1(17AA+/KTS+)异构体,发现WT1(17AA+/KTS+)可以抑制细胞分化,促进细胞增殖。我们的实验通过将HL-60 细胞中WT1 异构体表达的比例由17AA+/KTS+优势型转变为17AA-/KTS-优势型,细胞增殖受到抑制,这与Loeb 等的实验结果基本一致。
目前对WT1 调节细胞凋亡的机制存在较多争论,一般认为WT1 通过与bcl-2、c-myc 等基因相互作用,在维持细胞增殖和凋亡之间的平衡起一定的作用。bcl-2 基因在细胞凋亡过程中起关键性作用,其第 2 外显子存在 WT1/EGR 结合的位点(GCGGGGGCG),WT1 通过调节bcl-2 的转录而参与细胞凋亡的调控[8]。新近研究表明WT1 调节细胞周期和凋亡途径,WT1 17AA+异构体在内源性凋亡途径中在线粒体上游某些位点起着抗凋亡作用[9-10]。Menke 等[11]将WT1 基因4 种异构体瞬间转染2 种肝癌细胞株,发现WT1(KTS-)可诱发细胞凋亡,而WT1(KTS+)则不能。我们的实验中转染WT1 (17AA-/KTS-)异构体能够增加HL-60 细胞对As2O3的敏感性,使As2O3对HL-60 细胞的促凋亡作用更加明显,这与Menke 等的研究结果大致相似。
综上,我们成功构建了稳定表达WT1 (17AA-/KTS-)的白血病细胞株HL-60,观察到HL-60 细胞中WT1 异构体的优势型转变为17AA-/KTS-后细胞增殖受抑制,对As2O3诱导的凋亡更加敏感,具体机制及其与增殖和凋亡相关基因之间的关系有待进一步研究。
[1] Lopotová T,Polák J,Schwarz J,et al. Expression of four major WT1 splicing variants in acute and chronic myeloid leukemia patients analyzed by newly developed four realtime RT PCRs[J]. Blood Cells Mol Dis,2012,49(1):41-47.
[2] Kramarzova K,Stuchly J,Willasch A,et al.Real-time PCR quantification of major Wilms’tumor gene 1(WT1)isoforms in acute myeloid leukemia,their characteristic expression patterns and possible functional consequences[J].Leukemia,2012,26(9):2086-2095.
[3] 徐 菁,王宏伟,杨 涛,等. 维甲酸诱导HL-60 细胞分化过程中WT1 基因表达及其异构体比例变化的研究[J]. 中华病理学杂志,2010,39(3):183-186.
[4] Gannon AM,Turner EC,Reid HM,et al. Regulated expression of the alpha isoform of the human thromboxane A2receptor during megakaryocyte differentiation:a coordinated role for WT1,Egr1,and Sp1[J]. J Mol Biol,2009,394(1):29-45.
[5] Richard DJ,Schumacher V,Royer-Pokora B,et al.Par4 is a coactivator for a splice isoform-specific transcriptional activation domain in WT1[J].Genes Dev,2001,15(3):328-339.
[6] Loeb DM,Summers JL,Burwell EA,et al.An isoform of the Wilms’tumor suppressor gene potentiates granulocytic differentiation[J]. Leukemia,2003,17(5):965-971.
[7] Inoue K,Tamaki H,Ogawa H,et al. Wilms’tumor gene(WT1)competes with differentiation-inducing signal in hematopoietic progenitor cells[J]. Blood,1998,91(8):2969-2976.
[8] 胡绍燕,陈子兴,顾伟英,等. WT1 基因增强子构建位点对WT1 基因启动子转录活性的影响[J]. 中国病理生理杂志,2008,24(2):209-214.
[9] Ito K,Oji Y,Tatsumi N,et al. Antiapoptotic function of 17AA(+)WT1 (Wilms’tumor gene)isoforms on the intrinsic apoptosis pathway[J]. Oncogene,2006,25(30):4217-4229.
[10]Gu W,Hu S,Chen Z,et al. High expression of WT1 gene in acute myeloid leukemias with more predominant WT1 +17AA isoforms at relapse[J]. Leuk Res,2010,34(1):46-49.
[11]Menke AL,Shvarts A,Riteco N,et al. Wilms’tumor 1-KTS isoforms induce p53-independent apoptosis that can be partially rescued by expression of the epidermal growth factor receptor or the insulin receptor[J]. Cancer Res,1997,57(7):1353-1363.
