肝纤维化大鼠肝脏中内质网应激相关分子CHOP 和TRB3 的表达变化*
2013-12-23杜锡潮谢汝佳
杜锡潮, 韩 冰, 谢汝佳, 邹 河, 杨 勤
(贵阳医学院病理生理教研室,贵州 贵阳550004)
近年研究显示,肝细胞凋亡是导致慢性肝损伤 肝纤维化的重要因素之一,而持续的内质网应激是导致肝细胞凋亡的重要途径。我们前期研究发现四氯化碳(carbon tetrachloride,CCl4)诱导肝纤维化过程中有明显的肝细胞凋亡和内质网应激,表现为肝纤维化组大鼠肝脏内质网应激蛋白葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)表达明显增加[1]。但肝纤维化发生发展过程中内质网应激如何引起肝细胞凋亡,其机制目前尚不清楚。有研究发现,内质网应激相关分子CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)和Tribbles 同源蛋白3(Tribbles homolog 3,TRB3)是内质网应激蛋白GRP78 下游的信号分子,在内质网应激介导细胞凋亡中发挥重要作用[2-3],但目前关于慢性肝损伤肝纤维化形成过程中内质网应激相关分子CHOP 和TRB3 的研究鲜有报道。因此本研究重点观察CCl4致大鼠肝纤维化发生过程中内质网应激相关信号分子CHOP 和TRB3表达的变化,探讨其在肝纤维化发生机制中的可能作用。
材 料 和 方 法
1 材料
1.1 主要试剂 CCl4(分析纯,成都金山化学试剂有限公司);活化转录因子6 (activating transcription factor 6,ATF6)和TRB3 多克隆Ⅰ抗(北京博奥森生物技术有限公司);CHOP 多克隆Ⅰ抗和β-actinⅠ抗(Cell Signaling);二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒、SABC(兔IgG)-POD 试剂盒和TUNEL 细胞凋亡检测试剂盒(武汉博士德生物工程有限公司);逆转录试剂盒(Fermentas);2 × SYBR Green I 试剂盒(Applied Biosystems);GAPDH、CHOP和TRB3 引物由大连宝生物科技公司设计合成;TRIzol (100 mL)试剂盒(Invitrogen);组织细胞裂解液和BCA 蛋白浓度测定试剂盒(北京鼎国昌盛生物科技有限责任公司);ECL 发光试剂(Millipore)。
1.2 动物分组 健康雄性Wistar 大鼠32 只,体重(180 ±20)g。大鼠适应性喂养1 周后随机分为:正常4 周组、正常8 周组、肝纤维化4 周组和肝纤维化8 周组,每组各8 只。
1.3 动物模型建立 新鲜配制40%CCl4植物油溶液,3 mL/kg 皮下注射,每隔3 d 注射1 次造模。分别在实验第4 周末和第8 周末股动脉放血处死相应各组大鼠,取部分肝组织切成3 mm ×1 mm ×1 mm 大小,固定于4%中性甲醛,其余肝组织于-70℃保存,用于real-time PCR 检测和Western blotting检测。
2 方法
2.1 肝组织病理形态学观察 常规石蜡包埋切片,行HE 染色,光镜下观察肝脏病理变化,并参照纤维化分级法[4]进行胶原纤维增生程度半定量分析。
2.2 免疫组化检测CHOP 和TRB3 蛋白表达 采用SABC 法严格按照试剂盒说明书操作。阴性对照以PBS 液代替Ⅰ抗。结果判定:光镜下观察棕黄色染成的细胞为阳性。200 倍下观察不少于5 个视野,记数阳性细胞个数及总细胞数,计算阳性细胞所占百分比(%)。
2.3 Western blotting 蛋白印迹分析 把冻存肝组织剪切成小块装入1.5 mL Eppendorf 管中,称重,按每20 mg 组织加200 μL 的比例加入裂解液,用匀浆器冰上匀浆5 min,4 ℃、12 000 r/min 离心10 min,取上清,严格按照BCA 蛋白浓度测定试剂盒操作说明测定样品总蛋白浓度。每孔上样60 μg,经10%SDSPAGE 分离,电泳结束后,湿转移法将蛋白条带转移至PVDF 膜上(Millipore),5%脱脂奶粉TTBS 溶液室温封闭1 h 后,分别加入ATF6 多克隆Ⅰ抗(1∶200)、CHOP 多克隆Ⅰ抗(1 ∶1 000)、TRB3 多克隆Ⅰ抗(1∶100)和β-actinⅠ抗(1∶1 000)置4 ℃冰箱振荡孵育过夜。TTBS 洗膜2 次后,加入HRP 标记的Ⅱ抗(1∶4 000)室温孵育1 h。TTBS 洗膜4 次后,ECL 化学发光试剂于暗室中显影,X 光胶片曝光,所得条带用凝胶图像分析系统扫描分析,目的蛋白的相对表达水平=目的蛋白的灰度值/β-actin 蛋白的灰度值。
2.4 Real-time PCR 检测CHOP 和TRB3 mRNA 按TRIzol (100 mL)试剂盒(Invitrogen)说明书提取大鼠肝脏的总RNA,采用紫外分光光度法进行质量控制并进行定量,逆转录合成cDNA,反应体系20 μL:总RNA 1 μg,5 ×PCR Buffer 4 μL,10 mmol/L dNTP 2 μL,10 μmol/L Oligo(dT)1 μL,RNase inhibitor 1 μL,MMLV 反转录酶1 μL,DEPC H2O 补足体积。反应条件:25 ℃10 min,48 ℃60 min,95 ℃5 min。Real-time PCR 反应体系25 μL:反转录产物2 μL,10 μmol/L 上、下游引物各1. 0 μL,2 × SYBR Green I 12.5 μL,DEPC H2O 补足体积。反应条件为50 ℃2 min,95 ℃10 min ,95 ℃15 s,60 ℃1 min,最后2 步重复40 个循环。以每例标本组织的目的片段与带内参照片段的循环阈值(Ct 值)的比值作为该标本基因表达的相对数值。GAPDH 上游引物 5'-GGAAGCTTGTCATCAATGG-3',下游引物5'-CTGTGGTCATGAGTCCTTC-3',扩增320 bp;CHOP 上游引物5'-CCTCGCTCTCCAGATTCCA-3',下游引物5'-CTCATTCTCCTGCTCCTTCTCC-3',扩增条带147 bp;TRB3 上游引物5'-TCAAGTTGCGTCGATTTGTCTTC-3',下游引物5'-CAGTCATCACACAGGCATCCTC-3',扩增条带84 bp。
2.5 TUNEL 检测肝脏细胞凋亡 取相应的组织切片常规脱蜡入水,滴加0.01 mol/L TBS 1∶200 新鲜稀释proteinase K,37 ℃消化10 min,0.01 mol/L TBS洗2 min×3 次,滴加标记缓冲液,置于湿盒中,37 ℃标记2 h,0.01 mol/L TBS 洗2 min ×3 次,滴加封闭液,37 ℃封闭30 min,甩掉封闭液,滴加用抗体稀释液1∶100 稀释生物素化抗地高辛抗体,37 ℃反应30 min,0.01 mol/L TBS 洗2 min ×3 次,滴加用抗体稀释液1∶100 稀释SABC-FITC + POD,37 ℃反应30 min,0.01 mol/L TBS 洗5 min×4 次,甘油封片,在荧光显微镜下观察明亮黄绿色为阳性细胞,200 倍下观察不少于5 个视野,记数阳性细胞个数及总细胞数,计算阳性细胞所占百分比(%)。
3 统计学处理
数据用SPSS 19.0 统计软件分析,计量资料以均数±标准差(mean ± SD)表示,均数比较用方差分析,病理学半定量结果采用秩和检验,以P <0.01 为差异有统计学意义。
结 果
1 各组大鼠肝脏病理学变化
经HE 染色镜下观察可见,正常组大鼠肝索和肝血窦以中央静脉为中心向周围呈放射状排列,无胶原纤维增生。肝纤维化4 周组大鼠主要表现为肝细胞脂肪变性,汇管区纤维结缔组织轻度增生。肝纤维化8 周组大鼠肝小叶结构破坏严重,肝索排列紊乱,汇管区纤维结缔组织大量增生,内有较多炎症细胞浸润,胶原纤维向肝实质延伸形成纤维间隔,包绕、分割正常肝组织,部分形成假小叶,纤维化程度较正常对照组明显加重(P <0.01),见图1 和表1。

Figure 1. HE staining of rat hepatic tissues in each group(×200). A:4-week normal group;B:8-week normal group;C:4-week liver fibrosis group;D:8-week liver fibrosis group.图1 各组大鼠肝组织HE 染色结果

表1 各组大鼠肝纤维化程度分级Table 1. Degree of hepatic fibrosis in rats of each group (n=8)
2 免疫组化染色结果
光镜下观察胞浆呈棕黄色者为阳性细胞。CHOP 和TRB3 蛋白在肝纤维化4 周和8 周组大鼠肝细胞阳性率均较正常组明显增高(P <0.01),肝纤维化8 周组大鼠肝细胞这2 种蛋白的阳性率较4 周组明显降低(P <0.01),见图2、3 和表2。
3 Western blotting 分析结果
各组大鼠肝脏均可检测到ATF6 蛋白,肝纤维化组大鼠肝脏p90ATF6表达量较正常组明显减少(P<0.01),p50ATF6 表达量较正常组明显增加(P <0.01),见图4;各组大鼠肝脏均可检测到CHOP 和TRB3 蛋白,肝纤维化4 周和8 周组大鼠肝脏CHOP和TRB3 蛋白表达均较正常组明显增加(P <0.01),肝纤维化8 周组肝脏CHOP 和TRB3 蛋白表达较4周组明显减少(P <0.01),见图5、6。
4 Real-time PCR 检测CHOP 和TRB3 mRNA 表达
各组大鼠肝脏均可检测到CHOP 和TRB3 mRNA 表达,肝纤维化4 周和8 周组大鼠肝脏CHOP 和TRB3 mRNA 表达均较正常组明显增加(P <0.01),肝纤维化8 周组CHOP 和TRB3 mRNA 表达量较4周组略有下降,但差异无统计学意义(P >0.05),见表3。

Figure 2. The expression of CHOP protein in liver tissues detected by SABC method (DAB staining,×200). A:4-week normal group;B:8-week normal group;C:4-week liver fibrosis group;D:8-week liver fibrosis group.图2 SABC 法检测肝脏CHOP 蛋白表达

Figure 3. The expression of TRB3 protein in liver tissues detected by SABC method (DAB staining,×200). A:4-week normal group;B:8-week normal group;C:4-week liver fibrosis group;D:8-week liver fibrosis group.图3 SABC 法检测肝脏TRB3 蛋白表达

表2 各组大鼠肝脏CHOP 和TRB3 蛋白表达比较Table 2. The expression of hepatic CHOP and TRB3 proteins in each group (%. Mean±SD.n=8)

Figure 4. The expression of ATF6 protein in liver tissues detected by Western blotting. 1:4-week normal group;2:8-week normal group;3:4-week liver fibrosis group;4:8-week liver fibrosis group. Mean ±SD. n =8. **P<0.01 vs normal groups.图4 Western blotting 检测肝脏ATF6 蛋白表达

Figure 5. The expression of CHOP protein in liver tissues detected by Western blotting. 1:4-week normal group;2:8-week normal group;3:4-week liver fibrosis group;4:8-week liver fibrosis group.Mean±SD. n=8. **P<0.01 vs normal groups;##P <0.01 vs 4-week liver fibrosis group.图5 Western blotting 检测肝脏CHOP 蛋白表达
5 TUNEL 检测肝脏细胞凋亡结果
荧光显微镜下观察细胞核呈明亮黄绿色者为凋亡细胞,肝纤维化4 周和8 周组肝细胞凋亡率均较正常组明显增高(P <0.01),肝纤维化8 周组肝细胞凋亡率较4 周组明显降低(P <0.01),见图7。

Figure 6. The expression of TRB3 protein in liver tissues detected by Western blotting. 1:4-week normal group;2:8-week normal group;3:4-week liver fibrosis group;4:8-week liver fibrosis group. Mean ± SD. n = 8.**P <0.01 vs normal groups;##P <0. 01 vs 4-week liver fibrosis group.图6 Western blotting 检测肝脏TRB3 蛋白表达
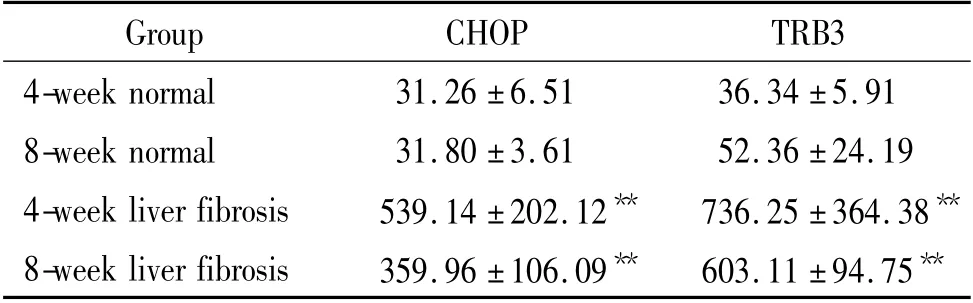
表3 各组大鼠肝脏CHOP 和TRB3 mRNA 表达比较Table 3. The expression of hepatic CHOP and TRB3 mRNA in each group (mean±SD.n=8)
讨 论
CHOP 又称生长停滞及DNA 损伤诱导蛋白153(growth arrest and DNA damage-inducible protein 153,GADD153),是一个特异性的内质网应激转导因子,属于CCAAT/增强子结合蛋白(CCAAT/enhancerbinding protein,C/EBP)转录因子家族成员[5]。近年来国内外研究结果显示,在正常情况下CHOP 主要存在于细胞浆中且表达量很低,而细胞处于应激状态时,通过IRE1-XBP1 和ATF6 通路可以上调CHOP表达,此外PERK-eIF2α 通路能选择性上调ATF4,通过ATF4 可激活CHOP 及氨基酸代谢、转运及氧化还原反应中的相关基因,导致CHOP 的表达量大大增加[6-8]。使用过表达和CHOP 基因定位突变技术的研究表明,在持续的内质网应激中CHOP 过表达可促进细胞凋亡的发生[9]。

Figure 7. Apoptotic hepatocytes detected by TUNEL staining(×200). A:4-week normal group;B:8-week normal group;C:4-week liver fibrosis group;D:8-week liver fibrosis group. Mean ±SD. n =8. **P <0.01 vs normal groups;##P <0.01 vs 4-week liver fibrosis group.图7 TUNEL 检测肝细胞凋亡
TRB3 是果蝇tribbles 基因的哺乳动物同源蛋白,在啮齿类动物中亦被称为神经元细胞死亡诱导假激酶(neuronal cell death-inducible putative kinase,NIPK)[10]。近年研究发现,在内质网应激信号通路中TRB3 属于下游因子,内质网应激时CHOP 可以与TRB3 启动子区域的一段33 bp 碱基重复序列结合而促进TRB3 基因的表达;抑制CHOP 表达会降低其对TRB3 表达的诱导作用[11],而不同原因引起的神经细胞内质网应激,细胞内CHOP 和TRB3 表达量明显增加,且与相关细胞凋亡有关[12-13]。此外最近的研究也发现,多种肝脏疾病如病毒性肝炎、酒精性肝病、非酒精性脂肪性肝病、药物性肝病、急性肝衰竭、肝癌等的发生发展也和内质网应激及其介导的细胞凋亡有关[14]。
目前关于慢性肝损伤肝纤维化过程中内质网应激相关分子CHOP 和TRB3 的研究鲜有报道。本课题组前期研究发现CCl4诱导肝纤维化形成过程中,内质网应激标志性蛋白GRP78 蛋白和mRNA 较正常组明显增加,且随时间延长增加更加显著,提示内质网应激参与了CCl4诱导的慢性肝损伤肝纤维化的形成[1]。本研究中我们发现,肝纤维化4 周组大鼠肝脏有明显的脂肪肝和肝纤维化形成,而肝纤维化8 周组大鼠肝脏纤维化更加明显,有假小叶形成;肝纤维化组大鼠肝脏p90ATF6 蛋白表达量较正常组明显减少,肝纤维化组大鼠肝脏p50ATF6 蛋白表达量较正常组明显增加。此外,肝纤维化大鼠肝组织中CHOP、TRB3 蛋白和mRNA 表达也较正常对照组显著增加,且变化趋势与肝细胞凋亡率一致。据此我们推测,CCl4进入肝细胞后,在肝细胞内代谢过程中产生大量氧自由基,导致肝细胞发生持续的内质网应激,ATF6 从GRP78 上解离,产生约90 kD 的ATF6 单体即p90ATF6[15],p90ATF6 随后进入高尔基体网腔[16]。在高尔基网腔特异性蛋白酶Site-1 及Site-2(S1P and S2P)作用下,切除p90ATF6 内质网跨膜结构域的附近区域,释放胞浆侧50 kD 的N 端ATF6 即p50ATF6[17]。p50ATF6 被转运至细胞核内,一方面促进GRP78 等分子伴侣表达[18],增强细胞对内质网应激的耐受能力;另一方面p50ATF6 与CHOP 基因的内质网应激反应元件结合,促进CHOP表达[19]。CHOP 进一步与TRB3 基因上的启动子区域结合诱导TRB3 表达,TRB3 一方面通过负反馈机制抑制CHOP 表达[20],使得肝纤维化8 周组大鼠肝脏CHOP 和TRB3 蛋白表达量较肝纤维化4 周组明显减少;另一方面TRB3 可能通过抑制Akt 磷酸化间接增加Bax 转运和线粒体膜通透性导致肝细胞凋亡[21],参与肝纤维化的发生发展。此外本研究还发现虽然与肝纤维化4 周组相比较,肝纤维化8 周组大鼠肝脏CHOP 和TRB3 mRNA 表达量降低不明显(P >0.05),但肝纤维化8 周组大鼠肝脏CHOP 和TRB3 蛋白表达量却比肝纤维化4 周组明显减少(P<0.01),造成这种基因和蛋白表达不同步,其原因可能是随着慢性肝损伤肝纤维化发生发展,机体内出现某些抗纤维化机制对CHOP 和TRB3 进行转录后调控,但具体机制还需进一步研究。
综上所述,内质网应激可能通过CHOP 和TRB3促进肝细胞凋亡参与肝纤维化发生发展。
[1] 温静静,谢汝佳,杨 勤,等. 肝纤维化大鼠肝细胞内质网形态及GRP78 蛋白表达的研究[J]. 中国病理生理杂志,2011,27 (11):2210-2213.
[2] Shen J,Snapp EL,Lippincott-Schwartz J,et al. Stable binding of ATF6 to BiP in the endoplasmic reticulum stress response[J]. Mol Cell Biol,2005,25 (3):921-932.
[3] Bromati CR,Lellis-Santos C,Yamanaka TS,et al. UPR induces transient burst of apoptosis in islets of early lactating rats through reduced AKT phosphorylation via ATF4/CHOP stimulation of TRB3 expression[J]. Am J Physiol Regul Integr Comp Physiol,2011,300(1):R92-R100.
[4] 杨 婷,谢汝佳,罗新华,等.丹芍化纤胶囊对肝纤维化大鼠肝脏Smads 分子表达的影响[J]. 中国病理生理杂志,2010,26(9):1807-1812.
[5] Oyadomari S,Mori M. Roles of CHOP/GADD153 in endoplasmic reticulum stress[J]. Cell Death Differ,2004,11(4):381-389.
[6] Ron D,Habener JF. CHOP,a novel developmentally regulated nuclear protein that dimerizes with transcription factor C/EBO and LAP and functions as a dominant-negative inhibitor of gene transcription[J]. Genes Dev,1992,6(3):439-453.
[7] Harding HP,Zhang Y,Zeng H,et al. An integrated stress response regulates amino acid metabolism and resistance to oxidative stress[J]. Mol Cell,2003,11(3):619-633.
[8] Pahl HL,Baeuerle PA. The ER-overload response:activation of NF-kappa B[J]. Trends Biochem Sci,1997,22(2):63-67.
[9] Yoneda T,Imaizumi K,Oono K,et al. Activation of caspase-12,an endoplastic reticulum (ER) resident caspase,through tumor necrosis factor receptor-associated factor 2-dependent mechanism in response to the ER stress[J].J Biol Chem,2001,276(17):13935-13940.
[10]Mayumi-Matsuda K,Kojima S,Suzuki H,et al. Identification of a novel kinase-like gene induced during neuronal cell death[J]. Biochem Biophys Res Commun,1999,258(2):260-264.
[11]Ohoka N,Yoshii S,Hattori T,et al. TRB3,a novel ER stress-inducible gene,is induced via ATF4-CHOP pathway and is involved in cell death[J]. EMBO J,2005,24 (6):1243-1255.
[12]闫 颖,赵咏梅,赵志伟,等. 内质网应激通路相关分子GRP78 及CHOP 在糖尿病小鼠海马表达的变化[J]. 首都医科大学学报,2011,32(1):90-94.
[13]Zou CG,Cao XZ,Zhao YS,et al. The molecular mechanism of endoplasmic reticulum stress-induced apoptosis in PC-12 neuronal cells:the protective effect of insulin-like growth factor Ⅰ[J]. Endocrinology,2009,150(1):277-285.
[14]王洪岩,刘晓珺,杜雅菊,等. 内质网应激与肝脏疾病研究进展[J]. 世界华人消化杂志,2012,20(6):451-459.
[15]Nadanaka S,Okada T,Yoshida H,et al. Role of disulfide bridges formed in the luminal domain of ATF6 in sensing endoplasmic reticulum stress[J]. Mol Cell Biol,2007,27(3):1027-1043.
[16]Shen J,Chen X,Hendershot L,et al. ER stress regulation of ATF6 localization by dissociantion of BiP/GRP78 binding and unmasking of Golgi localization signals[J].Dev Cell,2002,3(1):99-111.
[17]Ye J,Rawson RB,Komuro R,et al. ER stress induces cleavage of membrane-bound ATF6 by the same proteases that process SREBPs[J]. Mol Cell,2000,6(6):1355-1364.
[18] Teodoro T,Odisho T,Sidorova E,et al. Pancreatic βcells depend on basal expression of active ATF6α-p50 for cell survival even under nonstress conditions[J]. Am J Physiol Cell Physiol,2012,302(7):C992-C1003.
[19] Gotoh T,Oyadomari S,Mori K,et al. Nitric oxide-induced apoptosis in RAW 264.7 macrophages is mediated by endoplasmic reticulum stress pathway involving ATF6 and CHOP[J]. J Biol chem,2002,227(14):12343-12350.
[20]Jousse C,Deval C,Maurin AC,et al. TRB3 inhibits the transcriptional activation of stress-regulated genes by a negative feedback on the ATF4 pathway[J]. J Biol Chem,2007,282(21):15851-15861.
[21]Humphrey RK,Newcomb CJ,Yu D,et al. Mixed lineage kinase-3 stabilizes and functionally cooperates with TRIBBLES-3 to compromise mitochondrial integrity in cytokineinduced death of pancreatic beta cells[J]. J Biol Chem,2010,285(29):22426-22436.
