密骨打老儿丸含药血清对共育体系中成骨细胞和破骨细胞功能的影响*
2013-12-23武密山赵素芝任立中韩红伟
武密山, 赵素芝, 任立中, 王 茹, 白 霞, 韩红伟, 李 彬
(1河北医科大学中医学院方剂学教研室,河北 石家庄050091;2石家庄市桥东区胜北社区卫生服务中心,河北石家庄050041;3河北医科大学第一医院骨科,河北 石家庄050031;4 河北医科大学生物化学教研室,河北 石家庄050017)
研究表明,密骨打老儿丸(Migu-Dalaoer pill,MDP)能抑制由去卵巢、雌激素缺乏引发的骨转换增强,提高骨密度,纠正失衡的骨偶联[1]。考虑到骨代谢是成骨细胞(osteoblast,OB)与破骨细胞(osteoclast,OC)共同生活在一起的整体,OB 和OC 间的信息交流是影响骨代谢调控的重要环节,二者之间的信息交流对彼此功能的影响是骨代谢的重要方面,用MDP 含药血清对单纯成骨细胞干预实验并不能代表MDP 对骨代谢调控的真实情况,本实验设计更符合骨代谢微环境的成骨-破骨细胞共育体系,并用MDP 含药血清进行了干预,现将结果报告如下。
材 料 和 方 法
1 材料
1.1 动物 清洁级10 月龄雌性SD 大鼠40 只,体重(351.36 ±12.35)g ,由河北医科大学实验动物中心提供,合格证号为2011A018。普通级1 日龄SD新生大鼠,由河北医科大学实验动物中心提供,合格证号为2011B025。
1.2 药物 打老儿丸来源于《万氏家抄方·卷四》,组成是:石菖蒲、干山药、川牛膝、远志、巴戟天、川续断、五味子、楮实子、杜仲、山萸肉、茯神、熟地黄、小茴香、肉苁蓉、枸杞子各等分。打老儿丸加上具有促进成骨作用的淫羊藿[2]、骨碎补[3]、补骨脂[4]、菟丝子各等分,按照参照文献[1],制备MDP,每1 mL 药液含生药5.5 g,相当于临床用量的20 倍。
1.3 主要试剂 胰蛋白酶(Sigma),collagenase typeⅡ(Worthington),噻唑蓝、碱性磷酸酶(alkaline phosphate,ALP)试剂盒(Wako);DMEM 培养基(Gibco),胎牛血清(HyClone),α-minimal essential medium(α-MEM,Gibco),二甲基亚砜(DMSO)购自 Sigma Chemical Co,抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)试剂盒(Sigma),戊二醛、甲苯胺蓝为E. Merck 产品。其余普通试剂均为分析纯。
1.4 主要仪器 倒置相差显微镜(Olympus),CO2恒温培养箱(NuAire),96 孔培养板(Costar),35 mm 组织培养皿(Corning),紫外可见分光光度计(HP 8453);低温台式离心机(IEC),可调式移液器(Eppendorf),全自动酶标仪(Biohit),D-37520 型高速冷冻离心机(Beckman),0.22 μm 针式滤器(Costar),Leitz 1600 型锯式切片机(Leica),SB-3200D 超声波清洗仪(宁波新芝生物科技股份有限公司),XDS-1B型倒置相差显微镜(重庆光学仪器厂)。
2 方法
2.1 大鼠血清的制备 40 只10 月龄大鼠,随机分为2 组:(1)服药组:按1 g·kg-1灌服MDP,每天1次,连续3 d;(2)对照组:只灌服相同体积的生理盐水。第3 次灌胃1.5 h 后,所有大鼠均在乙醚麻醉下自腹主动脉抽取血液,同组合并后离心获取血清,血清在56 ℃灭活30 min,0.22 μm 滤膜过滤除菌后备用。参照本实验室方法[5],制备0.1 μmol·L–1、1 μmol·L–1和10 μmol·L–1(低、中、高剂量)的MDP 含药血清和生理盐水对照血清。
2.2 骨片的制备 参照文献[6],将新鲜牛股骨用金刚砂片及粗细金钢砂石制备成6 mm ×6 mm 大小,10 μm 厚的骨磨片,超声清洗2 次,各10 min,置入含1 ×106U/L 青霉素和1 g/L 链霉素的D-Hanks 缓冲液中浸泡,换液3 次,每次20 min。
2.3 OB 的分离与培养 取孕龄22 d SD 大鼠1只,处死后无菌操作取出14 只胎鼠的颅骨,参考Brighton 等[7]介绍的分段胶原酶消化法进行成骨细胞的分离。
2.4 OC 的分离与培养 参照文献[8],应用改良Fenton 等的方法,由1 日龄SD 大鼠四肢长骨分离OC。
2.5 成骨- 破骨细胞共育体系的建立 参照文献[9-10],对96 孔细胞培养板进行改装(图1)。即在距培养孔底部2 mm 处打孔(直径4 mm),使相邻的4 孔相通,中间加一层0.45 μm 的隔膜,膜与培养板接触处用3%琼脂糖凝胶密封,防止左右两室的细胞混杂,但培养上清可以经过隔膜相通。将制备好的培养板置于紫外线灯下照射消毒,备用。将OB 以5×103密度接种到96 孔细胞培养板的OB 培养室,3 h 后细胞已牢固贴于孔底;在培养板的OC 培养室中加入密度为5 ×103的新分离的OC,30 min 后可见细胞沉入孔底;小心加入培养基,漫过通道孔,使两侧培养上清相通;每4 h 将培养板倾斜5 次,促进双侧上清交流。待细胞周期同步化后,按实验要求进行培养。
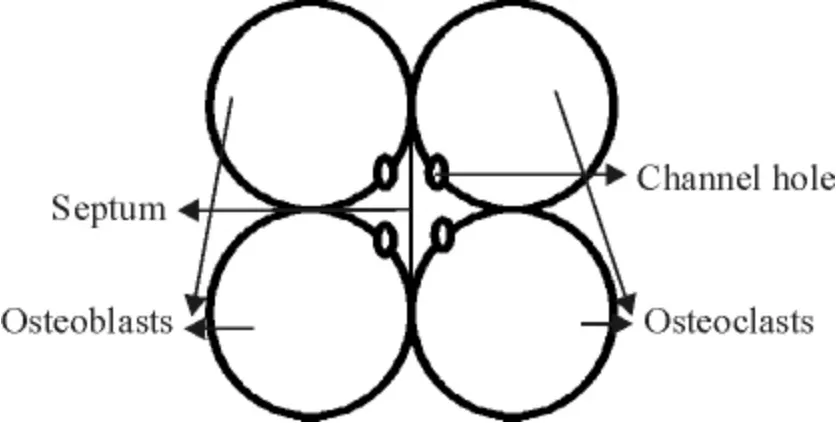
Figure 1. Osteoblast and osteoclast co-culture system.图1 成骨细胞-破骨细胞共育体系示意图
2.6 血清干预方法与分组 待上述成骨-破骨细胞共育体系的细胞周期同步化后,实验共分4 组,分别为:对照组(normal,加入相同质量浓度的对照大鼠血清)、MDP 含药血清低剂量组(L-MDP,加入0. 1 μmol·L–1MDP 含药血清)、MDP 含药血清中剂量组(M-MDP,加入1 μmol·L–1MDP 含药血清)和MDP 含药血清高剂量组(H-MDP,加入10 μmol·L–1MDP 含药血清),不同浓度培养组,每组药物浓度均设10 个平行孔,每孔加入相应DMEM 培养液200 μL 予以培养,每隔2 ~3 d 换液1 次。
2.7 MTT 法绘制OB 增殖生长曲线 将上述共育体系中OB 培养室的OB 分别于4、5、6、7 d 用0.25 g·L-1胰蛋白酶消化,1 ×108L-1接种于96 孔板,每天各取10 孔计数,每孔计数5 次,计算均值,连续4 d。以培养时间为横轴,细胞数为纵轴,描绘生长曲线。计算群体倍增时间(doubling time,TD):TD=t ×log2 /(logNt-logN0),N0和Nt分别代表接种后和培养t h 的细胞数。
2.8 OB 内ALP 活性测定 将上述共育体系中OB培养室的OB 分别于4、5、6、7 d 进行ALP 检测。方法如下:每天于同一时点取每个实验组10 个复孔,吸尽培养液,PBS 溶液洗3 次,每孔加入0. 2 %Triton X-100 100 μL,振荡30 min 后再加入反应液100 μL,37 ℃孵育30 min,最后每孔加入0.2 mol ·L-1NaOH 50 μL,终止反应,在酶标仪405 nm 波长下检测各孔的吸光度,每组取样本值的均数绘制各组ALP 随时间变化的曲线。
2.9 OC 骨吸收陷窝的计数 在上述共育体系中OC 培养室中加入吸附OC 骨磨片,小心加入培养基,漫过通道孔,使两侧培养上清相通;每4 h 将培养板倾斜5 次,促进双侧上清交流。分别于4、5、6、7 d 计数每个骨磨片上吸收陷窝数目。方法如下:取出骨磨片,2.5% 戊二醛固定液中于4 ℃固定7 min ,然后在0.25% NH3·H2O 溶液中超声清洗1 min,共3次,经系列乙醇脱水,自然晾干后,置甲苯胺蓝染液中,室温下染色3 ~4 min,蒸馏水清洗后于光镜下对整张骨磨片上的吸收陷窝有专人盲法进行计数。
2.10 OC 内TRAP 活性检测 将上述共育体系中OC 培养室的OC,分别于4、5、6、7 d 按照试剂盒说明进行TRAP 活性检测。
3 统计学处理
数据以均数±标准差(mean ±SD)表示。使用SPSS 11.5 统计软件,用方差分析处理,组间比较用单因素方差分析,以P <0.05 为差异有统计学意义。
结 果
1 密骨打老儿丸含药血清对共育体系中OB 增殖的影响
与对照组相比,MDP 含药血清低剂量组OB 的生长曲线无显著差异(P >0. 05)。MDP 含药血清中剂量组和高剂量组OB 的生长曲线在6 和7 d 与同一时段对照组相比较明显升高(P <0.01 ),见图2。
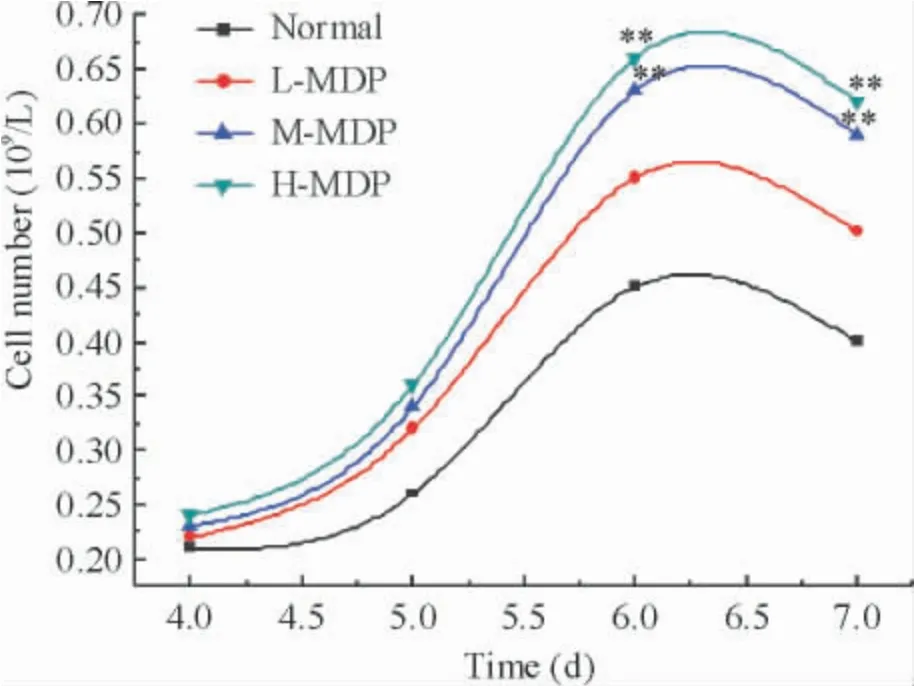
Figure 2. Effects of the serum containing MDP at different concentrations on osteoblast proliferation rate in osteoblast and osteoclast co-culture system at different time points. **P <0.01 vs normal.图2 不同浓度密骨打老儿丸含药血清对共育体系中OB 增殖的影响
2 密骨打老儿丸含药血清对共育体系中OB ALP活性的影响
与对照组相比,MDP 含药血清低剂量组OB 的ALP 活性无显著差异(P >0. 05)。MDP 含药血清中剂量组和高剂量组OB 的ALP 活性在6 和7 d 与同一时段对照组相比较明显升高(P <0.01),见图3。
3 密骨打老儿丸含药血清对共育体系中OC 骨吸收陷窝数目的影响
与对照组相比,MDP 含药血清低剂量组OC 的骨吸收陷窝数目无显著差异(P >0. 05)。MDP 含药血清中剂量组和高剂量组OC 的骨吸收陷窝数目在6 和7 d 与同一时段对照组相比较明显降低(P <0.01),见图4。
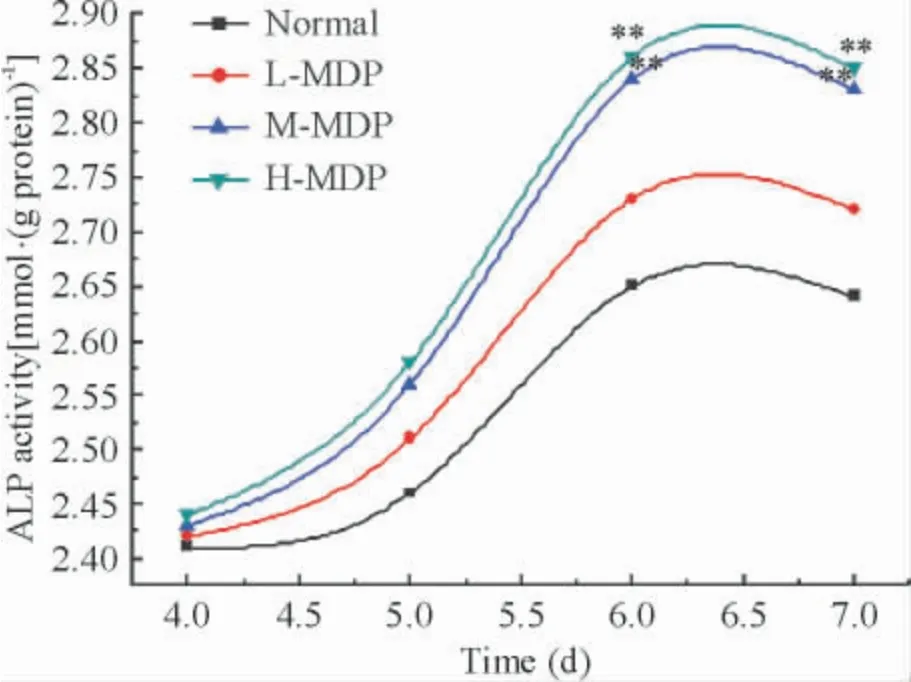
Figure 3. Effects of the serum containing MDP at different concentrations on ALP activity of osteoblasts in osteoblasts and osteoclast co-culture system at different time points. **P <0.01 vs normal.图3 不同浓度密骨打老儿丸含药血清对共育体系中OB 碱性磷酸酶活性的影响
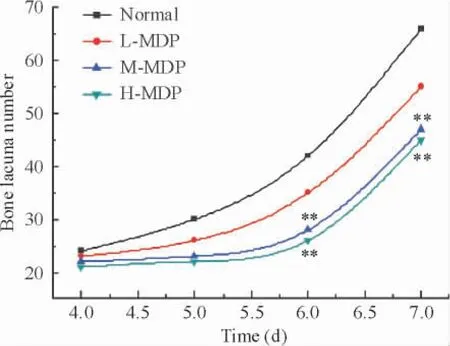
Figure 4. Effects of the serum containing MDP at different concentrations on the number of osteoclast bone absorption lacuna in osteoblast and osteoclast co-culture system at different time points. **P <0.01 vs normal.图4 不同浓度密骨打老儿丸含药血清对共育体系中OC 骨吸收陷窝数目的影响
4 密骨打老儿丸含药血清对共育体系中OC TRAP活性的影响
与对照组相比,MDP 含药血清低剂量组OC 的TRAP 活性无显著差异(P >0.05)。MDP 含药血清中剂量组和高剂量组OC 的TRAP 活性在6 和7 d与同一时段对照组相比较明显降低(P <0.01),见图5。
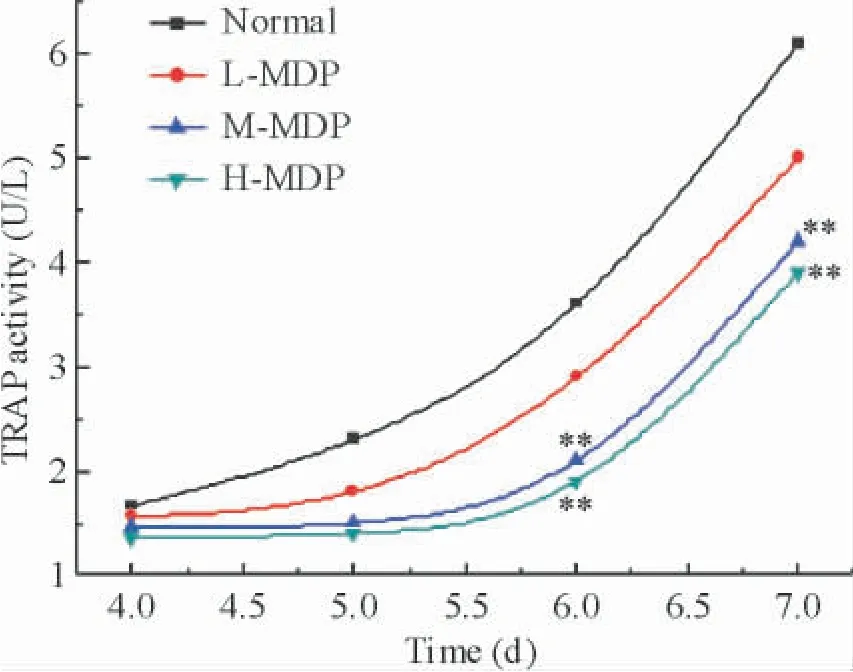
Figure 5. Effects of the serum containing MDP at different concentrations on TRAP activity of osteoclasts in osteoblasts and osteoclast co-culture system at different time points. **P <0.01 vs normal.图5 不同浓度密骨打老儿丸含药血清对共育体系中OCTRAP活性的影响
讨 论
OB 不仅分泌骨基质参与骨形成,也参与OC 骨吸收功能的调节[11]。正常骨重建起始于OC 激活,OC 性骨吸收伴随生命活动的始末,如果OC 异常活跃,可诱发骨质疏松症。ALP 是OB 分化时所分泌的酶,是OB 早期和中期分化的标志物[12],能够反映OB 合成Ⅰ型胶原、形成骨基质的能力。ALP 的活性体现OB 的成骨活性[13]。ALP 在体外钙化中起着关键性作用,其机制在于ALP 能够水解有机磷酸酶,使局部PO43-浓度升高,破坏钙化抑制剂,而启动钙化[14]。本实验显示,中、高浓度的MDP 含药血清组与对照组相比,ALP 合成增多,活性增强,证实MDP 含药血清能促进共育体系的OB 分化,刺激骨形成。
骨基质的降解需要多种溶酶体参与,TRAP 是酸性磷酸酶(acid phosphatase,ACP)的同工酶之一,直接参与OC 的骨吸收过程[15]。TRAP 标志着OC 的活性,血清中TRAP 是反映OC 功能、判断骨吸收的敏感特异性指标[16]。本实验显示,在成骨-破骨共育体系中,随着培养时间的延长,中、高浓度MDP 含药血清组和对照组相比,TRAP 活性都有所降低,提示MDP 含药血清有抑制共育体系中OC 分泌TRAP的能力。
OC 在骨重建过程中起着启动和先锋作用。OC有极强的溶骨能力,其功能过度活跃时,骨吸收亢进,在骨表面和较深处形成较多的凹陷、腔隙(howship 陷窝),甚至出现隧道,呈现骨质疏松。骨磨片上吸收陷窝是OC 骨吸收的直接结果,其陷窝数量、大小和深度直接反映了OC 的骨吸收能力。骨吸收陷窝光镜计数法是评价体外培养OC 骨吸收功能的定量可靠方法。本实验结果显示,在成骨-破骨共育体系中,中、高浓度的MDP 含药血清组骨吸收陷窝数目明显低于对照组。说明中、高浓度的MDP 含药血清能够对共育体系中OC 骨吸收功能有直接抑制作用,阻止骨丢失。
细胞信息交流(即细胞通讯,cell communication)存在长距通讯和短距通讯2 种方式,长距通讯以激素或生长因子为介质,通过血液循环和局部组织液的流动,将信息从一个细胞传到另一个细胞;短距通讯在相邻的细胞间形成直接通道,信息物质由此进行交流。骨组织代谢是由OB 和OC 分别承担的,处于骨形成和骨吸收不断更新和转换的动态平衡的骨重建活动中。OB 和OC 之间的功能活动并不是孤立存在的,二者之间的相互作用是骨代谢的直接调节因素。从单一OB 或OC 培养中获得的实验结果与在2 种细胞联合培养时不同[17]。建立培养上清可以相互交流,但OB 和OC 互不接触的共育模型更能反映骨代谢的实际情况。
本研究共育体系呈左右两室平行结构,能在倒置显微镜下观察2 种细胞的情况,可同时收集两室的OB 和OC 进行定量指标的检测;中间隔膜的孔径与双层式共育体系的孔径一样为0.45 μm,在此孔径下,蛋白质可以自由通过,而OB 和OC 因直径在30 μm 以上,不能越过滤隔膜,OB 和OC 分泌的蛋白质可以通过微孔滤膜影响对方的生物学功能。本实验中,OC 可以促进OB 增殖和分化,OB 也可以促进OC 骨吸收作用,即OB 和OC 具有相互促进功能,其途径是OC 分泌了某些蛋白质,弥散到隔膜的另一侧影响了OB 功能。这些蛋白质中是否含有某些新的信号分子,详细机制有待于进一步研究。
[1] 武密山,赵素芝,任立中,等. 密骨打老儿丸对去卵巢大鼠骨质疏松的影响[J]. 中成药,2013,35(1):5-11.
[2] 武密山,赵素芝,任立中,等. 淫羊藿苷对去卵巢大鼠骨和下丘脑不同核团ERβ mRNA 表达的影响[J]. 中国药理学通报,2011,27(1):29-33.
[3] 武密山,赵素芝,任立中,等. 柚皮苷对乳鼠成骨细胞增殖及c-fos、c-jun 表达的影响[J]. 中国药理学通报,2011,27(5):677-681.
[4] 武密山,赵素芝,任立中,等. 补骨脂素对成骨细胞核因子-κB 受体激活配体和骨保护素表达的影响[J]. 中国老年学杂志,2012,32(1):66-69.
[5] 武密山,李 恩,赵素芝,等. 补肾方含药血清对大鼠成骨细胞雌激素受体mRNA 及其蛋白表达的影响[J].中国药理学通报,2008,24(10):1396-1397.
[6] Arnett TR,Dempster DW. Effect of pH on bone resorption by rat osteoclasts in vitro[J]. Endocrinology,1986,119(1):119-124.
[7] Brighton CT,Strafford B,Gross SB,et al. The proliferative and synthetic response of isolated calvarial bone cells of rats to cyclic biaxial mechanical strain[J]. J Bone Joint Surg Am,1991,73(3):320-331.
[8] 高建军,金慰芳,王洪复. 骨片吸收陷窝光镜计数法定量测定破骨细胞功能[J]. 上海医科大学学报,1998 ,25(1):71-73.
[9] 杨德鸿,金大地,陈建庭,等. 共育体系中成骨细胞和破骨细胞生物学特性观察[J]. 中华骨科杂志,2001,21(11):676-680.
[10] Rodan GA,Martin TJ. Role of osteoblasts in hormonal control of bone resorption:a hypothesis[J]. Calcif Tissue Int,1981,33(4):349-351.
[11]Suda T,Takahashi N. Osteoblasts are essential for osteoclast formation[J]. Calcif Tissue Int,1989,44(1):45-47.
[12]Aubin JE. Advances in the osteoblast lineage[J]. Biochem Cell Boil,1998,76(6):899-910.
[13]Effenberger KE,Johnsen SA,Monroe DG,et al. Regulation of osteoblastic phenotype and gene expression by hop-derived phytoestrogens [J]. J Steroid Biochem Mol Biol,2005,96(5):387-399.
[14]Włodarski KH. Properties and origin of osteoblasts[J].Clin Orthop Relat Res,1990,(252):276-293.
[15] Yu X,Collin-Osdoby P,Osdoby P. SDF-1 increases recruitment of osteoclast precursors by upregulation of matrix metalloproteinase-9 activity[J]. Connect Tissue Res,2003,44(Suppl 1):79-84.
[16]Hayman AR ,Cox TM. Purple acid phosphatase of the human macrophage and osteoclast[J]. J Biol Chem,1994,269(2):1294-1300.
[17] Sugimoto T,Kanatani M,Kano J,et al. Effects of high calcium concentration on the functions and interactions of osteoblastic cells and monocytes and on the formation of osteoclast-like cells[J]. Bone Miner Res,1993,8(12):1445-1452.
