SnS2纳米片/氧化石墨烯复合材料的制备及其光催化性能研究
2013-12-22胡军成陶方琪于娟娟周贤龙魏仁杰
胡军成,杨 伟,陶方琪,于娟娟,罗 曼,周贤龙,魏仁杰,米 倩
(中南民族大学 催化材料科学湖北省暨国家民委-教育部共建重点实验室,武汉 430074)
近年来,TiO2作为光催化剂降解有机染料已成为研究的焦点,但由于TiO2带隙较宽(3.2 eV),只能在紫外光下表现出较高的活性,对波长大于420 nm的可见光不响应[1],这一缺陷限制了TiO2的使用范围.而SnS2作为一种n型半导体材料,能隙较窄(2.46 eV),对可见光有吸收,能更好地利用太阳光,克服了TiO2缺陷,因此被开发用作理想的光催化材料[2],其催化活性与SnS2纳米片的形貌、尺寸、结晶度、表面活性和缺陷有很大关系,其中最直接的影响因素是反应条件和合成方法[3].
氧化石墨烯(GO)具有准二维层状结构,片层上富含的大量·OH、·COOH、·C=O、环氧基等极性含氧官能团,赋予了其诸多化学活性点,易与具有较高表面活性的纳米硫化物结合生成硫化物/GO纳米复合材料[4].由于GO充当了电子的传导者和接受者,光诱导产生的空穴-电子对存在的寿命被延长,而空穴的存在是光氧化反应的核心,故空穴存在时间越长,催化活性越高[5]. GO可以采用廉价的石墨来制备[6],是一种比较理想的光催化剂掺杂材料.
基于SnS2在降解有机污染物方面的光催化活性和GO作为掺杂材料表现出来的独特复合效应,本文设计并合成了SnS2纳米片/GO复合材料,研究了不同GO掺杂量、不同反应时间得到的复合材料和纯SnS2在可见光下降解甲基橙溶液的性能.
1 实验部分
1.1 主要试剂与仪器
SnCl4·5H2O,硫脲(国药集团化学试剂有限公司),二次蒸馏水,无水乙醇,甲基橙(天津市科密欧化学试剂有限公司)
氙灯光降解装置(XQ-350W可调型,蓝晟电子有限公司),紫外-可见分光光度计(Lambda 35型,美国珀金/埃尔默公司),水热反应釜(PCF05-10型,招远松岭仪器设备有限公司),低温冷却液循环泵(DLSB-5L/25型,予华仪器有限公司),恒温油浴槽(DF-101S型,东玺制冷仪器有限公司),透射电子显微镜(Tecnai G20型,荷兰FEI公司),X-射线衍射仪(D8型,德国BRUKER公司),傅立叶红外光谱仪(Nicolet Nexus 470型,美国Thermo Nicolet公司).
1.2 氧化石墨的制备
该制备过程分为预处理、低温、中温、高温4步.预处理阶段在100 mL小烧杯中加入7.5 mL 浓H2SO4,2.5 g K2S2O8,2.5 g P2O5,当混合液温度到80℃时,加入5 g 石墨粉,搅拌3 h至均匀的浓稠浆液,冷却至室温,过滤洗涤,调pH至中性,烘箱中干燥备用.向三颈烧瓶中加入46 mL浓H2SO4、5 g预处理的石墨粉,再缓慢加入15 g KMnO4,使用循环冷却泵控制反应液温度在0℃以下,搅拌反应2 h得墨绿色的粘稠液,完成低温反应. 将低温反应的烧杯置于约35℃的恒温水浴中,搅拌保温3 h,得褐色混合液,完成中温反应.再加入100 mL去离子水,控制反应温度在98 ℃以下,继续搅拌30 min,高温反应结束,得棕黄色浓稠液,加入20 mL 30% H2O2,再用5% HCl、去离子水洗涤、离心,直至混合液成中性.干燥后研磨得到GO粉末.
1.3 SnS2和SnS2/GO复合材料的制备
称取1.218 g硫脲置于100 mL烧杯中,滴加50 mL去离子水溶解后加入1.4024 g SnCl4·5H2O,磁力搅拌得均匀的混合液. 另称取36.6 mg GO溶于30 mL去离子水中,超声分散20 min后将上述2种溶液混合均匀,搅拌2 h后,将所得到的悬浮液转移至水热反应釜中,180 ℃烘箱内反应24 h,取出反应釜于通风橱内自然冷却至室温,移出产物,用乙醇和去离子水分别洗涤3次并过滤至滤液变为无色.再将产物置于60 ℃的烘箱中干燥12 h,所得产物即为 SnS2-5% GO复合材料.
其他条件不变改变GO的用量0,18.8,73.2 mg得到产物分别标记为SnS2,SnS2-2.5% GO,SnS2-10% GO. 控制GO与SnS2的质量比为5%不变,改变反应时间12,36 h测试.
1.4 不同催化剂的光催化性能实验
配制50 mL的20 mg/L甲基橙溶液,加入50 mg的催化剂,超声分散10 min后,暗室中搅拌3 h使甲基橙吸附在催化剂表面并达到吸附平衡. 取出安装在磁力搅拌器上, 同时通入冷凝水,打开氙灯光降解仪,用可见光(λ>420 nm)照射. 每隔10 min取一次样,过滤出催化剂,直至滤液基本无色时再多取1次样. 使用紫外可见分光光度计对所得滤液进行光谱分析.
2 结果与讨论
2.1 X射线粉末衍射(XRD)
GO和纯SnS2的XRD衍射图谱见图1.图1(a)中10.9°、 42.7°处的衍射峰分别对应(001)、(100)晶面,为GO的特征峰. 由布拉格方程算得 GO的层间距为0.886 nm,较氧化石墨层间距更大,证明所得的产物为氧化石墨烯,而不是氧化石墨. 图1(b)中15.0 °、28.3 °、30.4°、32.2 °、42.0 °、46.3°、50.1 °、52.6 °、60.8 °等处的峰刚好与六方相SnS2(JCPDS No: 83-1075)晶体的(001)、(100)、(002)、(011)、(012)、(003)、(110)、(111)、(201)晶面相符,且图谱上没有杂质峰,各个产物的各晶面衍射峰较强,较尖锐,说明产物结晶生长较为完善,纯度较高.
不同GO掺杂量和不同反应时间制备的SnS2/GO复合材料的XRD图谱分别见图2和图3. 由图2、图3可见,所有产物的峰均与六方相SnS2(JCPDS No: 83-1075)晶体的各个晶面相吻合,且没有杂质峰,表明改变GO的掺杂量和反应时间,复合材料中的SnS2均为纯的六方相.
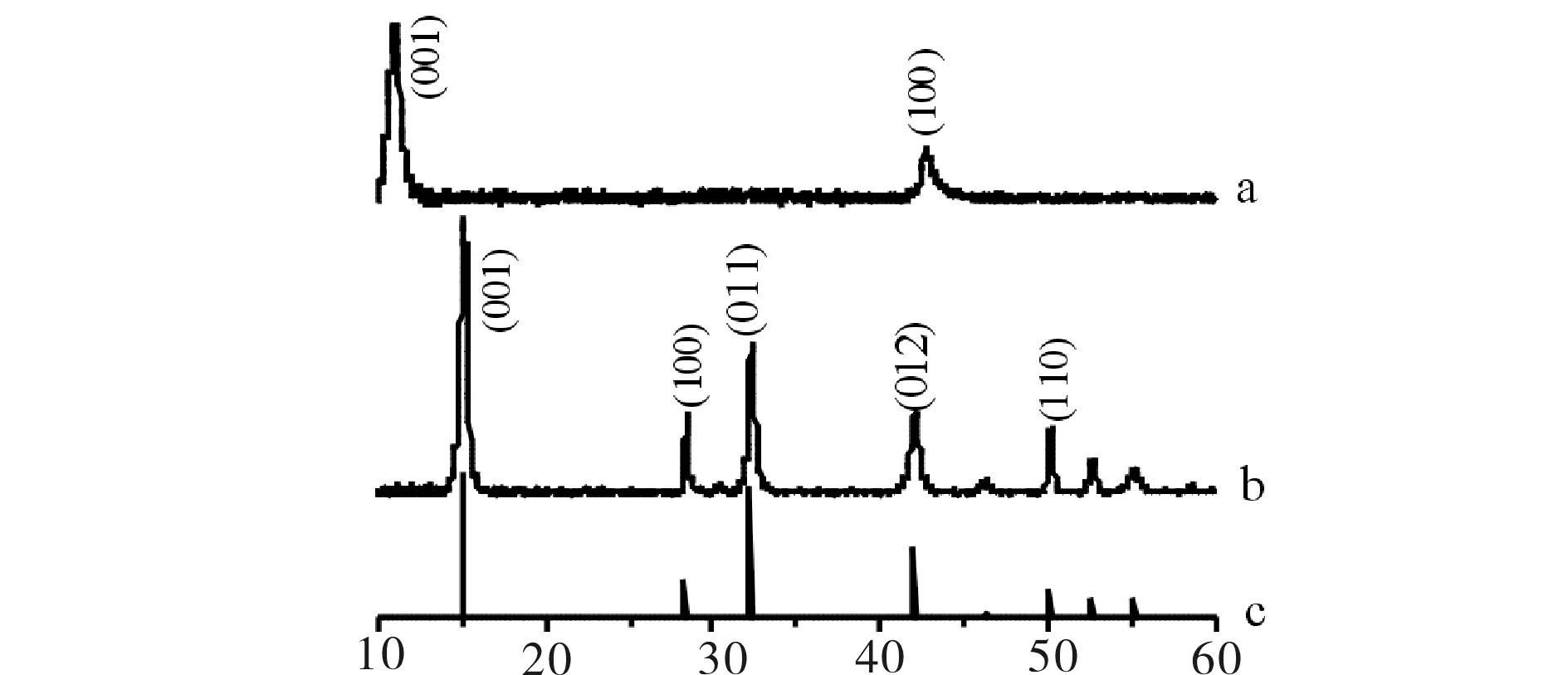
2θ(°)

2θ(°)

2θ(°)
2.2 紫外可见固体漫反射 (UV-Vis DRS)
为研究SnS2/GO复合材料的光吸收性能,用UV-Vis在200~800 nm范围内对纯SnS2和SnS2/GO复合材料样品进行漫反射测试,结果见图4.由图4可知,当λ>485 nm时,SnS2/GO复合材料相比纯SnS2表现出更强的吸光性能,为光催化反应提供更多的光生载流子,说明GO的加入对提高SnS2光催化性能有较大的影响.

λ/nm
2.3 红外光谱分析(IR)
GO、SnS2/GO复合材料和纯SnS2的红外光谱图见图5.由图5 (a)可见,GO在3425 cm-1附近出现了较强的C-OH和-OH基团伸缩振动特征吸收峰,在1719 cm-1附近出现了羰基C=O的伸缩振动特征吸收峰,在1628 cm-1附近出现较强的·OH基团弯曲振动特征吸收峰,1389 cm-1附近是水的-OH的弯曲振动吸收峰,均表明GO片层存在丰富的极性含氧基团.由图5(b)、(c)可见,SnS2/GO复合材料在3425 cm-1、1719 cm-1、1628 cm-1等处的特征吸收峰强度明显降低,而纯SnS2没有明显的特征红外吸收峰,说明在水热条件下,GO片间发生剥离,部分含氧基团脱落,同时SnS2纳米粒子发生扩散进入GO片层间,与上面的含氧基团逐渐络合,并随着反应的进行形成新的晶型[7].

σ/cm-1
2.4 透射电子显微镜(TEM)
GO、纯SnS2、SnS2/GO复合材料的TEM结果见图6. 由图6 (a)可见,经氧化后的石墨保持了片层结构.图6(b)为以硫脲和SnCl4·5H2O 为原料,水为反应介质,180℃反应24 h合成的纯SnS2,它具有规则的六边形纳米片状结构,边长约为200~250 nm,厚度约为20 nm,左上角可见SnS2纳米片组装在一起形成的团簇状结构.图6(c)为SnS2/GO复合材料,图中一片连续的浅色片状结构即为GO片,表面上负载有片状的SnS2,说明GO和SnS2结合的比较紧密,有助于提高光催化活性.
GO表面被多种极性含氧官能团修饰,使其层间距增大,在水热条件下容易剥离,层间距进一步增大,极性含氧基团的存在,使锡离子可以物理吸附的方式结合在这些活性点上.在较高的温度下,溶剂中硫脲释放出的硫离子与锡离子发生反应,在这些活性点上原位生成了硫化锡纳米颗粒,由于GO为SnS2的结晶提供了良好的平台,促进结晶成核过程[8],硫化锡的生长促进GO进一步被剥离,形成新的晶型,两者是相辅相成的关系.

a)GO;b)纯SnS2;c)SnS2/GO复合材料
3.4 催化剂对甲基橙光降解性能
为研究GO的加入对SnS2光催化活性影响,采用紫外可见分光光度计分别对纯SnS2和SnS2/GO复合材料降解染料所得的滤液定量分析,结果见图7.如图7(a)所示,纯SnS2降解20 mg/L甲基橙时,110 min可降解完全.图7(b)中掺杂5%GO反应36 h的SnS2/GO复合材料作催化剂时,25 min 时即可将20 mg/L的甲基橙降解完全. 对比可知,GO的加入使光降解活性显著增强.
不同催化剂对甲基橙的降解曲线如图8所示.由图8可知,随着GO掺杂量的增加,复合效应逐渐增强,SnS2/GO复合材料的光催化活性也随之增大,但当GO用量过大时,引起光散射,导致光量子效率下降,催化活性反而下降,当GO与SnS2质量比为5%时达最佳值. 水热反应时间对对样品的光催化性能也有很大的影响,当反应时间为36 h时,催化活性较佳,25 min即可将染料降解完全.

λ/nm λ/nm
推测SnS2/GO复合材料的降解机理如下:在可见光照射下,在SnS2纳米粒子价带上的电子较为活跃,获得足够的能量进入导带,在价带上留下电子空穴,而SnS2和GO结合得较紧密,故这些被光诱导的电子很容易被转移到GO片上,阻止了电子和空穴的重新复合[4],保证空穴具有一定相对的稳定性,吸附在催化剂表面的甲基橙被这些空穴氧化.GO的存在促进了SnS2的结晶过程,使得SnS2的结晶度提高,催化活性提高.

t/min
4 结论
(1)采用Hummers液相氧化法制备了GO,GO片层存在丰富的极性含氧基团,这些活性基团可与SnS2纳米粒子络合形成复合材料.
(2)以水为介质,采用硫脲作为硫源,通过水热法一步合成SnS2/GO复合材料. 并初步推测了SnS2纳米粒子与GO复合是由于SnS2扩散进入发生剥离的GO片层间并与上面基团逐渐络合而生成新的晶型.
(3)通过纯SnS2和SnS2/GO复合材料光降解性能的对比研究,说明GO的加入对提高光催化活性有显著影响,当GO与SnS2质量比为5%,反应时间为36 h时,光催化性能较佳.
[1] Rehman S,Ullah R,Butt A M,et al. Strategies of making TiO2and ZnO visible light active [J]. J Hazard Mater,2009,170(2-3): 560-569.
[2] Zhang Y C,Du Z N,Li K W,et al. Size-controlled hydrothermal synthesis of SnS2nanoparticles with high performance in visible light-driven photocatalytic degradation of aqueous methyl orange [J]. Sep Purif Technol,2011,81(1):101-107.
[3] Zhang Y C,Du Z N,Li S Y ,et al. Novel synthesis and high visible light photocatalytic activity of SnS2nanoflakes from SnCl2·2H2O and S powders [J]. Appl Catal B: Environ,2010,95 (1/2):153-159.
[4] Zhang N,Zhang Y H,Pan X Y,et al. Assembly of CdS nanoparticles on the two-dimensional graphene scaffold as visible-light-driven photocatalyst for selective organic transformation under ambient conditions [J]. J Phys Chem C,2011,115 (47): 23501-23511.
[5] Geim A K . Graphene: Status and Prospects [J]. Science,2009,324 (5934): 1530-1534.
[6] Hummers W S,Offeman R E. Preparation of graphitic oxide [J]. J Am Chem Soc,1958,80 (6):1339-1342.
[7] Ji L W,Song B,Lei J G,et al. Preparation and characterization of graphene/CdS nanocomposites [J]. Appl Surf Sci,2010,257 (3):747-751.
[8] Li Q,Yu J,Ran J,et al. Highly efficient visible-light-driven photocatalytic hydrogen production of CdS-cluster-decorated graphene nanosheets [J]. J Am Chem Soc,2011,133 (28): 10878-10884.
