一种新型蛋白类药物口服载体的海藻酸钠/巯基化果糖-壳聚糖复合水凝胶
2013-12-21张银叶代苗苗邱叶艳何所惧龚仁敏
张银叶, 代苗苗, 邱叶艳, 杜 艳, 何所惧, 龚仁敏
(安徽师范大学生命科学学院, 芜湖 241022)
近年来,蛋白质类药物非注射给药途径已成为药剂学研究的一个热点,这些途径包括眼部、鼻腔、肺部、直肠、口腔黏膜、口服给药等,其中口服给药是最便捷且最易被患者接受的给药方式,然而口服给药过程中存在的酶屏障、生理屏障、制药工艺屏障等均可导致蛋白质类药物的生物利用率降低[1-3]。各种口服蛋白质类药物载体被用来改善这类药物的生物利用率,其中物理交联等方法制备的高分子水凝胶微球,对外界环境变化可作出敏感的应答,可改善蛋白质、多肽在体内易变性降解的性质,在药物控、缓释等方面具有很好的应用前景[4-7]。
壳聚糖(Chitosan,CS)是一类由D-氨基葡萄糖和N-乙酰-D-氨基葡萄糖组成的碱性多糖,具有天然无毒、生物相容性好及可降解等特性[8],已经广泛应用于医药领域[9-11]。但是仅在酸性介质中溶解的性质影响了壳聚糖的用途,目前研究人员通过化学改性来提高其溶解性[12]。 海藻酸钠(Sodium Alginate,Alg)是一种由甘露糖醛酸(Mannuronic acid,M)与其立体异构体古洛糖醛酸(Guluronic acid,G)通过α-(1,4)糖苷键链接而成的亲水性多糖,具有良好的可降解性和生物相容性[13]和凝胶作用,在医药工程、新型药物载体、基因治疗[14-15]等领域有广泛应用。
本研究以果糖修饰壳聚糖改善其水溶性,再经半胱氨酸修饰成为巯基化果糖-壳聚糖,以增加其肠壁粘附性[16]。海藻酸钠与巯基化果糖-壳聚糖混合后,以氯化钙和硫酸钠双重交联制得复合水凝胶珠,研究了水凝胶珠的溶胀性质。以牛血清白蛋白(BSA)为模式蛋白进行了药物包载和释放的研究,以考察海藻酸钠/巯基化果糖-壳聚糖复合水凝胶作为蛋白类药物口服载体的可行性。
1 试剂与仪器
1.1 试剂
壳聚糖(CS,脱乙酰度>95.0%,日本兴洋化工有限公司),D-果糖(上海惠兴生化试剂有限公司),硼氢化钠(中国国药集团化学试剂有限公司),半胱氨酸(Cys,上海博舜生物科技有限公司),二环己基碳二亚胺(DCC,SCIENTIFIC)。4-二甲氨基吡啶(DMAP,购自美国sigma公司),二甲亚砜(DMSO,无锡市亚盛化工有限公司),海藻酸钠(Alg,购自美国sigma公司),透析袋MD36(截留分子量12000,美国联合碳化公司),牛血清蛋白(BSA,购自美国Sigma公司),其它试剂均为国产分析纯。
1.2 仪器
电子分析天平(上海精科实业有限公司),数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂),循环水式真空泵(巩义市予华仪器有限公司),增力电动搅拌机(JJ-2型,金坛市医疗仪器厂),恒温磁力搅拌器(79HW-1型,江苏省金坛市金城国胜实验仪器厂),UV-Vis分光光度计(754—PC型,上海菁华科技仪器有限公司),冷冻干燥机(美国LABCONCO公司),傅立叶变换红外光谱仪(Nexus 870 FT-IR型), 扫描电子显微镜(JSW-6390LV 日本电子)。
2 方法
2.1 果糖-壳聚糖的制备及溶解性的测定
在酸性条件下,果糖的羰基与壳聚糖的氨基脱水形成Schiff碱。RH-C=O+CS-NH2→RH-C= N-CS
称取4.5 g CS溶于100 mL 1%(V/V)的乙酸,加入8.879 g果糖,37 ℃条件下搅拌反应4~5 h后,加入硼氢化钠还原24 h,用95%乙醇终止反应,将析出产物用无水乙醇、乙醚洗涤3~4次,抽滤,烘干,得到果糖-壳聚糖。称取5 g壳聚糖或果糖-壳聚糖溶于50 mL蒸馏水,在37 ℃条件下缓慢振荡,每隔2 h抽滤、烘干,称重,分别测其溶解性。
2.2 巯基化果糖-壳聚糖(TFC)的制备及巯基测定
制备过程参照文献[17]。称取0.25 g Cys溶于50 mL DMSO,依次加入0.426 g DCC、0.194 g DMAP、1 g果糖-壳聚糖,常温反应24 h,将反应产物透析3次,每次2 d,最后用乙醚洗涤过滤,冷冻干燥,获得TFC。
用直接碘量法(2SH-+I2+3O2==HSO3+2I-)测定巯基含量:称取0.2 g TFC,溶于50 mL蒸馏水,加入5 g/L淀粉指示剂1 mL后,立即用0.005 mol/L I2标准溶液滴定至浅蓝色,计算出每克TFC中的巯基含量:
巯基含量(mmol/g) =2(CV)/W0
其中,C为I2的浓度,单位 mol/L; V为滴定消耗I2标准溶液的体积,单位mL;W0是巯基化果糖-壳聚糖的质量,单位g。
2.3 TFC的红外光谱的测定
用傅立叶红外光谱仪对TFC进行红外测试,采用KBr压片法。
2.4 Alg/TFC复合水凝胶的制备及溶胀实验
称取2.0 g Alg溶于100 mL蒸馏水,2.0 g TFC溶于100 mL 蒸馏水。按不同比例(Alg/TFC=9∶1、8∶2、7∶3、6∶4、5∶5)将Alg溶液加入TFC溶液中均匀混合,用注射器将Alg/TFC混合溶液缓慢滴入2%(W/V) CaCl2溶液,形成光滑的球形水凝胶珠,水凝胶珠在CaCl2溶液中搅拌交联1 h,充分洗涤后再浸入2%(W/V) Na2SO4溶液中搅拌交联0.5 h,用蒸馏水淋洗,过滤,收集,室温干燥至恒重,制得Alg/TFC复合水凝胶珠。
称取一定量(WO)的Alg/TFC样品分别置于3种缓冲溶液中(pH值1.2模拟胃环境、pH值6.8模拟小肠环境及pH值7.4模拟结肠环境),在37 ℃条件下缓慢振荡。特定时间间隔内分别取出凝胶珠样品,用滤纸吸去凝胶珠样品表面多余的水分,称重(Wt)。凝胶珠样品溶胀率S(t)的计算公式:
S(t) = (Wt-WO)/WO
其中,Wt与WO分别为凝胶珠样品的湿重和干重,单位:g。
2.5 Alg/TFC复合水凝胶珠红外光谱的测定
用傅立叶红外光谱仪对Alg、TFC和以Alg/TFC=7∶3比例的凝胶珠进行红外测试,采用KBr压片法。
2.6 Alg/TFC复合水凝胶珠形态结构的测定
取5种(Alg/TFC=9∶1、8∶2、7∶3、6∶4、5∶5)不同比例样品,用扫描电子显微镜(SEM)对其表面和剖面结构进行观察,离子渐射仪处理样品。
2.7 Alg/TFC水凝胶对BSA的包载及BSA的释放实验
称取2.0 g Alg溶于100 mL蒸馏水,2.0 g TFC溶于100 mL 蒸馏水中。按不同比例(Alg/TFC=9∶1、8∶2、7∶3、6∶4、5∶5)将Alg溶液加入TFC溶液中,同时加入0.4 g BSA均匀混合,用注射器将混合溶液缓慢滴入2%(W/V) CaCl2溶液,凝胶珠在CaCl2溶液中搅拌交联1 h,充分洗涤后再浸入2%(W/V) Na2SO4溶液中搅拌交联0.5 h,用蒸馏水淋洗,过滤,收集,室温干燥至恒重,制得载BSA的 Alg/TFC复合水凝胶珠。
称取0.2 g载BSA的凝胶珠样品,置于pH值7.4磷酸盐缓冲液,在室温条件下振荡24 h,将溶液离心后在280 nm处测定其吸光值,依据BSA标准曲线计算出溶液中BSA含量。按照下述公式计算包载率(LE):
LE(%)=(凝胶珠中包载的BSA的总量/实验中使用的BSA的总量)×100%
称取0.2 g载BSA的凝胶珠样品加入20 mL的模拟胃液(SGF pH值1.2)、肠液(SIF pH值6.8)、结肠液(SCF pH值7.4)中,在37 ℃条件下缓慢振荡,在一定的时间间隔内取5 mL在波长280 nm处测定其吸光值,同时补充等量的模拟溶液。BSA的累计释放量通过标准曲线计算获得,进行3次重复实验。
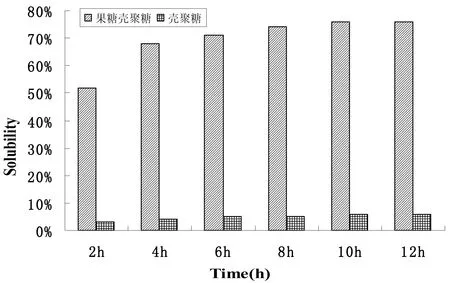
图1 壳聚糖和果糖壳聚糖的溶解性
3 结果与讨论
3.1 溶解性的测定结果及分析
实验结果如图1所示,10 h后达到溶解平衡,壳聚糖的溶解性只有6%左右,而果糖-壳聚糖的溶解性高达76%左右,是壳聚糖的12倍,由此可见改性的果糖-壳聚糖的溶解性提高。这主要是因为壳聚糖引入了含有亲水性基团的果糖,同时破坏了壳聚糖分子间的氢键作用,从而提高了其溶解性。
3.2 TFC中巯基的测定结果及TFC的红外光谱分析
巯基含量测定,重复实验3次,取其平均值,得巯基含量为0.95 mmol/g。TFC红外光谱测定结果如图2所示,在1700 cm-1~1750 cm-1处出现一个较强吸收峰,说明TFC中含有酯键。另外,在2400 cm-1~2500 cm-1附近,TFC(b)曲线与CS(a) 曲线相比有微弱的吸收峰,此峰为巯基的特征吸收峰。以上结果说明TFC已成功合成。
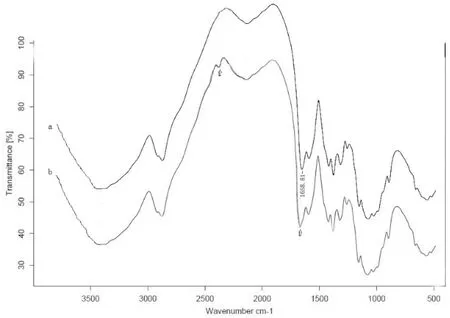
图2 CS (a)和TFC (b)的红外光谱
3.3 Alg/TFC复合水凝胶珠红外光谱的测定
Alg/TFC凝胶珠、Alg及TFC的红外光谱如图3所示,比较3者的红外光谱,Alg/TFC凝胶珠红外光谱中波数1609 cm-1处Alg羧基的不对称震动吸收峰明显减弱且向高波数移动(蓝移),另外波数1569 cm-1处CS氨基的特征性剪切震动吸收峰明显减弱。
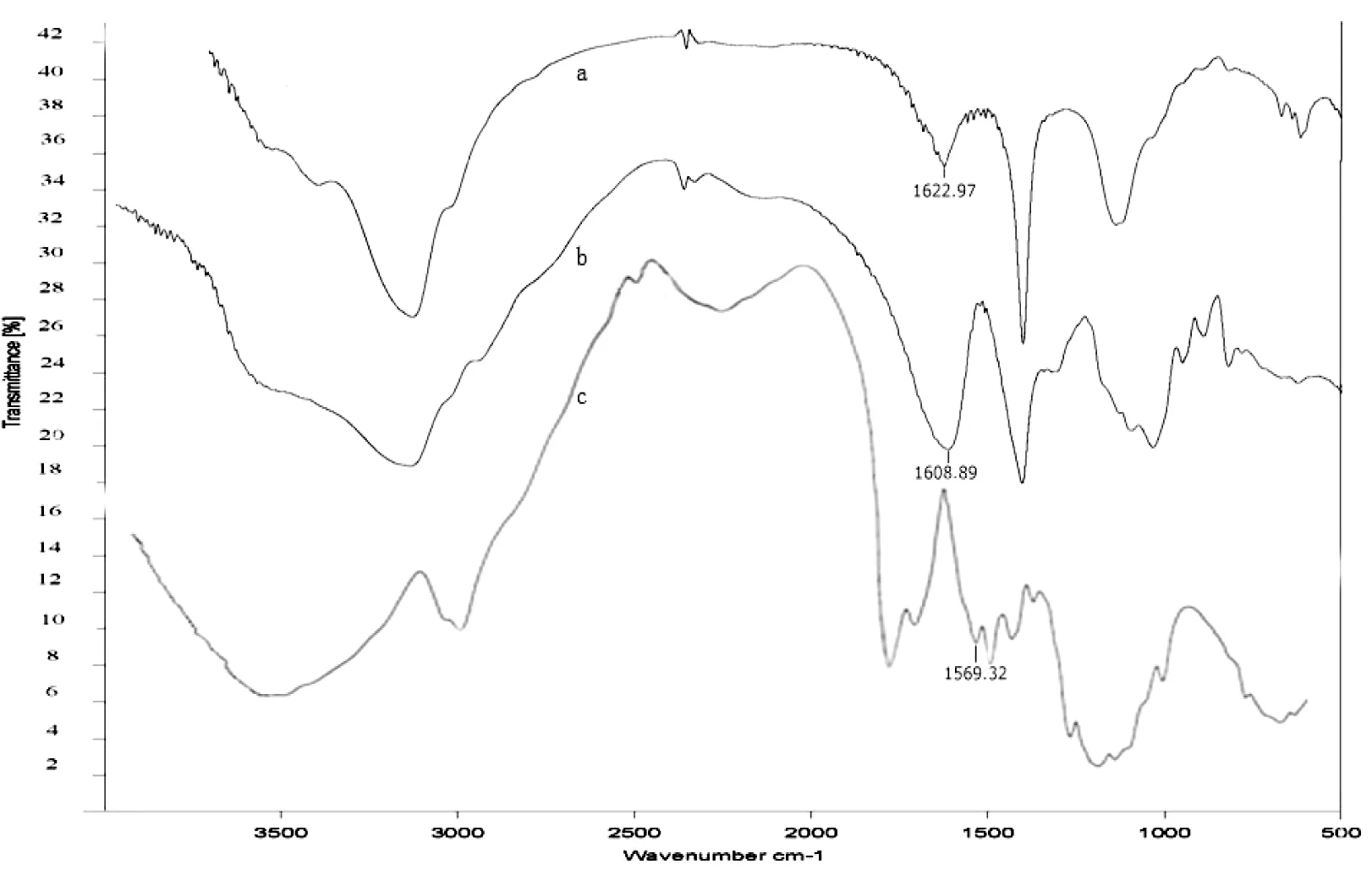
图3 Alg/TFC(7∶3)凝胶珠(a)、Alg(b) 和TFC(c)的红外光谱
3.4 Alg/TFC复合水凝胶珠形态结构特征
不同比例Alg/TFC复合水凝胶珠SEM如图4所示。Alg/TFC=9∶1、8∶2、7∶3、6∶4、5∶5这几种比例样品的表面和剖面结构形态特征明显。
A(A1-A5)组所示的是不同样品的表面结构,发现随着TFC含量的增加,凝胶珠中褶皱增多,这是由于Alg带有负电荷,而TFC带有正电荷,带有两种相反电荷的聚电解质相互混和时就会形成聚电解质复合物,形成了纤维状的网络结构[18]。
B(B1-B5)组所示的是不同样品的剖面结构,发现随着TFC含量的增加,凝胶珠中褶皱增多,其微小细孔增多,Alg与TFC之间相反电荷的相互使得内部的网状结构更加致密,微小细孔更多。

A组—凝胶珠的表面;B组—凝胶珠的剖面;1~5—Alg/TFC=9∶1、8∶2、7∶3、6∶4、5∶5的不同比例。
3.5 Alg/TFC水凝胶珠的溶胀特性
Alg/TFC水凝胶珠的溶胀率如图5所示。pH值1.2的溶胀特性如图5-A所示,是体外模拟胃环境(SGF)。溶胀率随着TFC在复合水凝胶珠中比例的增加而增加,但溶胀率都比较低,这是因为Alg在酸性较强时,分子之间能够形成氢键,使分子间的作用力增强,故溶胀率较低。

图5 Alg/TFC在SGF(A)、SIF(B)和SCF(C)中的溶胀率
pH值6.8和pH值7.4的溶胀特性分别如图5-B、5-C所示,是分别体外模拟小肠环境(SIF)和结肠环境(SCF)。溶胀率是随着TFC在复合水凝胶中比例的增加而降低。其中Alg/TFC=9∶1的凝胶珠在溶胀60 min后即崩解,是因为Alg含量多,在小肠和结肠环境中,分子间不能形成氢键,且相互排斥,故易于崩解。但Alg/TFC其它比例的凝胶珠溶胀缓慢,这是因为在小肠和结肠环境中,随着TFC在Alg/TFC中比例的增加,Alg带有的负电荷和TFC带有的正电荷相互作用力增加,使得形成的结构致密。其次从SEM图中可知,随着TFC含量的增加,水凝胶珠中的褶皱增多,因此不会迅速崩解。结果表明:Alg/TFC复合水凝胶珠样品在pH值6.8和pH值7.4时的溶胀率分别是pH值1.2时的7倍和10倍左右。
3.6 BSA包载率测定
BSA的包载率如图6所示,假定在24 h内,凝胶珠中包载的BSA完全释放。当BSA的重量占到凝胶珠的20%时,包载率可达到94%以上,同时随着TFC在凝胶珠中总量比例的增加,BSA的包载率也有所上升。这是因为BSA与凝胶载体间特殊的离子环境促成的,凝胶珠包载BSA时的弱酸性条件(pH值5.0)很特别,它高于BSA的等电点(4.7)[19],却低于壳聚糖链上氨基的pKa值(6.3)[20]。在这种情况下,带负电荷的BSA就会和壳聚糖链上带正电荷的氨基通过静电吸引完成包载。

图6 Alg/TFC复合凝胶珠中BSA的包载率
3.7 BSA的体外释放
不同环境体外模拟测定BSA的释放率如图7所示。pH值1.2 BSA控制释放如图7-A所示,是体外模拟胃环境(SGF)。不同比例样品的释放率均相对较低,2 h内只有6%~10%的BSA从凝胶珠中释放出来,之后其累积释放量的增加量基本保持不变。这与pH值1.2的溶胀率有关,溶胀低,BSA的释放率也低。pH值6.8 BSA控制释放如图7-B所示,是体外模拟小肠环境(SIF)。Alg/TFC=9∶1的释放率在45 min内就达到了70%,而Alg/TFC=5∶5的释放率在2 h后才达到70%。由不同比例样品的SEM图可知,随着TFC的增加,水凝胶珠的褶皱增多,其网状结构增加,使微孔更加细小;又由同pH值下不同样品溶胀率可知,随着样品的溶胀,药物就会溶于水,从载体中释放出来,同时随着TFC的增加,BSA的溶胀率降低;另外,TFC与BSA之间的疏水作用可形成网状结构,随着TFC的增加,凝胶珠与BSA的结合更加紧密。因此,不同比例的样品中,随着TFC含量的增加,药物释放均相对缓慢。其中Alg/TFC=5∶5的释放率最缓慢,达到药物控制释放的要求。不同样品的释放率达到75%左右,并没有达到90%以上,这与pH值6.8环境下的溶胀率有关。pH值7.4 BSA的控制释放如图7-C所示,是体外模拟结肠环境(SCF)。在不同的时间内,BSA的释放率曲线基本与pH值6.8的释放率曲线一致。区别是此pH值下,3 h后BSA的释放率达到了90%以上。这是因为不同比例样品pH值7.4的溶胀率比pH值6.8的溶胀率高。
为了更好地体外模拟胃肠道,我们把Alg/TFC复合水凝胶珠先放入SGF中,然后再放入SCF中,测量BSA的累积释放率。如图7-D所示,发现BSA在SCF中的累积释放率明显高于在SGF中的释放率。这是因为BSA的释放与凝胶珠的溶胀率及其结构有关。
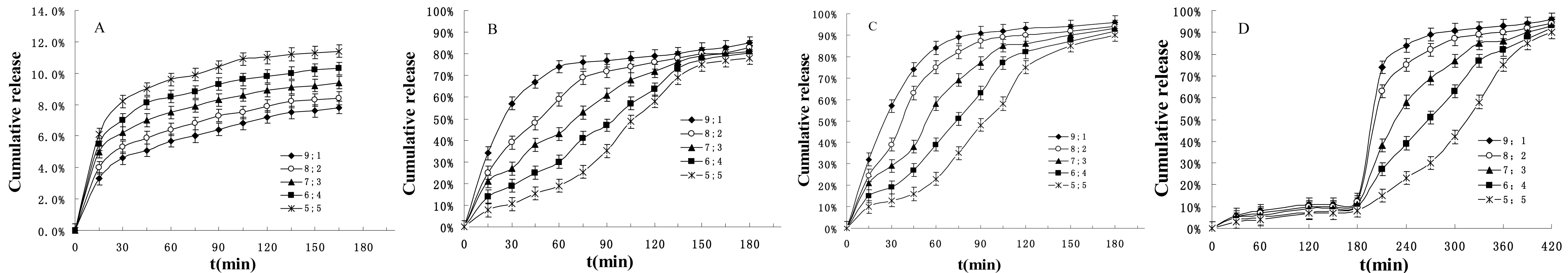
图7 复合凝胶珠中BSA在不同环境中的累积释放率
4 结果
壳聚糖与天然多糖Alg都具有良好的生物相容性和生物可降解性,并且价格低廉,易于生产,近年来常被广泛用于药物剂型中。本研究采用果糖修饰壳聚糖,极大地改善了壳聚糖的水溶性,再用半胱氨酸修饰果糖-壳聚糖,使其巯基化,以增加肠道的粘附性,从而增加肠道对蛋白类药物的吸收;最后用Alg和TFC的混合溶液在CaCl2和Na2SO4溶液中复合交联制备凝胶珠,通过对其溶胀率和载BSA的包载率及释放率的研究表明:在酸性条件下基本不溶胀崩解,而在近中性pH下可以缓慢溶胀,从而可以达到药物控释的作用。因此这种复合交联的凝胶珠可作为一种潜在的口服蛋白类药物载体。
5 展望
本实验采用果糖修饰壳聚糖,使其溶解性得到很大改善,但是还不能做到使壳聚糖完全溶于水,今后可以用其他的方法改性壳聚糖,使其水溶性进一步提高甚至能够完全水溶。用半胱氨酸修饰果糖-壳聚糖使其巯基化,以增加肠道的粘附性,从而增加肠道对蛋白类药物的吸收,对于本实验是否能更好地增加对蛋白类药物的吸收,并没有用肠粘膜细胞来进一步验证,后续工作可以将此口服蛋白类药物载体用于活体实验。
[1]Pauletti G, Gangwar S, Knipp G T, et al.Structural requirements for intestinal absorption of peptide drugs[J].J Control Release, 1996, 41: 3-17.
[2]王宝江, 杨 爽, 李 丹.蛋白口服给药的研究进展[J].中国医药导刊, 2008, 10(8): 1236-1237.
[3]刘映薇.口服蛋白质药物AC控释微球的膜性能研究[D].大连: 中国科学院大连化学物理研究所, 2004.
[4]闰欲晓.“智能型”水凝胶在生物工程和医药中的应用[J].食品科技, 2002, (11): 11-14.
[5]Fotios M A, Indushekhar P.Delivery of basic fibroblast growth factor(bFFG) from photoresponsive hydrogel scaffolds[J].Biomaetirals, 2006, 27(11): 2468-2476.
[6]郭启雷, 朱春燕.温敏水凝胶在智能给药系统中的应用[J].国外医药, 2002, 23(l): 41-44.
[7]Okano T, Bae Y H, Jacobs H, et al.Thermally on-off switching polymers for drug permeation and release[J].J Control Release, 1990, 11: 255-265.
[8]Muzzarelli R, Baldassarre V, Conti F, et al.Biological activity of chitosan: ultrastructural study[J].Biomaterials, 1988, 9: 247-252.
[9]陈碧琼, 孙 康.甲壳素和壳聚糖的医药应用及开发近况[J].中国药学化学杂志, 2001, 11(4): 245-248.
[10]杨吟野, 李训虎, 龚海鹏, 等.壳聚糖及相关材料用于神经修复的前景[J].生物医学工程学杂志, 2001, 18(3): 444-447.
[11]章玉苹, 陈 震, 吴优利.壳聚糖-新型生防农药的应用研究进展[J].世界农药, 2003, 25(4): 39-42.
[12]姚 倩, 孙 涛, 周冬香, 等.壳寡糖衍生物的抗氧化性能研究进展[J].食品科技, 2007, 14(10): 109-11.
[13]Wayne R G, Siow F W.Protein release from alginate matrices[J].Adv Drug Delivery Rev, 1998, 31: 267-285.
[14]陈 玺,朱桂贞,唐在明.海藻酸钠在临床上的应用[J].中国医药学杂志, 2000, 20(9): 560-561.
[15]李红兵.海藻酸钠作为新型药物运载体的开发[J].高分子通报, 2006, 5(8): 39-43.
[16]刘月华, 赵春艳, 李 凤, 等.壳聚糖-巯基醋酸偶合物的合成及其体外粘附性能的研究[J].中国新药杂志, 2009, 18(7): 656-659.
[17]Na K, Park K M, Jo E A, et al.Self-organized pullulan/deoxycholic acid nanogels: physicochemical characterization and anti-cancer drug-releasing behavior[J].Biotechnology and Bioprocess Engineering, 2006, 11: 262-267.
[18]Lai H L, Abu′ Khalil A, Craig D Q M.The preparation and characterization of drug-loaded alginate and chitosan sponges[J].Int J Pharm, 2003, 251: 175-181.
[19]Ang W S, Elimelech M.Protein (BSA) fouling of reverse osmosis membranes: Implications for wastewater reclamation[J].J Membrane Sci, 2007, 296: 83-92.
[20]Wang T, Turhan M, Gunasekaran S.Selected properties of pH-sensitive, biodegradable chitosan-poly(vinyl alcohol) hydrogel[J].Polym Int, 2004, 53: 911-918.
