鱼类体表粘液凝集素研究进展
2013-12-17黄智慧马爱军雷霁霖
黄智慧,马爱军,雷霁霖
1. 中国海洋大学 水产学院,山东 青岛 266003
2. 中国水产科学研究院黄海水产研究所 农业部海洋渔业资源可持续利用重点开放实验室,青岛市海水鱼类种子工程与生物技术重点实验室,山东 青岛 266071
鱼类皮肤上皮组织中分布有大量粘液细胞,所分泌粘液广泛覆盖在鱼体表面构成其与外界直接接触的第一道门户,在保护鱼体免遭外界环境中的病菌、寄生物和病毒侵袭中至关重要(Huang et al,2009)。普遍认为体表粘液中含有抵抗病原微生物入侵的非特异性免疫活性物质,尤其自 1969年,Fletcher & Grant(1969)提出在血清和粘液中均存在免疫球蛋白后,国、内外研究者对鱼类粘液的免疫功能产生了浓厚兴趣。不断有学者证实鱼类体表分泌物中存在补体、溶菌酶、凝集素、C-反应体、溶血素、抗菌肽及白细胞介素IL-1等多种生物活性因子(Alexander & Ingram, 1992; Buchman &Bresciani, 1998; Ingram, 1980)。凝集素作为具有糖专一性、可促进细胞凝集的糖蛋白,为鱼类体表粘液中的重要天然免疫因子,且已逐渐成为研究热点。本文结合国内、外研究成果,对鱼类体表粘液凝集素的研究简史、分类、生物学性质和功能进行阐述。
1 鱼类粘液凝集素研究简史
不同于免疫球蛋白,凝集素为不具酶催化活性的蛋白质或糖蛋白,能专一、多价与糖非共价可逆结合,并具有凝集细胞和沉淀聚糖或糖复合物的作用(Sun, 1994; Zhang, 1999),广泛存在于生物细胞膜、细胞质和细胞外基质,在脊椎动物及无脊椎动物的先天性免疫和宿主防御过程中起重要作用,参与异己识别、炎症反应、吞噬作用、细胞与细胞之间和细胞与外界之间的联络、受精、发育及再生等过程(Goldstein et al, 1980; Kilpatrick, 2002)。
凝集素最早由Stillmark在1888年从蓖麻籽和红豆碱中发现,此后,1919年Sumner从豌豆中分离出结晶蛋白,命名为 ConA,并用此方法第一次获得了纯凝集素(Xiong et al, 2006)。20世纪70年代,凝集素独特的性质引起越来越多学者的兴趣,并在很多生物体中被发现。Watkins & Morgan(1952)最早从鳗鱼中提取得到糖特异性凝集素,后来研究确定为L-fucose 凝集素。20世纪80年代后,在重组技术的支持下,鱼类凝集素研究有了突飞猛进的发展,人们从鱼体中分离筛选出多种新的具有生物活性的凝集素。经研究发现,鱼类凝集素在体内,如血清、体液、肌肉、血细胞及受精卵等(Jensen et al, 1997; Russel & Lumsden, 2005; Tateno et al, 2002; Yano, 1997),分布广泛的同时,也分布于体外,如鱼类体表粘液 (Suzuki et al, 2003)。
鱼类皮肤是保护鱼体与水环境接触的一道物理和化学屏障。皮肤粘液除包围入侵微生物外,还含有抗菌物质。其中,凝集素可有效识别和结合异己物质,产生凝集反应,从而防止外来微生物等入侵鱼体。Kamiya & Shimizu (1980)第一次从斑点犁齿鲆(Lophopsetta maculata)体表粘液中分离出了凝集素,随后,Ingram(1980)提出了鱼类体表含有凝集素,并将其描述为既非抗体类亦非酶类的碳水化合物结合蛋白。此后 30年,有关鱼类体表粘液凝集素的研究有了更长足的进步,研究者们分别从阿拉伯海鲇(Arius thalassinus)、海鳗(Conger myriaster)、欧洲小龙(Repomucenus richardsoniii)、泥鳅(Misgurnus anguillicaudatus)、岬羽鼬(Genypterus capensis)等多种鱼体表粘液中分离并纯化出了凝集素(Goto-Nance et al, 1995; Kamiya et al, 1988; Shiomi et al, 1989, 1990; Toda et al, 1996),不断证实凝集素存在于鱼类体表,并与体液免疫因子,如免疫球蛋白、补体、溶菌酶和血溶素等,具有同等重要的抵抗病原菌侵入的功能,在鱼体天然免疫系统中至关重要。但当时对体表粘液凝集素蛋白质结构、分子结构及其生物学功能却鲜有报道。Suzuki(1985)、Suzuki & Kaneko (1986)对日本鳗鲡(Anguilla japonica)凝集素红血球凝集反应的研究,提出的该凝集素存在于上皮组织杯形细胞中的推论,为体表粘液凝集素定位及其生物学功能研究的首次报道。其后,Muramoto & Kamiya(1992)对康吉鳗(Conger myriaster)粘液凝集素的氨基酸进行测序,并于1999年根据其蛋白质一级结构提出了康吉鳗体表粘液凝集素包括congerins Ⅰ和congerins Ⅱ两种结构类型。此后将近8年的时间里,东京大学又从日本鳗鲡、红鳍东方鲀(Takifugu. Rubripes)及颈带鲾(Leiognathus nuchalis)的体表粘液中分离出了不同的凝集素(Okamoto et al, 2005; Tasumi et al, 2004; Tsutsui et al, 2006),并分别进行了结构研究,最终根据其糖类识别位点(carbohydrate recognition domains,CRDs)的差异以及Ca2+依赖性将鱼类体表粘液凝聚素确定为4种类型,此后在其他鱼种中发现的粘液凝集素也大都归属于以上 4类(Chen, 2010;Rajan et al, 2011)。
2 体表粘液凝集素结构类型及其功能研究
迄今为止,共鉴定有 4种鱼类体表粘液凝集素,即:半乳凝集素、C型凝集素、Lily型凝集素及L-鼠李糖结合凝集素(Suzuki et al, 2003),表现广泛的分子多样性。第1种类型属于半乳凝素,其中包括从康吉鳗中分离出的 congerins Ⅰ,congerins Ⅱ,以及从日本鳗鲡中分离出的AJL-1,由于此类凝集素可特异性结合半乳糖或乳糖,故在皮肤粘液中占大多数 (Suzuki, 1985; Suzuki &Kaneko, 1986)。第2种类型是典型的C型凝集素,最早发现于日本鳗鲡,命名为AJL-2(Tasumi et al,2002)。第3种类型是由红鳍东方鲀中提取的特异性甘露糖凝集素,结构与单子叶植物凝集素相似,被命名为Lily-type lectin(Suzuki et al, 2003)。第4种提取自颈带鲾(Leiognathus nuchalis),为特异性乳糖结合凝集素(PFL-1,PFL-2)(Okamoto et al,2005),由于其与从某些鱼卵中所提取的 L-鼠李糖结合凝集素具有高度同源性,故被归属于L-鼠李糖结合凝集素家族 。另外,近期还发现了一种存在于鱼类体表粘液中的特异内源性凝集素(Tsutsui et al,2011),目前尚未确定该凝集素的分类,本文暂将其单列一类。
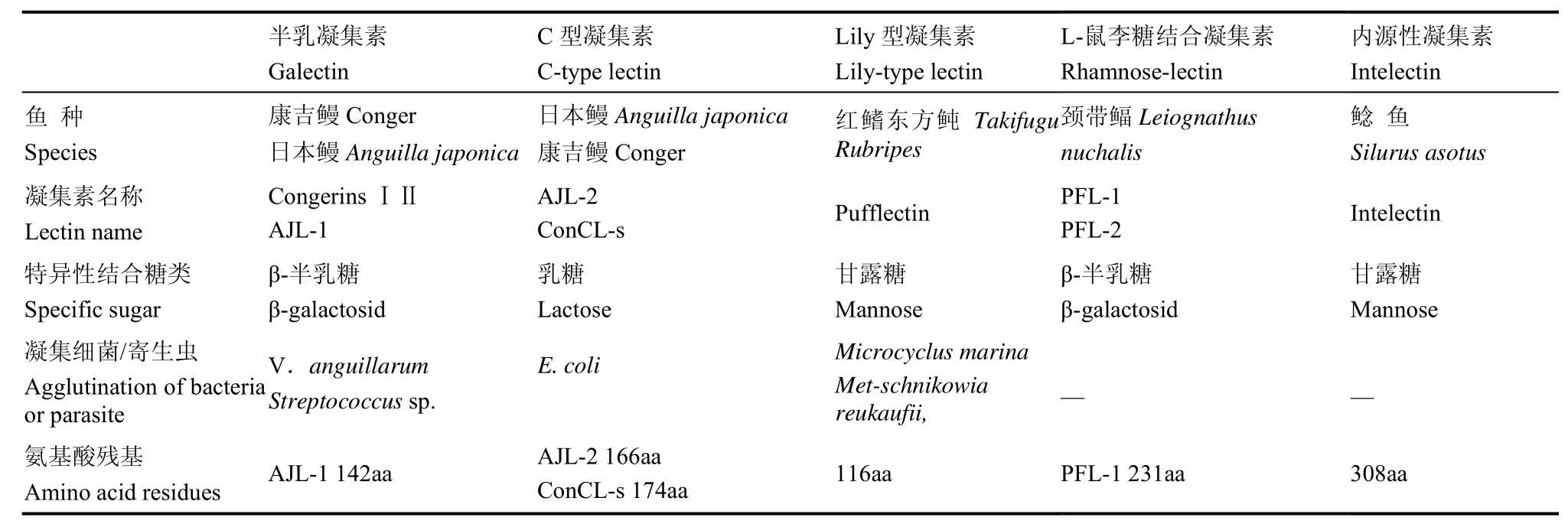
表1 体表粘液凝集素分类及特征汇总Table 1 Characteristics of skin mucus lectin in fish
2.1 半乳凝集素——galectins
Galectins又称半乳凝集素,是广泛存在的主要凝集素类型,具以下特性: Ca2+-不依赖性、特异的β-半乳糖苷酶活性、N-末端封闭、缺少单肽与糖基以及主要定位与细胞质 (Kilpatrick, 2000)。Galectin存在于动物体内及某些低等脊椎动物的体表粘液中,如非洲爪蟾(Xenopus laevis)(Marschal et al, 1992)以及康吉鳗(congerins Ⅰ和 congerins Ⅱ)等(Suzuki, 1985; Suzuki & Kaneko, 1986)。Tasumi et al(2002)对提取自日本鳗鲡的凝集素——AJL-1的结构研究显示,其表现β-半乳糖苷酶活性及 Ca2+-不依赖性,N-末端封闭,由 142个氨基酸残基组成,无半胱氨酸,未非共价键结合的二聚体结构,属于galectin。而对其基因全长的研究则显示,AJL-1 426 bp的开放阅读框编码142个氨基酸,同源性比较分析表明其与 congerins Ⅱ表现较高相似度(45%),且AJL-1具三个不同的糖结合残基,与congerins Ⅰ结构相似(Shirai et al, 1999)。这些证据都表明 AJL-1与康吉鳗粘液凝集素同源性较高。基因表达检测显示该凝集素仅存在于体表粘液,且表达含量很高(Kilpatrick, 2000)。AJL-1具有较强的抵抗病原微生物能力,对致病菌、链球菌属均表现凝集活性,是鱼类体表粘液中重要的防御因子。
2.2 独特的C型凝集素
在动物凝集素中,C型凝集素分布广泛,功能复杂,涉及体内许多重要的生理、病理过程。C型凝集素成员均含有一个或多个特征性糖类识别功能域(CRD),且该功能域能够通过两对或三对二硫键形成明显而稳定的结构,具有Ca2+-依赖性,其中有14个恒定残基(包括4个C残基)和18个保守残基。大多数 C型凝集素都与 D型甘露糖(D-mannose)、D 型葡糖糖(D-glucose)这一类的Man型配体(Gal-type ligands)或 D型半乳糖(D-galactose)及其衍生物结合(Kolatkar & Weis,1996)。目前研究最多甘露糖结合(mannose-binding protein, MBP)C型凝集素是激活免疫系统补体途径的最主要因子(Dong et al, 2004; Wei et al, 2010;Zhang et al, 2010)。在鱼类中,虹鳟(Oncorhynchus mykiss)、鲤鱼(Cyprinus carpio)、大西洋鲑(Salmo salar)、日本牙鲆(Paralichthys olivaceus)以及大菱鲆(Scophthalmus maximus)中的C型凝集素均已被克隆并进行了部分功能验证(Kondo et al, 2007;Nakao et al, 2006; Nikolakopoulou & Zarkadis, 2006;Richards et al, 2003; Zhang et al, 2010)。
上述C型凝集素均分布于体内,直到2002年,Tasumi从日本鳗鲡体表粘液中分离出凝集素AJL-2,其结构与C-type lectin相似,均具有一段保守性氨基酸序列,以及4个需要二硫键联接的保守半胱氨酸残基。AJL-2具有Ca2+-不依赖性,其基因序列中包括498 bp的开放阅读框,编码166个氨基酸,同源性比对分析发现其与肋突螈(Pleurodeles),响尾蛇(Crotalus atrox)及小鼠等多个物种的C型凝集素同源,同源性≥30%。Northern blot分析发现,AJL-2仅存在于体表,且在鱼体上皮组织中的杯型细胞分泌液泡中积累。凝集反应实验表明,AJL-2的凝集模式与MBP结合方式相似,对病原菌E.coli K 12具有凝集作用,进而抑制细菌穿透细胞膜进入机体,或促使细菌陷入到体表粘液中最终被新分泌出来的粘液冲洗掉而起到保护鱼体的作用(Tasumi et al, 2002)。
Tsutsui et al (2007)由康吉鳗体表粘液中发现了另一种对酵母菌具凝集活性的甘露糖特异性结合凝集素,并称之为 conCL-s,与之前在康吉鳗中发现的 congerins Ⅰ和 congerins Ⅱ不属于同一类型。该凝集素为四聚体结构,由两个以二硫键结合且单体分子量为16×103的二聚体组成,其结构属于C-type lectin家族。conCL-s对酵母菌的结合表现明显Ca2+-不依赖性。基因表达实验发现其广泛存在于机体内部和外部粘膜组织中,如皮肤、鳃、舌和食道,在这些组织中,conCL-s对细菌具有凝集性,且在康吉鳗巨噬细胞中,lectin结合微球体可显著提高细胞的吞噬作用。这些发现均表明conCL-s具有调理素的作用,在体表天然免疫系统中起重要作用。
2.3 Lily型凝集素——pufflectin
Suzuki et al(2003)将从红鳍东方鲀体表粘液中提取出的pufflectin认定为第3种类型凝集素,并命名为“Lily-type lectin”。该凝集素较为特殊,cDNA全长527 bp,包括编码116个氨基酸的348 bp开放阅读框,其上游区无 ATG翻译起始位点,即不含单肽的特征常见于半乳凝集素(Kilpatrick, 2000)。Pufflectin氨基酸序列与目前发现的任何一类动物凝集素均无同源性,却与单子叶植物的甘露糖凝集素高度同源,如雪花莲(Galanthus nicalis)、水仙花(Narcissus hybrid cultivar)、韭菜(Allium prorrum)和大蒜(A.sativum)等。这些植物的凝集素都含有三个甘露糖结合位点,而pufflectin被证实含有其中两个(Tsutsui et al, 2007)。这类凝集素在体内分布广泛,在鳃、口腔壁、食道以及体表都有表达。据报道,凝集素与细菌具有特异性凝集现象,而pufflectin与细菌并不发生凝集反应,但却对寄生虫具有凝集活性,这一发现指出其对鱼体在由寄生虫引起的机体防御系统中起重要作用。Pufflectin是第一个被发现与寄生虫有凝集现象的鱼类体表粘液凝集素,证实了凝集素对细菌及寄生虫均具天然免疫功能。
2.4 L-鼠李糖结合凝集素——PFL-1,PFL-2
第四种类型粘液凝集素为提取自颈带鲾(ponyfish Leiognathus nuchalis)的特异性乳糖结合凝集素(PFL-1,PFL-2),cDNA全长1 086 bp,包括693 bp开放阅读框,编码231个氨基酸。PFL-1与从某些鱼卵中提取的 L-鼠李糖结合凝集素高度同源,均拥有一段保守的串联重复序列,故归属于L-鼠李糖结合凝集素家族。但PFL-1仅表达于体表粘液,而不存在于性腺、鳃、肝脏、脾脏以及肠道。PFL-2与PFL-1 的N-末端氨基酸序列高度相似,被确认与PFL-1同型(Okamoto et al, 2005)。该种凝集素亦具有凝集细菌,阻止其进入而保护鱼体的重要免疫功能,但其具体作用机理尚无报道。
2.5 新发现的粘液凝集素
Tsutsui et al(2011)在鲶鱼(Silurus asotus)体表粘液中发现了具甘露糖结合的 Ca2+-依赖活性的甘露糖结合凝集素。凝胶过滤结果显示,其具有单聚体和二聚体形式,为由308个氨基酸组成的分泌蛋白,与哺乳动物和鱼类内源凝集素同源。该凝集素基因在鱼类的鳃部、肾和皮肤都有所表达。抗血清反应监测显示,内源性凝集素蛋白存在于皮肤和鳃的杯型细胞、肾脏及血浆。此凝集素对病原微生物具有凝集活性,揭示其在鱼类体表抵抗外来细菌侵入的自我保护系统中至关重要。而且,该凝集素的发现证实内源性蛋白同样存在于鱼类体表粘液,为对凝集素家族功能的补充。目前该凝集素分类尚未确定,暂将其归为内源性凝集素类。随着分子生物学、蛋白组学技术及测序技术的迅猛发展,通过转录组文库、蛋白组图谱等高端技术,研究者在其他鱼种中发现了粘液凝集素,如Rajan et al (2011)在对大西洋鳕鱼(Gadus morhua)粘液进行比较蛋白组学研究时,就发现其存在Galectin-1及甘露糖凝集素(MBL),Bo et al(2012)构建感染鳗弧菌青鳉鱼(Oryzia melastigma)的消减文库,Blast比对获得了其粘液凝集素。但目前尚未深入开展这些凝集素分子结构特点及凝集反应现象等有关功能特性的研究。
3 鱼类体表粘液凝集素功能性研究展望
凝集素功能性研究开展较早的是植物凝集素,对其生理功能以及分子机制等都有较深入探究,尤其是为防治病虫害开拓了新思路。植物凝集素被认为是植物防御系统的重要组成部分,目前,更多应用于转基因抗虫品种的培育及抗病品种的筛选。海洋生物凝集素相对发展较晚,自 20世纪70年代后期,其在贝类免疫识别中的作用才为人们所关注,随着研究的深入,现已发现海洋生物凝集素的生物活性绝不逊色于陆生植物凝集素,且水产动物凝集素的研究也已有不少报道(James &Rowland, 1974;Muramoto et al, 1994)。其中,鱼类凝集素通过有效识别和结合异己物质,提高吞噬细胞对异己物质的吞噬、灭杀作用,以及作为免疫活性物质保护机体的防御功能已得到了越来越多的关注。
鱼类体表粘液及其中所包含的凝集素,以及凝集素的分子结构多样性在保护鱼体免遭外界环境中的病菌、寄生物和病毒的侵袭中至关重要(Huang et al,2009)。粘液凝集素对寄生虫也表现强烈的凝集活性,同时,还具有调理素的功能。因此,掌握其生物功能的多样性及特殊性,对于了解鱼类粘液免疫系统以及抵抗外界环境胁迫效应都有着广泛的应用前景。
日本东京大学SuzukiYuzuru教授经过近10年的研究,目前,已从多个物种中分离纯化出了凝集素,并对其蛋白及分子结构作了详细分析和功能验证,根据其对糖特异性结合位点及对Ca2+-依赖性等结构性特性进行了初步分类。但这些成果对于大规模凝集素功能性应用开发而言,只是初级阶段,关于体表粘液凝集素的功能性分子机理以及应用性研究仍需进一步研究。笔者认为,凝集素具有多价结合能力,能与荧光素、酶、生物素、铁蛋白及胶体金等结合,而不影响其生物活性,可用于光镜或电镜水平的免疫细胞化学研究工作,探究机体在处于环境胁迫条件下的体表上皮细胞分化、增生和恶变的生物学演变过程,了解病理变化,从而对机体状态作出诊断评价。而且粘液凝集素对于不同类型的细菌具有特异凝集活性,可以作为粗略鉴定病原微生物的指示因子。
总之,粘液凝集素作为生物体内特殊的糖蛋白,存在于鱼体与外界直接接触的第一道门户——体表粘液中,在鱼类整个生命过程中至关重要。它在认识和解决鱼类集约化、半集约化养殖疾病防治中的重要意义也得到了越来越多的关注,而且随着生物工程研究手段和研究领域的不断扩大,对其开发、利用和生化工程技术的拓展将具有广阔应用前景。
