激活大鼠前额叶下边缘区GABAA受体对被动回避记忆巩固的影响
2013-12-17王晓琴李仙丽王功伍
王晓琴,李仙丽,王功伍
1. 云南师范大学 体育学院,云南 昆明 650500
2. 云南师范大学 生命科学学院行为与认知神经生物学实验室,云南 昆明 650500
3. 郑州中学,河南 郑州 450001
记忆巩固的系统水平理论(system-level memory consolidation theory)指出,陈述性记忆(declarative memory)信息经海马(hippocampus)等编码后,在相关新皮质形成长时记忆,即记忆巩固(Dudai,2012;Squire et al,2004)。作为新皮质,前额叶(prefrontal cortex,PFC)尤其是腹内侧前额叶(ventromedial PFC,vmPFC)在记忆巩固中非常重要(Bontempi et al,1999;Frankland &Bontempi,2005;Nieuwenhuis & Takashima,2011),参与恐惧消退记忆的巩固和提取(Burgos-Robles et al,2007;Laurent & Westbrook,2009;LaLumiere et al,2010;Milad & Quirk,2002;Quirk et al,2000 ),主要包括前边缘皮质(prelimbic cortex,PLC)和下边缘皮质(infralimbic cortex,ILC)。虽然PLC和ILC在解剖位置上相邻,但其在记忆中的作用并不完全一致(Jinks & Mcgregor,1997;Laurent &Westbrook,2009;Marquis et al,2007;Sierra-Mercado et al,2011)。Nieuwenhuis & Takashima(2011)根据人类和大鼠 vmPFC在记忆过程中的活动表现,推测两者具有功能相似性,而人类 vmPFC在情感相关精神疾病(如虚谈症)的发生中具有重要作用,因此,研究大鼠ILC的记忆功能,有助于了解此类精神疾病的发病机理。
Jinks & Mcgregor(1997)发现训练前永久损毁大鼠ILC会导致严重的被动回避记忆障碍,而损毁PLC则无明显影响。在训练前可逆失活PLC可致工作记忆障碍,但对被动回避学习无明显损伤效应(Wang & Cai,2006,2008)。Laurent & Westbrook(2009)比较了分别失活PLC和ILC对恐惧消退记忆的影响,发现PLC主要参与恐惧反应的表达,而ILC在消退记忆的巩固和提取中更为关键。Zhang et al(2011)发现,小鼠接受被动回避训练后90 min时,包括ILC在内的多个脑区的即刻早基因(如c-fos和Arc基因)表达(蛋白合成)显著增加,而若在训练后立即向vmPFC(PLC以及ILC的小部分区域)注射蛋白合成抑制剂则可导致被动回避记忆巩固过程受损,说明被动回避记忆的巩固过程依赖vmPFC的蛋白合成。
以上研究均提示ILC在被动回避记忆巩固中具有重要作用。但Jinks & Mcgregor(1997)使用的电损毁方法,不能排除过路纤维受损效应,亦不能说明ILC在不同记忆阶段中的作用。而Zhang et al(2011)则由于注射位点不专一,不能说明PLC和ILC在记忆巩固中作用的异同。鉴于前额叶区域存在丰富的GABAA受体,激活该受体会使Cl-通道开放,神经元兴奋性降低而致局部脑区功能暂时失活(Dunn et al,1996)。为明确ILC中GABAA受体在被动回避记忆巩固中的作用,本研究选用 GABAA受体激动剂蝇蕈醇(muscimol)可逆失活ILC区域神经元,并以局部 EEG功率谱变化作为神经活动抑制指标,探讨ILC区神经元兴奋性降低对被动回避记忆巩固过程的影响。
1 材料与方法
1.1 实验动物
实验用 20只成年雄性 Sprague-Dawley大鼠(Rattus norregicus),购自成都达硕生物科技有限公司(许可证编号:SCXK(川)2008–0024),购入时为 8 周龄,体重 180~220 g),分组饲养于聚丙烯鼠笼,自由饮水和取食。手术前,所有动物在实验室适应至少一周,实验者每天抚摸、抓握数次,使其适应实验过程。房间内保持自然光周期变化(12L:12D),并监控温度(22±1)℃和湿度(45%~55%,相对湿度)。所有行为测试均在每天的下午同一时间(13:30—15:30)进行。所有实验过程均遵照《云南省实验动物管理条例》及美国国立健康研究院《Guidelines for Use and Care of Laboratory Animals》进行。实验动物分成生理盐水(saline)组(n=10)和蝇蕈醇(muscimol)组(n=10),用被动回避作业进行测试。实验流程如图1所示,为防止对被动回避作业造成干扰,EEG记录在被动回避作业重测试结束后进行。
1.2 引导管埋置
硫酸阿托品(上海禾丰制药有限公司,批号:100804)(0.2 mg/kg,i.p.)预处理20 min后,使用戊巴比妥钠(4%,Merck Drugs & Biotechnology,德国,批号:1063180500)(50 mg/kg,i.p.)深度麻醉动物,随后,将动物固定于立体定位仪(68404型,深圳市瑞沃德生命科技有限公司深圳瑞沃德公司)。盐酸普鲁卡因(重庆莱美药业股份有限公司,批号:090530)局部麻醉后,切开头皮,在预定位置钻孔(直径 1 mm),将不锈钢引导管(外径0.48 mm;62003型,深圳市瑞沃德生命科技有限公司)插入预定深度,并用不锈钢螺丝和牙科水泥固定,引导管内置不锈钢内芯,内芯较引导管深入 0.5 mm,至目标脑区所在位置。根据大鼠脑立体定位图谱(Paxinos & Watson,2007),以前囟(bregma)为原点,确定ILC的立体定位坐标(AP:+3.0 mm;ML:±0.7 mm;DV:−5.0 mm。手术完毕后,在刀口处涂以莫匹罗星软膏(中美天津史克制药有限公司,批号:12040269)和云南白药(云南白药集团股份有限公司,批号:20081010)止血、止痛并预防感染,手术当天及以后连续4 d每天注射青霉素钠(8×104U,i.m.,哈药集团制药总厂,批号:A120805610)以预防感染。动物在手术后单笼饲养,至少恢复一周。

图1 被动回作业行为测试和EEG记录流程图Figure 1 Flow diagrams of the passive avoidance task and EEG recordingEEG记录时间轴线上的小矩形代表在此段采集的用于EEG功率谱分析的EEG片段(2 min)。The small rectangles on the EEG recording timeline indicate the 2 min segments used in EEG power analysis.
1.3 被动回避作业
训练采用经典的一次性步入法,使用GEMINI两用回避系统(San Diego Instruments,美国)。测试箱由明室和暗室组成,两室中间有自动升降门供动物通行,两室底部的平行铜棒间隔2 cm,与内置电刺激器相连。训练过程持续3 d,第1天为适应期(habituation),将动物放入明室,小门保持打开状态,熟悉实验装置 5 min。第 2天为训练期(training phase),同一时间,打开小门,将动物背向小门放入明室,记录动物从开始到进入暗室的时间(潜伏期),待动物四肢全部踏入暗室后,小门立即关闭,并给予电击(0.9 mA,3 s),电击结束5 s后将动物取出,立即注射药物(蝇蕈醇溶液或生理盐水),注射完毕放回笼中。24 h后进行重测试(retest phase),操作与训练期相同,但不给予电击(图1),同样记录动物步入暗室的潜伏期,若动物在300 s内未进入暗室,则将其潜伏期记作300 s并取出,该指标反映动物对24 h前在暗室遭电击事件信息的记忆保持情况。
1.4 脑内注射
实际注射前,采用模拟注射的方式让动物适应整个过程,并于被动回避训练期电击结束后立即进行注射。将引导管内芯取出,插入不锈钢注射导管(直径0.3 mm),且深入程度与引导管内芯相同。通过微量泵(MD-1001,Bioanalytical System,美国)推动5 μL微量进样器以0.125 μL/min的速率注射0.25 μL 生理盐水或蝇蕈醇溶液(0.5 μg/0.25 μL,Sigma Chemical Co., Ltd.,美国,批号:674K4052)2 min。注射完毕后,注射导管原位停留1 min后取出,放回内芯,旋上导管帽后将动物放回笼中。
1.5 局部EEG记录和EEG功率谱分析
行为任务结束后第 2天,注射蝇蕈醇并记录EEG。记录时将引导管内芯取出,插入不锈钢记录电极(尖端裸露0.3 mm,直径0.15 mm),深入程度与引导管内芯相同。记录基线30 min后,取出电极插入注射导管,注射蝇蕈醇(0.5 μg/0.25 μL)或生理盐水(0.25 μL),注射完毕后立即将记录电极插回引导管,记录EEG信号50~60 min(图1)。EEG信号由生理信号采集系统(RM6240B,成都仪器厂)采集,采样频率为1 000 Hz,时间常数为0.2 s。EEG记录期间,动物自由活动,但需注意防止动物出现较大的运动或进入睡眠状态。脑电图记录分为注射前(基线)和注射后两部分,注射前选取2 min的基线段,注射后共选取6个2 min(128 s)的EEG片段,间隔时间为10 min(图1)。原始数据经数字滤波和200 Hz重采样后进行快速傅立叶变换,将其由EEG曲线转变为EEG功率谱,计算包含 δ(0.98~3.91Hz)、θ(4.10~8.01Hz)、α( 8.21~11.91Hz)、 β1( 12.11~ 19.92Hz)、 β2(20.12~30.08Hz) 等 常 见 EEG 频 段 在 内 的0.98~30.08 Hz 频段的对数线性功率(Wang & Cai,2006)。基线功率视为 100%,计算注射后各时间段总功率占基线总功率的百分率,作为该时间段的相对功率。注射后的功率与自身基线纵向比较时采用对数线性功率,药物注射后同时间段的功率与生理盐水组横向比较时采用相对功率。EEG功率谱详细计算方法参照Wang & Cai(2006)。
1.6 注射部位组织学检查
行为测试和 EEG记录完成后,将动物用超量戊巴比妥钠麻醉,将不锈钢电极经引导管插入脑内,通以正向6 V直流电10 s。随后经升主动脉灌流生理盐水及4%甲醛生理盐水溶液(含1%亚铁氰化钾)固定,用普鲁士蓝法标记注射位点。取脑,并置于4%甲醛生理盐水溶液固定一周,用振动切片机(DQP-1,成都仪器厂)作连续冠状切片(50 μm),每5张切片取一张在解剖镜下观察标记的蓝斑区域,其中心区即注射导管尖端和记录电极位置。
1.7 数据统计
本研究采用独立样本 t-检验比较生理盐水组与蝇蕈醇组动物在被动回避反应作业的潜伏期数据(组间比较),采用配对样本t-检验比较每组动物训练期和保持期潜伏期数据(组内比较),采用双因素和单因素重复测量的方差分析比较 EEG功率谱数据,所有数据均表示为mean±SE,P<0.05为统计显著性差异。
2 结 果
2.1 注射导管位置的组织学检查
组织学检查表明,7只生理盐水组动物及8只蝇蕈醇组动物导管准确位于预期脑区(图2),其余动物数据未用于统计分析。
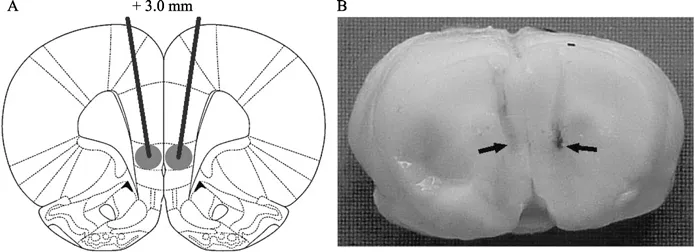
图 2 注射导管尖端位置(冠状切面观)Figure 2 Positions of the cannula tip in brain (coronal view)A:注射导管在大鼠脑下边缘区的位置示意图(引自Paxino & Watson,2007,略作修改);B:注射导管在大鼠脑中的实际位置;数字为该冠状切片与前囟的距离(mm);箭头:注射导管尖端所在位置。A; Draft of the positions of cannula tip in the infralimbic area of rat brain (derived from Paxino & Watson,2007 with modification); B: Actual position of cannula tip in a rat brain; Number indicates the distance of this coronal slice from bregma (mm), Arrows indicate the positions of cannula tip.
2.2 蝇蕈醇使ILC局部EEG总功率显著降低
单因素重复测量方差分析表明,在ILC内注射生理盐水后,其局部 EEG功率随时间变化无显著改变 [F(1,6)=2.129,P=0.195],而注射蝇蕈醇后则表现时间依赖性显著降低 [F(1,7)=20.010,P=0.003],相对基线和盐水组,注射后10 min,EEG功率明显降低,注射后50 min降低~20 %。双因素重复测量方差分析表明,存在显著的时间/处理交互效应 [F(1,13)= 7.954,P=0.014](图 3,图 4)。由图 4可见,下降明显的成分主要分布于低频频段(δ+θ,0.98~8.01 Hz)和 β 频段(12.11~30.08 Hz),α频段功率改变较小。
2.3 蝇蕈醇导致的 ILC区神经元兴奋性降低对大
鼠被动回避记忆巩固无显著影响
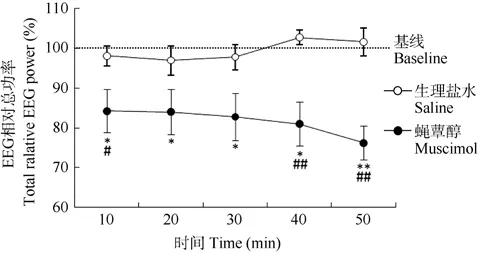
图3 大鼠前额叶下边缘皮质注射蝇蕈醇后不同时段的局部EEG(0.98~30.08 Hz)总功率变化Figure 3 Local EEG spectral profiles (0.98~30.08 Hz) of rat prefrontal infralimbic cortex before and after muscimol infusion
训练期,生理盐水组动物进入暗室的潜伏期平均值为 15.17 s,蝇蕈醇组为7.74 s,说明两组动物均能在被放入明室后迅速进入暗室。生理盐水组和蝇蕈醇组的潜伏期无显著差异 [独立样本t-检验:t(13)=1.664,P=0.1200],说明两组动物的避暗行为无显著差异,均具有正常的趋暗习性和正常的视觉、运动功能。重测试期,生理盐水组进入暗室的潜伏期平均值为163.2 s,蝇蕈醇组为123.9 s,两组间无显著性差异 [独立样本 t-检验:t(13)=0.5801,P=0.5718]。两组动物各自训练期和重测试期数据相比较均存在显著性差异 [配对样本 t-检验,生理盐水组:t(6)=2.968,P=0.0250;蝇蕈醇组:t(7)=2.523,P=0.0397],说明两组动物均可建立正常的被动回避记忆(图5)。
3 讨 论
蝇蕈醇通过激动GABAA受体,使Cl-通道开放,导致注射区域神经元超极化,兴奋性降低(Saari et al,2011)。EEG总功率是检查大脑兴奋性的一个定量指标(Ludvig et al,2012;Wang & Cai,2006)。在本研究中,注射蝇蕈醇后,ILC局部EEG总功率降低,注射后50 min,总功率下降~20%,表明注射脑区的神经元兴奋性受到了抑制。蝇蕈醇仅能够暂时抑制注射脑区功能,24 h后该抑制功能即可被代
.

图4 大鼠前额叶下边缘皮质注射蝇蕈醇后不同时间段的局部EEG功率谱曲线Figure 4 EEG spectral profiles of rat prefrontal infralimbic cortex before and after muscimol infusion每段曲线为2 min的EEG对数功率谱的平均值。Each profile is the mean of a 2 min period EEG power.
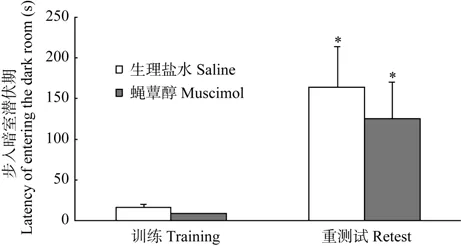
*:P<0.05(配对样本t-检验,与训练期相比)。*: P<0.05 (paired samples t-test,compared with training phase).
图 5 前额叶下边缘皮质训练后失活对大鼠被动回避作业
一次性步入潜伏期的影响
Figure 5 Effect of prefrontal infralimbic cortex after training inactivation on one-trial step-through latency in passive
avoidance task rats谢清除,从而恢复该脑区的功能(Arikan et al,2002)。本研究在训练后立即给药,训练结束 24 h后重测试,此时神经元的兴奋性已经完全恢复,对重测试时的记忆提取过程没有影响。被动回避作业反映动物形成的由足底电击引起的厌恶或恐惧情绪与电击情境相联合的长时记忆(McGaugh,2004),包含获得、巩固和提取 3个阶段。本研究在训练后立即给药,观察药物对记忆巩固阶段的影响,结果发现,试验组与对照组的重测试潜伏期均显著高于训练期,而两组相比无显著性差异,即蝇蕈醇激活GABAA受体,抑制ILC兴奋性,但不影响被动回避记忆巩固。
Wang & Cai(2006,2008)报道,在训练前30 min将蝇蕈醇(0.5 μg/ 0.25 μL)注射至PLC或者腹侧海马可使局部 EEG总功率下降,且下降程度与本研究相似(~20%),且可导致T-迷宫空间工作记忆、Morris水迷宫空间参考记忆和步入式被动回避记忆的损伤,说明本研究采用的蝇蕈醇注射剂量可以激活足够的GABAA受体,抑制注射脑区神经元兴奋性。工作记忆是短暂(持续数秒~数十秒)保持信息并将其用于指导思维或行为的记忆,并与神经元和神经回路的功能状态有关(Floresco et al,1997;Wang & Cai,2006,2010)。而参考记忆和被动回避记忆属长时记忆范畴,其记忆信息的获得和提取同样与神经元及其回路的功能状态有关(Bontempi et al,1999;Wang & Cai,2008)。训练前给药主要干扰记忆获得和巩固,因此,在训练前注射蝇蕈醇(0.5 μg/ 0.25 μL)至PLC,可损伤工作记忆和长时记忆形成过程(Floresco et al,1997;Wang & Cai,2006,2008)。Jinks & McGregor(1997)在训练前永久损毁大鼠ILC,Zhang et al(2011)在小鼠被动回避训练后,向包括PLC和ILC在内的mPFC中注射蛋白合成抑制剂后,动物的被动回避记忆巩固明显受损,表明ILC区与被动回避记忆巩固有关。本研究在训练后以蝇蕈醇降低大鼠ILC区兴奋性,但其被动回避记忆巩固未受影响。记忆巩固需要基因表达、新蛋白的合成和突触形态结构的改变(Sutton & Schuman,2006)。可能在训练期,即记忆获得阶段,相关神经元就已经启动了巩固相关基因表达和新蛋白质合成等过程(Zhang et al,2011),而在训练后的记忆巩固阶段抑制神经元兴奋性就不能阻止蛋白质的合成了。因此,在本研究中,GABAA受体激动剂虽能降低神经元兴奋性,但不影响已经启动的蛋白合成过程,故大鼠的被动回避记忆巩固过程未受影响。
综上所述,本研究结果表明,相对于PLC,ILC是一个独立的vmPFC亚区,激活其GABAA受体,抑制神经元活动,可降低局部 EEG总功率,且不损伤大鼠被动回避记忆巩固过程,但其具体的机制有待进一步探讨。
致谢:云南师范大学生命科学科学学院 2006级本科生张怡斐同学和李淑芳同学曾参与部分动物手术辅助和行为数据收集、整理工作,中国科学院昆明动物研究所脑与行为实验室蔡景霞研究员提供了部分实验条件,在此表示特别感谢。
