2种化感成分对木麻黄幼苗小枝活性氧含量和保护酶活性的影响
2013-12-14林勇明吴承祯
李 键,刘 奕,洪 滔,林勇明,吴承祯,2,洪 伟,①
(1.福建农林大学林学院,福建福州350002;2.武夷学院生态与资源工程学院,福建南平354300)
大量研究证实:逆境胁迫会导致植物细胞内活性氧(reactive oxygen species,ROS)生成和清除的动态平衡破坏而出现ROS的积累[1-3],同时也会导致植物体内的保护酶系统,如过氧化氢酶(CAT)、过氧化物酶(POD)及超氧化物歧化酶(SOD)等保护酶活性提高[4-5],从而清除植物细胞内过多的 ROS,减缓逆境胁迫对植物细胞膜系统[6]、色素[7]、蛋白质[8]及核酸[9]的损伤。因此研究植物活性氧代谢及其清除系统对于揭示植物的逆境适应机制有重要意义。
木麻黄(Casuarina equisetifolia Forst.),又名短枝木麻黄,广泛分布于热带和亚热带地区[10]。因其具有坚固厚重的材性和良好的抗风、速生、耐盐碱、耐贫瘠、耐涝等特点[11],引种至中国后在东南沿海生态防护林、纸浆用材林及薪碳林的营建中扮演着重要角色,在维持海岸带生态系统稳定、保护沿海农业生产、改良受盐碱危害的沿海沙地和防潮汐侵蚀固沙等方面都起到其他树种无法替代的作用[12]。但木麻黄防护林可持续经营面临着生长年限短、林分二次更新困难、连栽导致生产力下降和防护功能衰退等问题[13-14],许多学者试图从植物化感作用的角度解释其衰退原因。Suresh等[15]发现木麻黄小枝水浸提物能够抑制向日葵(Helianthus annuus Linn.)、豇豆〔Vigna unguiculata(Linn.)Walp.〕和 高 粱〔Sorghum bicolor(Linn.)Moench〕的发芽和生长;而邓桂兰等[16]从木麻黄中分离鉴定出化感物质,并用生物检测方法证实这些化感物质对其幼苗的生长有显著的抑制作用;林武星等[17-21]用木麻黄根系水浸提液处理水培木麻黄幼苗,研究了木麻黄幼苗的生长、营养吸收、内源激素、叶绿素及糖类、活性氧代谢的变化,证实了木麻黄的化感作用,并对其自身的生长与更新有显著影响;黄舒静等[22]发现来源于短枝木麻黄小枝的单宁对其幼苗的生长和发育有影响;王春晴等[23]的研究结果表明:木麻黄根系、凋落物及根际土壤水浸提液均对青皮(Vatica mangachapoi Blanco)种子的萌发有抑制作用。但迄今为止尚未见有关木麻黄化感物质对其幼苗生理代谢影响的研究报道。
作者以木麻黄品种‘惠安1号’(‘Hui’an No.1’)水培苗为实验材料,研究槲皮黄素-3-α-阿拉伯糖苷(Q3A)和槲皮黄素-3-β-葡萄糖苷(Q3B)2种存在于木麻黄中的化感成分[21]对其水培幼苗小枝活性氧代谢、膜质过氧化作用及保护酶活性的影响,探寻自毒胁迫下木麻黄生理代谢的响应机制,为抗自毒木麻黄无性系的筛选以及木麻黄连栽困难问题的解决提供理论依据。
1 材料和方法
1.1 材料
水培木麻黄枝条由福建省泉州市惠安县赤湖国有防护林场提供,为保证材料的基因型一致,枝条均采集自‘惠安1号’木麻黄采穗圃同一株截干母树当年萌出的小枝。
供试用槲皮黄素-3-α-阿拉伯糖苷(Q3A)和槲皮黄素-3-β-葡萄糖苷(Q3B)购自美国Sigma公司,经HPLC检测纯度分别大于95%和90%。
1.2 方法
1.2.1 水培苗培养方法 实验于2012年5月至9月在福建农林大学森林生态研究所进行。在5月下旬培育水培苗,采集长度约9~10 cm小枝,用质量浓度60 mg·L-1萘乙酸浸泡(液面在小枝基部2 cm处)24 h后用去离子水冲洗干净,放入灭菌的小玻璃瓶中,每瓶20根,用去离子水培养(液面在小枝基部3 cm处)。白天置于阳光直射处,夜间移入室内保温,每日更换去离子水1次。水培30 d后选取株高15~16 cm、具5~6个分枝、根系长势较一致的植株,移至MGC-800B型人工气候箱(上海一恒科学仪器有限公司)中,于白天(6:00至18:00)28℃ ~30℃、夜间(18:00至次日6:00)24℃ ~26℃、白天光照强度 400 μmol·m-2·s-1、昼夜空气相对湿度 60% ~70%的条件下恢复培养;并使用增氧泵为根系供氧。2周后用于化感处理。
1.2.2 化感处理方法 准确称取Q3A和Q3B各400 mg,分别用2 mL甲醇溶解再用去离子水稀释至500 mL,用RE-2000A型旋转蒸发器(上海亚荣生化仪器厂)于50℃、30 r·min-1旋转蒸发,待溶液体积减少约20%后加100 mL去离子水,重复操作4次,以去除溶液中的甲醇,然后用去离子水定容至1 L,并用去离子水稀释至质量浓度 12.5、25、50、100、200 和400 mg·L-1,即可用于化感处理,对照为去离子水。采用水培法进行化感处理,水培期间气候箱参数设置与上述一致,每日更换1次处理液,每次100 mL。实验共14个处理,每处理3次重复,每一重复20株,分别于处理的 0、12、24、36、48、60 和 72 h 各选取 1 株,剪取每株的第1分梢,去除枝条顶端后混合,用于生理指标测定,若第1分梢质量不足,则再剪取第2分梢。
1.2.3 指标测定方法 取0.2 g叶片,加入5 mL预冷的 50 mmol·L-1磷酸缓冲液(pH 7.8),于冰浴条件下研磨,然后于4 ℃、10 000 r·min-1离心20 min,上清液即可用于丙二醛(MDA)含量及CAT、POD和SOD活性的测定。参照文献[24]的方法测定H2O2含量;参照文献[25]的方法测定O-·2产生速率;按赵世杰等[26]的方法测定 MDA 含量;采用紫外吸收法[27]165测定CAT活性;采用愈创木酚法[27]164测定 POD活性;采用氮蓝四唑法[27]167-169测定 SOD 活性。
1.3 数据处理
采用SPSS 18.0软件进行差异显著性检验(LSD,P<0.05)及方差分析。
2 结果和分析
表1 用Q3A和Q3B水培处理后木麻黄幼苗小枝产生速率的动态变化 (±SD)1)Table 1 Dynamic change ofproduction rate in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)
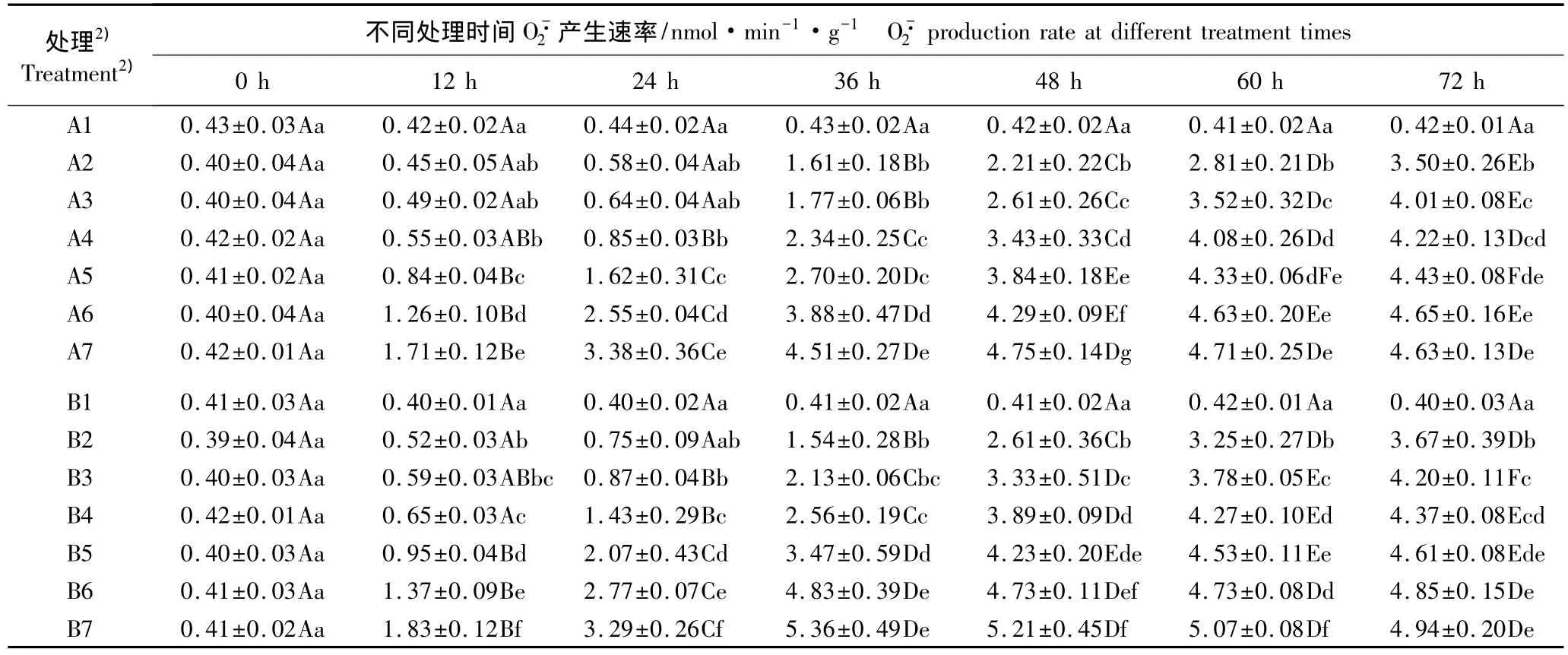
表1 用Q3A和Q3B水培处理后木麻黄幼苗小枝产生速率的动态变化 (±SD)1)Table 1 Dynamic change ofproduction rate in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)
1)同列中不同的小写字母表示同一化合物不同浓度处理间差异显著(P<0.05)Different small letters in the same column indicate the significant difference among different concentration treatments of the same compound(P<0.05);同行中不同的大写字母表示同一浓度处理在不同时间间差异显著(P<0.05)Different capitals in the same row indicate the significant difference among different times in the same concentration treatment(P<0.05).2)A1-A7:分别为0(对照)、12.5、25、50、100、200和400 mg·L-1槲皮黄素-3-α-阿拉伯糖苷(Q3A)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-α-araboside(Q3A)treatments,respectively;B1-B7:分别为0(对照)、12.5、25、50、100、200 和400 mg·L-1 槲皮黄素-3-β-葡萄糖苷(Q3B)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-β-glucoside(Q3B)treatments,respectively.
?
用Q3A进行化感处理,随Q3A浓度的提高和处理时间的延长产生速率总体上呈逐渐升高的趋势,且在处理的0~48 h增速较快;其中,400 mg·L-1Q3A处理组的产生速率总体上均最高且增速最快,在48 h达到最高值(4.75 nmol·min-1·g-1),其后产生速率略有下降,但差异不显著;100和200 mg·L-1Q3A处理组产生速率均在72 h达到峰值,分别为4.43和4.65 nmol·min-1·g-1;50、25 和 12.5 mg·L-1Q3A 处理组产生速率在0~24 h增速较慢,在24 h后产生速率明显增加,且均在72 h达到峰值,分别为4.22、4.01 和 3.50 nmol·min-1·g-1。
2.1.2 对H2O2含量的影响 经不同质量浓度Q3A和Q3B水培处理后木麻黄幼苗小枝H2O2含量的动态变化见表2。由表2可见:在对照条件下木麻黄幼苗小枝中 H2O2含量为 0.71 ~0.79 μmol·g-1,变幅不大;而Q3A和Q3B各处理组的H2O2含量均高于对照,总体上差异达显著水平。
随着处理浓度的提高和处理时间的延长,各Q3A处理组的H2O2含量总体上呈逐渐增加的趋势,总体上在处理的0~48 h增速较快。其中,用400 mg·L-1Q3A处理,H2O2含量增速最快且均最高,在48 h达到最高值(6.74 μmol·g-1);用 100 和 200 mg·L-1Q3A处理,H2O2含量均在72 h达到最高值,分别为6.21和 6.41 μmol·g-1;用 50、25 和 12.5 mg·L-1Q3A 处理,0~24 h H2O2含量增幅较为缓慢,至72 h达到峰值,分别为 5.64、5.12 和 4.44 μmol·g-1。
用不同浓度Q3B处理,小枝中H2O2含量的变化趋势与Q3A处理类似,区别在于0~36 h H2O2含量增速较快。用400 mg·L-1Q3B处理,H2O2含量在36 h 达到最高值,为7.28 μmol·g-1;用200 mg·L-1Q3B处理,H2O2含量在 60 h 达到峰值(6.54 μmol·g-1)。总体上看,用不同浓度Q3B处理不同时期,H2O2含量均高于相应浓度的Q3A处理组。
表2 用Q3A和Q3B水培处理后木麻黄幼苗小枝H2O2含量的动态变化(±SD)1)Table 2 Dynamic change of H2O2content in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)
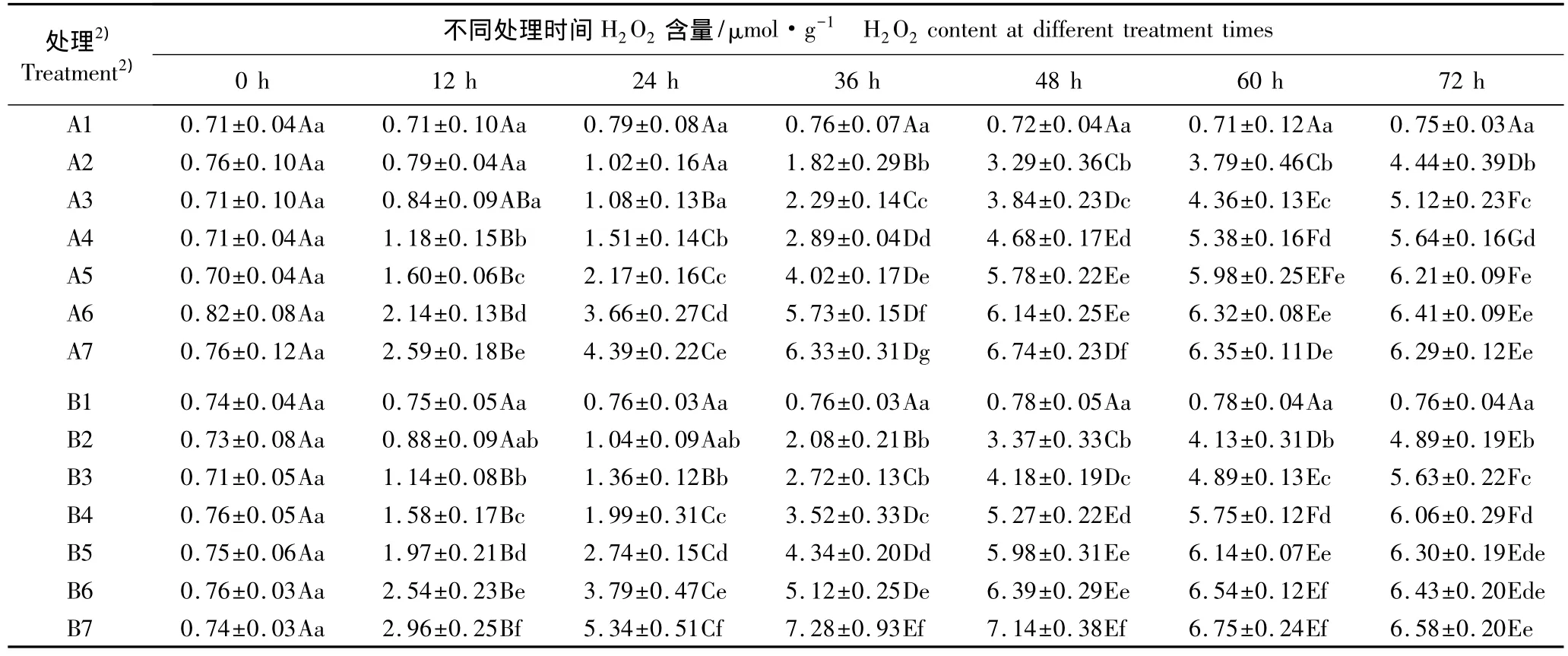
表2 用Q3A和Q3B水培处理后木麻黄幼苗小枝H2O2含量的动态变化(±SD)1)Table 2 Dynamic change of H2O2content in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)
1)同列中不同的小写字母表示同一化合物不同浓度处理间差异显著(P<0.05)Different small letters in the same column indicate the significant difference among different concentration treatments of the same compound(P<0.05);同行中不同的大写字母表示同一浓度处理在不同时间间差异显著(P<0.05)Different capitals in the same row indicate the significant difference among different times in the same concentration treatment(P<0.05).2)A1-A7:分别为0(对照)、12.5、25、50、100、200和400 mg·L-1槲皮黄素-3-α-阿拉伯糖苷(Q3A)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-α-araboside(Q3A)treatments,respectively;B1-B7:分别为0(对照)、12.5、25、50、100、200 和400 mg·L-1 槲皮黄素-3-β-葡萄糖苷(Q3B)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-β-glucoside(Q3B)treatments,respectively.
?
综合分析结果显示:木麻黄幼苗小枝H2O2含量对Q3A和Q3B处理的响应规律与产生速率类似,不同浓度Q3B处理组产生速率和H2O2含量的增幅均高于相应浓度的Q3A处理组,且用400 mg·L-1Q3B处理后产生速率和H2O2含量峰值出现的时间均由48 h提前至36 h。
2.1.3 对MDA含量的影响 经不同质量浓度Q3A和Q3B水培处理后木麻黄幼苗小枝MDA含量的动态变化见表3。由表3可见:在对照条件下木麻黄幼苗小枝中 MDA 含量均低于 1.97 μmol·g-1,且变幅不大;而Q3A和Q3B各处理组的MDA含量均高于对照,且总体上差异达显著水平。
随着处理浓度的提高和处理时间的延长,不同质量浓度Q3A处理组的MDA含量均呈逐渐增加的趋势,且均在72 h达到最高;其中,400 mg·L-1Q3A 处理组MDA含量在不同时期均最高;100、200和400 mg·L-1Q3A处理组MDA含量在0~48 h增速较快、在48 ~72 h 增速减缓;而50、25 和12.5 mg·L-1Q3A处理组MDA含量的增速相对缓慢。
用不同浓度Q3B处理,小枝中MDA含量变化趋势与Q3A处理类似,不同的是400 mg·L-1Q3B处理组的MDA含量在0~36 h增速较快、在36~72 h增速减缓。总体上看,用不同浓度Q3B处理不同时间,MDA含量均高于相应浓度的Q3A处理组,且木麻黄小枝MDA含量对不同浓度Q3A和Q3B化感处理的响应规律与产生速率和H2O2含量相似。
表3 用Q3A和Q3B水培处理后木麻黄幼苗小枝MDA含量的动态变化(±SD)1)Table 3 Dynamic change of MDA content in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)
1)同列中不同的小写字母表示同一化合物不同浓度处理间差异显著(P<0.05)Different small letters in the same column indicate the significant difference among different concentration treatments of the same compound(P<0.05);同行中不同的大写字母表示同一浓度处理在不同时间间差异显著(P<0.05)Different capitals in the same row indicate the significant difference among different times in the same concentration treatment(P<0.05).2)A1-A7:分别为0(对照)、12.5、25、50、100、200和400 mg·L-1槲皮黄素-3-α-阿拉伯糖苷(Q3A)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-α-araboside(Q3A)treatments,respectively;B1-B7:分别为0(对照)、12.5、25、50、100、200 和400 mg·L-1 槲皮黄素-3-β-葡萄糖苷(Q3B)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-β-glucoside(Q3B)treatments,respectively.
?
2.2 对SOD、CAT和POD活性的影响
2.2.1 对SOD活性的影响 经不同质量浓度Q3A和Q3B水培处理后木麻黄幼苗小枝SOD活性的动态变化见表4。由表4可见:随处理时间延长,不同浓度Q3A和Q3B处理组SOD活性均呈现先增后降的变化趋势,仅到达峰值的时间有所不同;其中,400 mg·L-1Q3A处理组SOD活性在12 h达到峰值,200、100、50、25 和12.5 mg·L-1Q3A 处理组 SOD 活性分别在24、36、48、60 和 60 h 达到峰值;400、200、100、50、25和12.5 mg·L-1Q3B处理组的SOD活性分别在12、24、24、36、48和48 h达到峰值。与相应浓度Q3A处理组相比,100、50、25 和 12.5 mg·L-1Q3B 处理组SOD活性均提前12 h达到峰值。各处理组SOD活性在处理的12~60 h均高于对照,总体上差异达显著水平;而在处理的72 h各处理组SOD活性与对照差异不显著。在处理的12~24 h,随Q3A和Q3B浓度的提高SOD活性逐渐增加;而在处理的36~60 h,随Q3A和Q3B浓度的提高SOD活性呈现先增后降的变化趋势,其中,用400 mg·L-1Q3A 或400 mg·L-1Q3B处理12 h,SOD活性均最高。
表4 用Q3A和Q3B水培处理后木麻黄幼苗小枝SOD活性动态的变化(±SD)1)Table 4 Dynamic change of SOD activity in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)
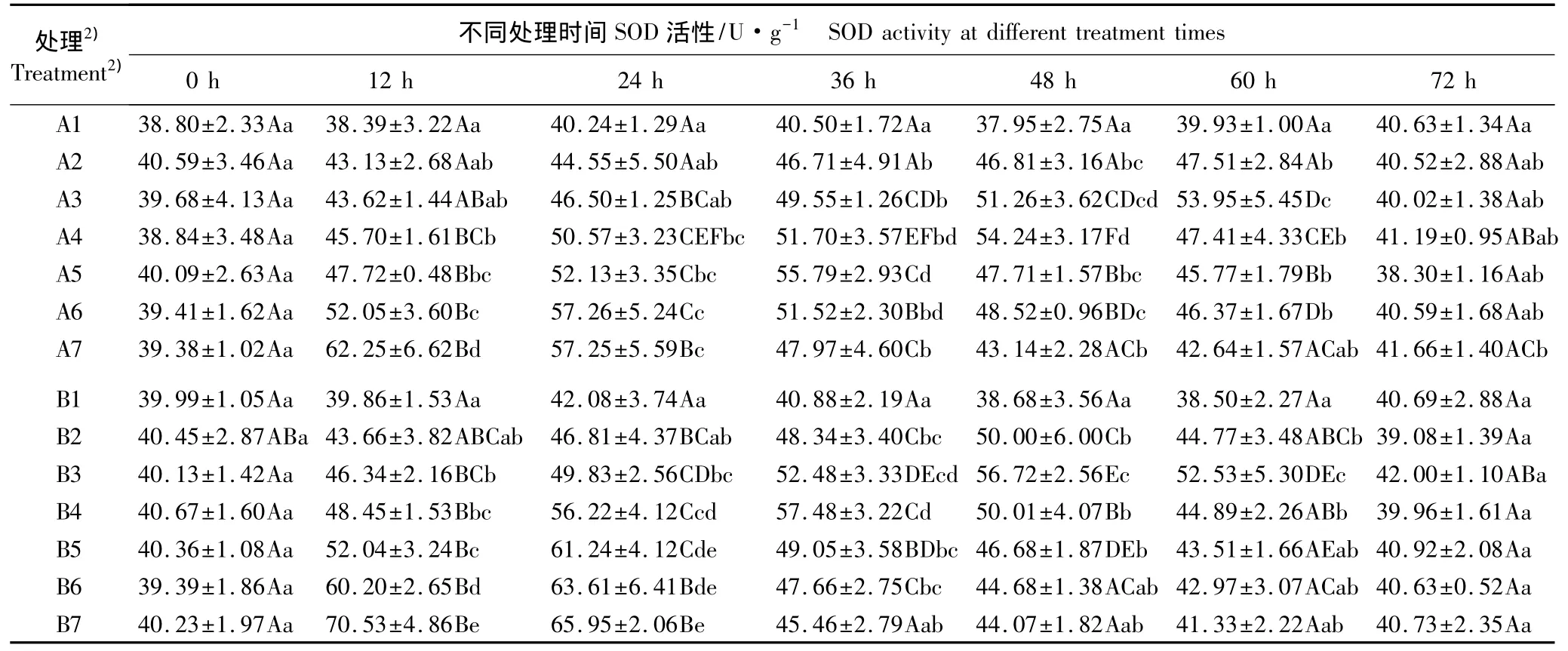
表4 用Q3A和Q3B水培处理后木麻黄幼苗小枝SOD活性动态的变化(±SD)1)Table 4 Dynamic change of SOD activity in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)
1)同列中不同的小写字母表示同一化合物不同浓度处理间差异显著(P<0.05)Different small letters in the same column indicate the significant difference among different concentration treatments of the same compound(P<0.05);同行中不同的大写字母表示同一浓度处理在不同时间间差异显著(P<0.05)Different capitals in the same row indicate the significant difference among different times in the same concentration treatment(P<0.05).2)A1-A7:分别为0(对照)、12.5、25、50、100、200和400 mg·L-1槲皮黄素-3-α-阿拉伯糖苷(Q3A)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-α-araboside(Q3A)treatments,respectively;B1-B7:分别为0(对照)、12.5、25、50、100、200 和400 mg·L-1 槲皮黄素-3-β-葡萄糖苷(Q3B)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-β-glucoside(Q3B)treatments,respectively.
?
2.2.2 对CAT活性的影响 经不同质量浓度Q3A和Q3B水培处理后木麻黄幼苗小枝CAT活性的动态变化见表5。由表5可见:随处理时间延长,不同浓度Q3A和Q3B处理组CAT活性均呈现先增后降的变化趋势,仅到达峰值的时间有所不同;其中,400和200 mg·L-1Q3A处理组CAT活性在24 h达到峰值,100、50、25和12.5 mg·L-1Q3A 处理组 CAT 活性分别在36、48、60 和 60 h 达到峰值;400、200、100、50、25 和12.5 mg·L-1Q3B 处理组 CAT 活性分别在24、24、24、36、48和48 h达到峰值,与相应浓度Q3A处理组相比较,100、50、25 和12.5 mg·L-1Q3B 处理组 CAT 活性均提前12 h达到峰值。除400和200 mg·L-1Q3B处理组外,各处理组CAT活性在处理的12~60 h均高于对照,且总体上差异达显著水平;而在处理的72 h各处理组CAT活性与对照差异不大。在处理的12~24 h,随Q3A浓度提高CAT活性逐渐增加;而在处理的36~72 h,随Q3A浓度提高CAT活性呈现先增后降的变化趋势。在处理的12~36 h,随Q3B浓度提高CAT活性逐渐增加;而在处理的48~72 h,随Q3B浓度提高CAT活性呈现先增后降的变化趋势。总体上看,用400 mg·L-1Q3A 或400 mg·L-1Q3B 处理24 h,CAT活性均最高。
2.2.3 对POD活性的影响 经不同质量浓度Q3A和Q3B水培处理后木麻黄幼苗小枝POD活性的动态变化见表6。由表6可以看出:随着处理时间的延长,不同浓度Q3A和Q3B处理组POD活性均呈现先增后降的变化趋势,仅到达峰值的时间有所不同;其中,400和200 mg·L-1Q3A处理组POD活性在12 h达到峰值,100、50、25 和 12.5 mg·L-1Q3A 处理组POD活性分别在24、36、36和36 h达到峰值;400、
200、100、50、25 和 12.5 mg·L-1Q3B 处理组 POD 活性分别在24、24、36、48、48 和 48 h 达到峰值,Q3B 各处理组POD活性峰值出现的时间均较相应浓度Q3A处理组延后12 h。
表5 用Q3A和Q3B水培处理后木麻黄幼苗小枝CAT活性的动态变化(±SD)1)Table 5 Dynamic change of CAT activity in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)

表5 用Q3A和Q3B水培处理后木麻黄幼苗小枝CAT活性的动态变化(±SD)1)Table 5 Dynamic change of CAT activity in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)
1)同列中不同的小写字母表示同一化合物不同浓度处理间差异显著(P<0.05)Different small letters in the same column indicate the significant difference among different concentration treatments of the same compound(P<0.05);同行中不同的大写字母表示同一浓度处理在不同时间间差异显著(P<0.05)Different capitals in the same row indicate the significant difference among different times in the same concentration treatment(P<0.05).2)A1-A7:分别为0(对照)、12.5、25、50、100、200和400 mg·L-1槲皮黄素-3-α-阿拉伯糖苷(Q3A)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-α-araboside(Q3A)treatments,respectively;B1-B7:分别为0(对照)、12.5、25、50、100、200 和400 mg·L-1 槲皮黄素-3-β-葡萄糖苷(Q3B)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-β-glucoside(Q3B)treatments,respectively.
处理2)Treatment2)不同处理时间 CAT 活性/U·g-1·min-1 CAT activity at different treatment times 0 h 12 h 24 h 36 h 48 h 60 h 72 h A1 63.07±2.47Aa 60.84±4.49Aa 65.87±2.78Aa 62.30±7.32Aa 65.16±2.18Aa 59.94±1.34Aa 65.32±2.78Aa A2 62.24±4.66Aa 66.66±4.01ABab 75.29±4.42BCa 79.76±5.83CDb 85.34±5.30DEbc 92.25±5.60Ebc 59.41±5.51Aab A3 63.73±3.19Aa 74.99±2.46Bbc 86.86±4.17Cb 92.10±3.21CDbc 95.64±2.91CDcd 100.26±12.56Db 62.71±1.69Aab A4 64.31±2.52Aa 78.02±2.53Bc 91.96±5.69CDb 95.04±7.61Dc 99.42±7.86Dd 83.03±8.47BCcd 65.07±1.37Aa A5 64.48±1.50ADa 86.64±2.20Bd 95.81±4.94Bb 110.24±5.90Cd 87.71±7.53Bbc 72.10±6.81Dad 61.50±3.50Aab A6 65.06±2.59ADa 88.91±7.55Bd 112.11±8.49Cc 92.39±6.40Bbc 82.96±6.94Bb 70.99±6.05Dad 57.48±5.67Ab A7 64.46±3.13AEa 98.32±7.36Be 123.46±8.85Cd 104.80±11.73Bcd 81.56±5.18Db 69.01±3.20Ea 56.19±3.52Ab B1 62.81±4.80Aa 62.80±4.32Aa 61.21±4.89Aa 58.73±6.03Aa 63.49±2.62Aa 64.52±2.47Aa 61.77±7.60Aab B2 61.79±6.58Aa 71.40±4.55Ba 82.50±2.76Cb 94.20±4.01Db 98.43±4.43Db 72.81±8.75Bab 61.33±3.69Aab B3 62.21±5.98Aa 81.17±5.81Bb 92.50±2.76Cb 102.53±4.97CDb 109.35±5.29Dc 78.11±11.99Bb 61.98±1.66Aab B4 60.79±6.78Aa 88.93±1.56Bbc108.55±7.29Cc 114.12±6.46Cc 98.05±7.22Bb 73.74±4.36Dab 64.80±2.54ADb B5 63.45±6.36Aa 94.44±3.73Bcd 121.28±9.37Cd 115.58±6.47Cc 84.02±8.09Bd 72.08±4.31Aab 62.71±1.93Aab B6 62.83±3.04Aa 102.75±8.72Bd 128.86±7.72Cde116.56±8.74Dc 76.97±2.98Ed 63.22±7.00Aa 57.84±6.47Aab B7 63.77±5.66Aa 113.41±7.06Be 135.43±6.84Ce 121.66±8.01Bc 75.01±4.23Dd 61.67±5.30Aa 55.23±2.65Aa
表6 用Q3A和Q3B水培处理后木麻黄幼苗小枝POD活性的动态变化(±SD)1)Table 6 Dynamic change of POD activity in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)

表6 用Q3A和Q3B水培处理后木麻黄幼苗小枝POD活性的动态变化(±SD)1)Table 6 Dynamic change of POD activity in branchlet of Casuarina equisetifolia Forst.seedling after hydroponics with Q3A and Q3B(±SD)1)
1)同列中不同的小写字母表示同一化合物不同浓度处理间差异显著(P<0.05)Different small letters in the same column indicate the significant difference among different concentration treatments of the same compound(P<0.05);同行中不同的大写字母表示同一浓度处理在不同时间间差异显著(P<0.05)Different capitals in the same row indicate the significant difference among different times in the same concentration treatment(P<0.05).2)A1-A7:分别为0(对照)、12.5、25、50、100、200和400 mg·L-1槲皮黄素-3-α-阿拉伯糖苷(Q3A)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-α-araboside(Q3A)treatments,respectively;B1-B7:分别为0(对照)、12.5、25、50、100、200 和400 mg·L-1 槲皮黄素-3-β-葡萄糖苷(Q3B)处理 Representing 0(CK),12.5,25,50,100,200 and 400 mg·L-1quercetin-3-β-glucoside(Q3B)treatments,respectively.
处理2)Treatment2)不同处理时间POD活性/U·g-1·min-1 POD activity at different treatment times 0 h 12 h 24 h 36 h 48 h 60 h 72 h A1 30.68±0.72Aa 29.81±2.74Aa 30.53±0.50Aa 31.31±2.89Aa 31.74±1.53Aa 31.14±3.86Aa 30.00±0.80Aa A2 28.69±3.11Aa 33.76±1.34ABa 37.19±2.30Bab 46.33±6.52Cb 32.05±4.68ABa 32.96±2.23ABa 30.30±3.66ABa A3 30.49±1.84Aa 35.79±2.44Aa 43.17±5.33Cbc 51.48±7.00Dbc 32.77±2.60Aa 33.85±4.07Aa 31.32±2.92Aa A4 29.93±3.04Aa 41.21±2.06Bab 48.79±2.43Cc 56.01±6.08Dc 34.63±3.45ABa 34.46±5.57ABa 30.25±3.96Aa A5 29.65±1.89Aa 49.23±8.96Bb 58.94±9.54Bd 34.15±3.59Aa 34.33±4.64Aa 34.31±4.25Aa 30.90±2.93Aa A6 29.77±2.87Aa 63.67±9.35Bc 36.68±3.16Aab 37.37±2.91Aa 36.33±7.24Aa 34.17±4.29Aa 30.69±2.65Aa A7 29.27±2.09Aa 73.28±11.35Bc 33.74±3.11Aa 35.65±2.99Aa 34.85±4.45Aa 30.83±3.50Aa 29.76±2.11Aa B1 29.65±4.01Aa 31.35±2.58Aa 30.60±3.36Aa 29.57±3.85Aa 30.79±2.70Aa 30.81±2.65Aa 30.40±0.27Aa B2 30.37±3.84Aa 33.76±3.37Aab 40.66±2.05Bb 43.74±1.84Bb 46.10±3.82Bb 29.49±2.82Aa 30.75±2.94Aa B3 31.26±4.09Aa 37.42±2.85Bbc 45.30±3.10Cbc 48.82±2.17CDbd 52.74±2.74Dbc 31.37±3.68Aa 32.04±1.59Aa B4 30.10±0.57Aa 40.30±2.03Bc 49.31±2.50Ccd 54.41±2.70CDcd 58.77±7.75Dc 31.73±3.44Aa 31.04±2.87Aa B5 30.09±2.62Aa 46.18±3.15Bd 53.85±1.94Cd 60.62±5.18Dc 32.00±2.17Aa 29.36±3.83Aa 31.97±2.36Aa B6 31.27±2.09Aa 53.48±2.87Be 59.55±3.41Bd 53.18±3.06Bd 31.83±6.00Aa 30.95±3.87Aa 32.00±3.08Aa B7 30.40±1.65Aa 59.76±2.99Bf 66.06±5.16Bf 36.08±6.31Aa 34.04±7.23Aa 30.94±3.88Aa 31.40±6.18Aa
各处理组POD活性在处理的12~48 h均高于对照,总体上差异达显著水平;而在处理的60~72 h各处理组POD活性均与对照差异不显著。在处理的12 h,随Q3A浓度提高POD活性逐渐增加;而在处理的24~72 h,随Q3A浓度提高POD活性呈现先增后降的变化趋势。在处理的12~24 h,随Q3B浓度提高POD活性逐渐增加;而在处理的36~72 h,随Q3B浓度提高POD活性呈现先增后降的变化趋势。总体上看,用 400 mg·L-1Q3A 处理 12 h或用 400 mg·L-1Q3B处理24 h,POD活性均最高。
3 讨 论
诸多研究结果表明:化感作用下植物细胞内活性氧自由基代谢失衡进而引起自由基积累和膜脂过氧化,使膜系统结构和功能受到损伤,是化感作用造成细胞伤害的重要原因之一[5-9,28]。本实验结果显示:随着外源化感成分Q3A和Q3B质量浓度提高和处理时间延长,木麻黄幼苗小枝中产生速率和H2O2含量呈逐渐增加的趋势,且在高浓度(400 mg·L-1)Q3A处理条件下产生速率和H2O2含量均在48 h达到峰值,而400 mg·L-1Q3B处理组的产生速率和H2O2含量则提前12 h达到峰值。木麻黄幼苗小枝中MDA含量也随处理时间延长及Q3A和Q3B质量浓度提高呈增加趋势。说明在化感作用下,活性氧代谢平衡被打破,木麻黄幼苗小枝中和H2O2快速积累、MDA含量持续升高,引起膜质过氧化作用加剧,使质膜透性不断增大且质膜稳定性持续降低。Q3A和Q3B对木麻黄幼苗小枝ROS代谢的影响机制类似但影响程度不同,Q3B处理0~36 h木麻黄幼苗小枝O产生速率、H2O2含量和MDA含量增速快于Q3A,且Q3B各处理组产生速率、H2O2含量和MDA含量水平均高于相应浓度的Q3A处理组,因此,相对于Q3A,Q3B对木麻黄小枝细胞造成的伤害更严重。
在逆境条件下植物体内ROS的增加除对细胞造成严重伤害外,还可以作为防御化学信号分子,启动植物体内的抗氧化系统[3,29],这是植物在长期进化过程中所形成的抗性机制,其中SOD、POD和CAT等是抗氧化系统中主要的活性氧清除酶。本实验结果显示:在Q3A和Q3B化感作用下木麻黄幼苗小枝中SOD、POD和CAT活性呈先增后降的趋势;在化感作用初期,随ROS累积量增加,SOD、POD和CAT活性也随之提高;在高浓度(400和200 mg·L-1)化感作用条件下,活性氧积累急剧增加,SOD、POD和CAT活性也显著提高;其后随处理时间延长3个酶的活性降低,且化感成分浓度越低各保护酶活性增加越缓慢。这种现象与胁迫后期和H2O2积累过量,导致保护酶合成下降或降解增强所致。但林武星[21]的研究结果表明:木麻黄小枝POD、CAT和SOD活性随木麻黄根系水浸提液浓度升高而下降,而MDA和H2O2含量及产生速率则逐渐增加,这与本研究结果有一定的差异,其原因与木麻黄不同器官化感成分存在差异有关,也说明水溶性化感成分组成复杂,要明晰其化感作用机制更为困难。在外源Q3A化感作用下木麻黄幼苗小枝保护酶活性的变化趋势与外源Q3B化感处理基本一致仅达到峰值的时间不同,在中度(100和50 mg·L-1)和轻度(25 和 12.5 mg·L-1)Q3B 化感作用下SOD和CAT活性的峰值较相应浓度Q3A处理均提前12 h,且Q3B各处理组SOD和CAT活性的峰值高于Q3A;而其POD活性的峰值出现的时间较Q3A均延后12 h,且Q3B各处理组POD活性的峰值低于Q3A。表明这2种外源化感成分对木麻黄幼苗小枝保护酶合成或降解的影响程度有差异。
综上所述,木麻黄幼苗小枝中SOD、CAT和POD对H2O2和等ROS的清除受2类外源化感成分浓度和处理时间的影响,在中度(100和50 mg·L-1)和 轻 度(25和12.5 mg·L-1)Q3A和Q3B短期(0~48 h)作用下,ROS积累速率较慢,保护酶的清除作用有效;但当化感成分浓度提高及处理超过一定时间后,植物体内产生过量ROS,引起保护酶活性下降,对ROS的清除效率降低,引起膜质过氧化,对植物造成不可逆的伤害,这可能是这2种外源化感成分对木麻黄的毒害机制之一。实验结果还表明:浓度和时间的叠加效应会加重化感物质对木麻黄的伤害。自然界中化感物质的释放和积累是一个漫长的过程,因此在木麻黄造林过程中,头茬种植的木麻黄会释放化感物质并对二次种植的木麻黄幼苗的生长产生化感作用。供试2类外源化感成分对木麻黄幼苗的化感作用程度存在差异,造成这种差异的原因还有待进一步深入研究。
[1]李兆佳,喻 杰,樊大勇,等.克隆整合提高淹水胁迫下狗牙根根部的活性氧清除能力[J].生态学报,2011,31(17):4992-4999.
[2]王小平,宋东杰,周泉澄,等.Cr3+胁迫对苦草叶片活性氧清除系统和叶细胞超微结构的影响[J].植物资源与环境学报,2008,17(2):56-60.
[3]袁 琳,克热木·伊力,张利权.NaCl胁迫对阿月浑子实生苗活性氧代谢与细胞膜稳定性的影响[J].植物生态学报,2005,29(6):985-991.
[4]王 鑫,郭平毅,原向阳,等.2,4-D丁酯对罂粟(Papaver somniferum L.)保护酶活性及脂质过氧化作用的影响[J].生态学报,2008,28(3):1098-1103.
[5]曹光球,杨 梅,林思祖,等.邻羟基苯甲酸对不同化感型杉木无性系抗氧化酶活性的化感效应[J].中国生态农业学报,2010,18(6):1267-1271.
[6]FOYER C H,NOCTOR G.Oxygen processing in photosynthesis:regulation and signaling[J].New Phytologist,2000,146:359 -388.
[7]SALIN M L.Toxic oxygen species and protective system of the chloroplast[J].Physiologia Plantarum,1987,72:681-689.
[8]SHAH K,KUMAR R G,VERMA S,et al.Effect of cadmium on lipid peroxidation,superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J].Plant Science,2001,161:1135-1144.
[9]MITTLER R,VANDERAUWERA S,GOLLERY M,et al.Reactive oxygen gene network of plants[J].Trends in Plant Science,2004,9:490-498.
[10]MAIR A,FARES A.Throughfall characteristics in three non-native Hawaiian forest stands[J].Agricultural and Forest Meteorology,2010,150(11):1453-1466.
[11]SCHMID J L,ADDISON D S,DONNELLY M A,et al.The effect of Australian pine(Casuarina equisetifolia)removal on Loggerhead Sea Turtle(Caretta caretta)incubation temperatures on Keewaydin Island,Florida[J].Journal of Coastal Research,2008,55:214-220.
[12]林武星,叶功富,谭芳林,等.沙岸木麻黄防护林不同更新模式土壤结构分形特征及其效应[J].中国生态农业学报,2008,16(6):1352-1357.
[13]张水松,叶功富,徐俊森,等.木麻黄基干林带类型划分和更新造林关键技术研究[J].林业科学,2002,38(2):44-53.
[14]MANTZ G,RONCO L,MONACO C.First record in Argentina of powdery mildew of Casuarina cunnighamiana caused by Oidium sp.[J].Journal of Plant Pathology,2008,90(2):397.
[15]SURESH K K,VINAYA A S.Studies on the allelopathic effects of some agroforestry tree crops[J].The International Tree Crops Journal,1987,4:109-115.
[16]邓桂兰,孔垂华,骆世明.木麻黄小枝提取物的分离鉴定及其对幼苗的化感作用[J].应用生态学报,1996,7(2):145-149.
[17]林武星,洪 伟,叶功富.木麻黄根系浸提液对幼苗营养吸收和生长的影响[J].浙江林学院学报,2005,22(2):170-175.
[18]林武星.木麻黄自身他感作用影响因素及缓解[J].防护林科技,2006(6):1-5.
[19]林武星.自身他感作用物对木麻黄幼苗叶绿素及糖类的影响[J].浙江林学院学报,2007,24(1):12-16.
[20]林武星.木麻黄自毒作用物对其幼苗内源激素的影响[J].中国农学通报,2009,25(19):100-103.
[21]林武星.自身他感作用物对木麻黄苗木活性氧代谢影响[J].福建农业学报,2010,25(1):108-113.
[22]黄舒静,曾 琦,张立华,等.短枝木麻黄小枝单宁对其幼苗生长及单宁含量的效应[J].热带亚热带植物学报,2009,17(5):471-476.
[23]王春晴,刘 强,张渝杰,等.木麻黄水浸提液对青皮种子的化感效应[J].西北林学院学报,2012,27(3):80-86.
[24]PROCHAZKOVA D,SAIRAM R K,SRIVASTAVA G C,et al.Oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J].Plant Science,2001,161:765-771.
[25]KE D S,WANG A G,SUN G C,et al.The effect of active oxygen on the activity of ACC synthase induced by exogenous IAA[J].Acta Botany Sinica,2002,44(5):551-556.
[26]赵世杰,许长成,邹 琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.
[27]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[28]POLITYCKA B.Peroxidase activity and lipid peroxidation in root of cucumber seedlings influenced by derivatives of cinnamic and benzoic acids[J].Acta Physiologiae Plantarum,1996,18(4):365-370.
[29]BANERJEE B D,SETH V,BHATTARYA A.Biochemical effects of some pesticides on lipid peroxidation and free-radical scavengers[J].Toxical Letters,1999,107:33-47.
