年龄和环境条件对泥蚶富集重金属镉和铜的影响
2013-12-09王召根吴洪喜陈肖肖高业田
王召根,吴洪喜,陈肖肖,高业田
(1. 上海海洋大学 水产与生命学院,上海 201306;2. 浙江省海洋水产养殖研究所,温州 325000;3. 浙江省近岸水域生物资源开发与保护重点实验室,温州 325005;4. 华东理工大学 生物与化学工程学院,上海 200237)
年龄和环境条件对泥蚶富集重金属镉和铜的影响
王召根1,2,吴洪喜2,3,*,陈肖肖2,4,高业田1,2
(1. 上海海洋大学 水产与生命学院,上海 201306;2. 浙江省海洋水产养殖研究所,温州 325000;3. 浙江省近岸水域生物资源开发与保护重点实验室,温州 325005;4. 华东理工大学 生物与化学工程学院,上海 200237)
采用实验生态学的方法研究了不同年龄、暴露时间、水温和盐度对泥蚶(Tegillarcagranosa)富集重金属Cd、Cu的影响。在重金属Cd和Cu的浓度分别为0.5mg/L和1mg/L海水中,实验96h后,泥蚶对重金属Cd、Cu的吸收和富集能力呈现以下规律:(1)与年龄的大小成反比,1龄组和3龄组泥蚶软体部中重金属Cd、Cu的含量分别为60.434、38.598μg/g和30.914、21.617μg/g;(2)随暴露时间的延长而增强,暴露7天后泥蚶软体部重金属Cd和Cu的含量分别达118.293μg/g和315.328μg/g;(3)与水温的高低成正比,水温15℃组与30℃组的泥蚶软体部中重金属Cd、Cu的含量分别为44.524、33.805μg/g和125.859、576.504μg/g;(4)与海水的盐度成反比,盐度10组和盐度30组的泥蚶软体部中重金属Cd、Cu的含量分别为69.958、32.226μg/g和10.191、12.564μg/g。(5)泥蚶对重金属Cd、Cu的吸收和富集量以外套膜为最高,分别达131.433、289.432μg/g;闭壳肌最低,分别为34.812、47.759μg/g。重金属Cd和Cu在不同组织器官中含量分别为:外套膜gt;内脏gt;鳃gt;足gt;闭壳肌和外套膜gt;鳃gt;内脏gt;足gt;闭壳肌。
年龄;环境条件;泥蚶;镉;铜;富集
泥蚶(Tegillarcagranosa),俗称花蚶、血蚶、粒蚶等,属双壳类,常见于印度洋及太平洋的热带、亚热带近岸海域,我国山东半岛以南诸海区均有分布,是我国山东、江苏、浙江、福建、广西等省的主要养殖贝类之一。泥蚶等双壳类由于自身用于代谢的混合氧化系统存在缺陷,对重金属的释放与鱼类和甲壳类动物相比慢得多,导致体内重金属含量不断升高[1- 3],也就是所谓的对重金属离子的富集作用[4- 6],双壳类中的泥蚶是近年来出现重金属含量超标现象较多的种类之一。人类食用受重金属污染的贝类会造成不同程度的中毒现象[7- 9]。
关于贝类富集重金属的研究报道已有不少,初步表明影响重金属富集的主要因子包括自身生物因子和非生物因子[10- 12],但其具体机理尚不十分清楚[13]。本文以我国浙江沿海一带的主要养殖贝类泥蚶为研究对象,探讨了年龄、暴露时间、水温和盐度对泥蚶富集重金属Cd、Cu的影响,以期为研究贝类富集重金属机理提供参考,同时为新的近岸海域水质标准的制定,全面有效地防治日益严重的海洋重金属污染提供基础资料。
1 材料与方法
1.1 实验生物与暂养
实验生物泥蚶于2011年11月取自浙江省温州市乐清湾清江养殖区,其生物学数据用游标卡尺和电子天平进行测量和称重,测定结果见表1。
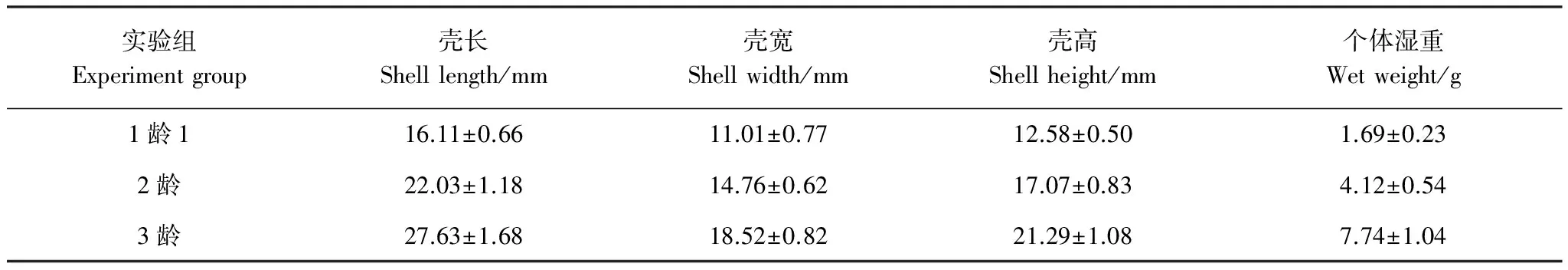
表1 实验生物泥蚶的生物学数据测定结果
实验用的自然海水取自浙江省温州市乐清湾海区,经沉淀、砂滤、曝气后使用。盐度25—27,pH值8.03—8.28,水温(17.47±1.82)℃。油类、总汞、铜、锌、铅、镉、铬等指标均符合《渔业水质标准》(GB11607—89)。
经挑选的健康泥蚶个体,在清洗掉表面附着物后,放入水族箱中暂养。暂养期间不间断充气,每天换水1/2,换水后投喂扁藻(Platymonassubcordiformis)饵料,密度为5×104细胞/mL,泥蚶个体在暂养1周后供实验使用。
1.2Cd2+和Cu2+母液配制与实验设计
分别用分析纯氯化镉(CdCl2·2.5H2O)和分析纯硫酸铜(CuSO4·5H2O)与去离子水配成质量浓度为10mg/L的Cd2+和Cu2+母液备用。
除暴露时间实验使用泥蚶20个外,其余实验均使用泥蚶10个。将实验泥蚶放入6L塑料盆中,向每个盆注入海水3L,再用配制好的重金属母液调节到《渔业水质标准》中相应重金属限量值的100倍,即分别为0.5mg/L的Cd2+和1mg/L的Cu2+。实验期间连续充气,不投饵,每隔24h换入含有相应浓度重金属的新鲜海水,每个实验组设置3个平行。实验时间除暴露时间实验延长至7d外,其它均为96h。各实验组的具体方案设计如下:
年龄实验 设定1龄蚶、2龄蚶、3龄蚶3个年龄梯度。
组织器官实验 均用2龄蚶,实验结束后分别测定泥蚶鳃、外套膜、内脏、足和闭壳肌中重金属Cd和Cu的含量。
暴露时间实验 均用2龄蚶,分别于实验1、2、3、4d和7d后取样。
水温实验 设4个温度梯度,分别为15、20、25、30℃。均用2龄蚶,实验前对泥蚶进行1周的温度驯化。使用水浴箱调控不同水温。
盐度实验 设5个盐度梯度,分别为10、15、20、25、30。均用2龄蚶,实验前对泥蚶进行1周的盐度驯化。不同盐度的实验海水用自然海水、曝气自来水和海水晶配置。
1.3 取样与测定
根据实验设计,除暴露时间实验分别于1、2、3、4d和7d后随机抽取3个泥蚶样品外,其它均在实验结束后随机抽取3个泥蚶样品,除组织器官实验特取指定部位外,其它实验均取泥蚶的整个软体部,样品在80℃烘箱中烘至恒重,冷却后将样品研磨成粉,分别装入密封袋中,干燥保存。
分别称取0.2g左右的泥蚶软体部或组织器官样品和扇贝标准物质(GBW10024),在80℃烘箱中烘至恒重,冷却后称量。微波消解仪消解后用火焰原子吸收分光光度法(AA240FS/GFA,Valian)测定样品中的重金属Cd、Cu含量。分析过程中使用扇贝标准物质做回收率监测(实际测得回收率为90.36%—108.25%)。
1.4 数据处理
实验数据利用SPSS统计软件(版本:19.0)进行单因素方差分析(ANOVA),定为Plt;0.05为差异显著,Plt;0.01为差异极显著。数据统计结果表示为平均值±标准偏差(Mean±SD)。
2 结果与分析
2.1不同年龄泥蚶富集重金属Cd、Cu的能力
图1为不同年龄泥蚶组富集重金属Cd和Cu的实验结果。可见,泥蚶对重金属Cd和Cu的富集能力与年龄的大小成反比,实验96h后1龄组和3龄组软体部中重金属Cd、Cu的含量分别为60.434、38.598μg/g和30.914、21.617μg/g。方差分析(ANOVA)表明,1龄泥蚶对重金属Cd、Cu的富集能力显著高于其它年龄组(Plt;0.05)。各年龄组间泥蚶软体部中的重金属Cd含量存在显著性差异(Plt;0.05);2龄和3龄泥蚶软体部中的重金属Cu含量没有显著性差异(Pgt;0.05),其余各年龄组间都有显著性差异(Plt;0.05)。
2.2 泥蚶不同组织器官富集重金属Cd、Cu的能力
泥蚶不同组织器官富集重金属Cd、Cu的实验结果见图2。实验96h后,各组织器官中重金属Cd和Cu的含量顺序分别为:外套膜gt;内脏gt;鳃gt;足gt;闭壳肌和外套膜gt;鳃gt;内脏gt;足gt;闭壳肌。重金属Cd和Cu的含量在5种组织中,以外套膜最高,分别达131.433、289.432μg/g;闭壳肌最低,分别为34.812、47.759μg/g。方差分析(ANOVA)表明:5种组织中,重金属Cd含量在鳃和内脏、闭壳肌和足之间的差异性不显著(Pgt;0.05),其余各组织之间差异性显著(Plt;0.05);重金属Cu含量在外套膜和鳃、内脏和足、足和闭壳肌之间的差异性不显著(Pgt;0.05),其余各组织间差异性显著(Plt;0.05)。
2.3 暴露时间对泥蚶富集重金属Cd、Cu的影响
实验结果表明(表2),泥蚶对重金属Cd和Cu的富集量随暴露时间的延长而上升,暴露7d后重金属Cd和Cu的含量高达118.293μg/g和315.328μg/g。对泥蚶在重金属Cd和Cu环境中暴露不同时间的实验结果多重比较显示,不同暴露时间的实验组泥蚶软体部富集重金属Cd、Cu的含量差异性显著(Plt;0.05)。泥蚶软体部中的重金属Cd含量,暴露时间2d和3d的组间差异性不显著(Pgt;0.05),其它组间差异性显著(Plt;0.05);泥蚶软体部中重金属Cu含量,暴露时间1d和2、2d和3d组之间的差异性不显著(Pgt;0.05),其它组间的差异性显著(Plt;0.05)。直线回归分析结果表明(图3),泥蚶体内重金属Cd和Cu的含量与暴露时间之间呈显著的正相关关系(Plt;0.01),其直线回归方程式分别为:y1=47.06t-25.46(R2=0.987)和y2=13.54t+27.74(R2= 0.941),式中y1为泥蚶体内Cd含量(μg/g干重),y2为泥蚶体内Cu含量(μg/g干重),t为暴露时间。

图1 不同年龄的泥蚶富集重金属Cd、Cu的情况 Fig.1 Accumulation of Cd, Cu in somatic tissues of Tegillarca granosa at different ages标有不同字母的数值间存在显著性差异(Plt;0.05)
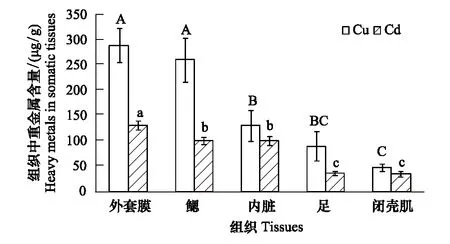
图2 泥蚶不同组织器官富集重金属Cd、Cu的情况 Fig.2 Accumulation of Cd, Cu in various tissues of Tegillarca granosa 标有不同字母的数值间存在显著性差异(Plt;0.05)
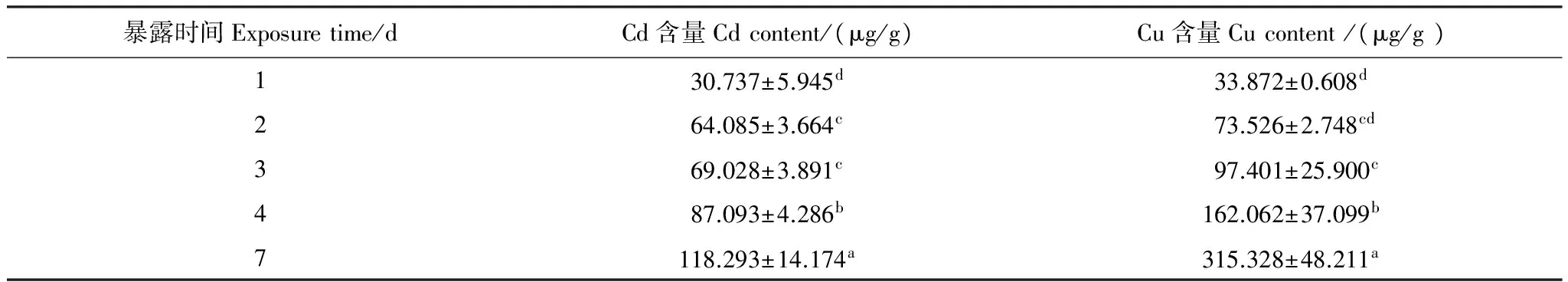
表2 暴露时间对泥蚶富集重金属Cd、Cu的影响
同列数值上字母不同,表示组间差异性显著(Plt;0.05)
2.4 水温对泥蚶富集重金属Cd、Cu的影响
实验结果(表3)显示,泥蚶对重金属Cd和Cu的富集能力随水温的升高而增强,实验96小时后, 水温15℃组与水温30℃组的泥蚶软体部中重金属Cd、Cu的含量分别为44.524μg/g、33.805μg/g和125.859μg/g、576.504μg/g。方差分析(ANOVA)表明,水温对泥蚶软体部富集重金属Cd和Cu具有极显著的影响(Plt;0.01),泥蚶软体部中重金属Cd和Cu的含量在不同温度实验组间均差异显著(Plt;0.05)。直线回归分析结果表明(图4),泥蚶体内重金属Cd和Cu的含量与暴露水体温度之间呈显著的正相关关系(Plt;0.05),其直线回

表3 水温对泥蚶富集重金属Cd、Cu的影响
同列数值上字母不同,表示组间差异性显著(Plt;0.05)
归方程式分别为:y1=5.254x+29.64(R2= 0.977)和y2=38.65x-577.2(R2=0.960),式中y1为泥蚶体内Cd含量(μg/g干重),y2为泥蚶体内Cu含量(μg/g干重),x为水温。
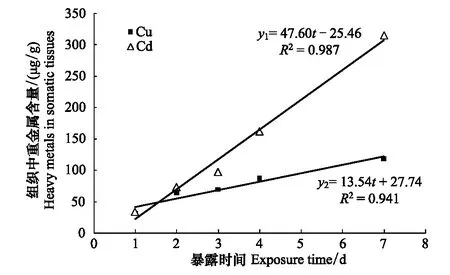
图3 泥蚶体内重金属Cd和Cu的含量与暴露时间之间的相关性Fig.3 Correlation between the heavy metals (Cd and Cu) in somatic tissues of Tegillarca granosa and the exposure times
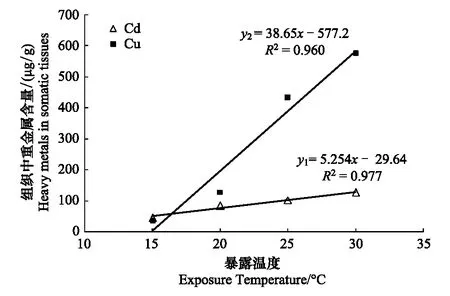
图4 泥蚶体内重金属Cd和Cu的含量与水温之间的相关性Fig.4 Correlation between the heavy metals (Cd and Cu) in somatic tissues of Tegillarca granosa and the water temperature
2.5 盐度对泥蚶富集重金属Cd、Cu的影响
实验结果(表4)表明,泥蚶对重金属Cd和Cu的富集能力随海水盐度的升高而下降,在海水中重金属Cd和Cu浓度分别为0.5mg/L和1.0mg/L的条件下,实验时间96h后,盐度10组和盐度30组泥蚶软体部中重金属Cd、Cu的含量分别为69.958、32.226μg/g和10.191、12.564μg/g。方差分析(ANOVA)表明,盐度对泥蚶软体部重金属Cd和Cu的富集能力具有极显著的影响(Plt;0.01)。各盐度组间泥蚶软体部重金属Cd含量存在显著差异(Plt;0.05);15、20和25盐度组间重金属Cu含量差异不显著(Pgt;0.05),其余盐度组间差异性显著(Plt;0.05)。直线回归分析结果表明(图5),泥蚶体内重金属Cd和Cu的含量与海水盐度之间呈显著的负相关关系(Plt;0.05),其直线回归方程式分别为:y1=-2.86x-96.2(R2=0.986)和y2=-0.848x+39.14(R2= 0.920),式中y1为泥蚶体内Cd含量(μg/g干重),y2为泥蚶体内Cu含量(μg/g干重),x为盐度。
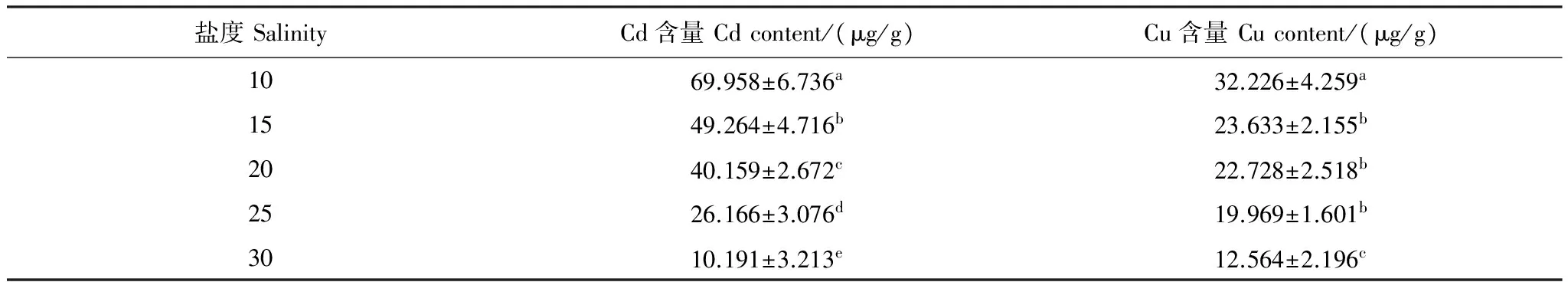
表4 盐度对泥蚶富集重金属Cd、Cu的影响
同列数值上字母不同,表示组间差异显著(Plt;0.05)

图5 泥蚶体内重金属Cd和Cu的含量与盐度之间的相关性Fig.5 Correlation between the heavy metals (Cd and Cu) in somatic tissues of Tegillarca granosa and the salinity
3 讨论
3.1 年龄对贝类生物富集重金属的影响分析
本实验结果表明泥蚶对重金属Cd、Cu的富集能力随年龄增加而下降,类似的规律也见于其它的研究报道。如:吴玉霖[14]发现毛蚶(Scapharcasubcrenata)年龄小的比年龄大的对重金属Hg有较强的富集能力;Dewolf[15]研究表明采集于同一地点的紫贻贝(Mytilusedulis),较小个体比较大个体含有较高浓度的重金属Hg;Boyden[16]也报道了紫贻贝体内重金属Pb、Cu、Zn和Fe的浓度随年龄的增加而减少。可见,贝类生物体的年龄与其体内重金属含量之间呈负相关是较为普遍的现象。这可能是由于年龄较小的贝类生物处于较快的生长阶段,其新陈代谢更为旺盛[17],因此具有对重金属较强的富集能力。
3.2 贝类不同组织器官富集重金属的能力分析
生物的不同组织器官对重金属Cd和Cu的富集能力普遍具有较大差异。崔可铎等[12]报道了毛蚶对重金属Cd、Cu、Pb、Ni和Cr的富集能力大小顺序,依次为:鳃gt;外套膜gt;闭壳肌gt;内脏gt;肌肉。蔡立哲等[18]报道了重金属Zn、Pb在菲律宾蛤仔(Ruditapesphilippinarum)2种器官的富集系数大小顺序为:鳃gt;软体部。本实验的研究结果表明各组织中重金属Cd和Cu的含量顺序分别为:外套膜gt;内脏gt;鳃gt;足gt;闭壳肌和外套膜gt;鳃gt;内脏gt;足gt;闭壳肌。在泥蚶的呼吸代谢过程中,鳃和外套膜是泥蚶与外界水体交换首先接触和关系最为密切的器官,水体中的溶解态重金属更容易被其吸收,因而有可能含有较高的重金属含量。内脏作为泥蚶的解毒和排泄器官,也成为重金属富集的主要场所。因此,泥蚶不同组织器官对同一种重金属或不同种重金属的富集机制很有可能是不同的[19]。
3.3 暴露时间对贝类富集重金属的影响
本实验结果表明泥蚶软体部内重金属Cd、Cu含量随暴露时间延长而增加,与崔可铎等[12]在毛蚶富集和排出实验结果很相似,毛蚶对Cu、Pb、Ni、Cr和Cd都有一定的富集能力,富集量随时间的延长而增加。可见,双壳类软体动物富集重金属有着共同的特性,暴露在重金属污染的水环境中进行呼吸代谢的同时也不断地富集重金属,而且时间越长,富集越多。
3.4 水温对贝类富集重金属的影响
由于水生动物不能调节自身的体温,环境温度的改变将显著影响其生理活动,尤其是机体的代谢活动,而且也能影响周围环境中重金属的化学性质,因此,温度是影响水生动物富集重金属的重要影响因子[20]。Fischer[21]在研究紫贻贝对Cd的富集与暴露温度的关系时发现:紫贻贝软组织中Cd浓度,25℃时最高,5℃时最低;Watkins[22]也认为紫贻贝对溶解态Cd的富集与暴露温度呈依赖性关系;Denton[23]的研究证实,在相同盐度下,黑唇牡蛎(Pinctatamargaritifera)在高温(36℃)时对重金属Hg、Cd的吸收速率明显比低温时快。本实验的结果与上述结果基本一致,表明水温高,生物体新陈代谢旺盛,生物体对水体中重金属吸收和富集增多。
3.5 盐度对贝类富集重金属的影响
有关盐度对水生动物累积、吸收溶解态重金属的影响己经进行了大量的研究,本研究表明泥蚶对重金属Cd、Cu的富集随水体盐度的升高而下降。此结果与之前的一些学者的研究结果具有同样的规律。例如,Wang等[24]的研究表明,当盐度由34降至15时,紫贻贝对Cd和Zn的吸收率增加了1.5—1.6倍。Lee等[25]也报道过当盐度由30降至10时,2种蛤仔: 黑龙江河蓝蛤(Potamocorbulaamurensis)和饰带白樱蛤(Macomabalthica)对Cd和Cr的吸收率平均增加了1.5—2.2倍。但到目前为止,盐度对双壳类富集重金属影响的机理尚不清楚。Bass推测随着盐度的降低,双壳类的呼吸代谢加快,耗氧量增加,于是需要提高空气流通速率,进而导致了贝类对金属的富集加强[11]。此外,盐度的变化也有可能影响金属在水体中的形态和金属间的相互作用,从而影响到生物对金属的可利用性[22]。
[1] Cai L Z, Liu Q Y, Hong H S.Metal-accumulation ofRuditapesphilippinarumin high zinc and lead experimental waters.Journal of Oceanography in Taiwan Strait, 1998, 17(4): 456- 461.
[2] Ma Z Y, Liu H, Yao B, Ji H M, Wang S B, Zhang T.Studies on the bioaccumulation of Cd, Cu, Zn in some macrobenthos.Chinese Research Academy of Environmental Sciences, 1997, 17(2): 151- 155.
[3] Chen R, Shen J C, Cai D J.Accumulation, release and control of three kinds of arsenides in fish and shellfish.Chinese Research Academy of Environmental Sciences, 1985, 5(2): 19- 23.
[4] Roesijadi G.Metallothioneins in metal regulation and toxicity in aquatic animals.Aquatic Toxicology, 1992, 22: 81- 114.
[5] Engel D W, Brouwer M.Trace metal-binding proteins in marine molluscs and crustaceans.Marine Environmental Research, 1984, 13: 177- 194.
[6] Liu M X, Li G J, Gu H K.Trace metal concentration in fish, crestacea and mollusea of the Bohai Bay.Acta Scientiae Circumstantiae, 1983, 3(2): 149- 155.
[7] Shuai J S, WANG L.Discussion about the health impact of heavy metal and the countermeasure.Environment and Exploitation, 2001, 16(4): 62.
[8] Liu Z K, LAN Y F.The pollution of heavy metal and human health.Science Garden Plot, 1991, 2: 35- 35.
[9] Guo D F.Environment sources of Pb and Cd and their toxicity to man and animals.Evolvement of Environment Science, 1994, 2(3): 71- 76.
[10] Philips D J H.Quantitative aquatic biological indicators: their use to monitor trace metal and organochlorine pollution.London, Applied Science Publishers, l980.
[11] Bass L E.Influence of temperature and salinity on oxygen consumption of tissues in the American oyster (Crassostreavirginica).Comparative and Biochemical Physiology,1977, 58: 125- 130.
[12] Cui K D, Wu Y L, Zhao H R.The experimental study of the accumulation, distribution and discharge of the Cd、Cu、Zn、 Pb、Ni 、Cr inScapharcasubcrenata.Studia Marina Sinica, 1987, 28: 97- 107.
[13] Sun P Y, Wang B.Effects of Seasonal Variation and Individual Size on Heavy Metals Accumulation inCorbiculaflumine.Marine Science Bulletin, 2004, 23(2): 19- 24.
[14] Wu Y L, Cui K D, Liu Y M, Hou L Y, Lou Q X.Laboratory experiment on the accumulation and depuration of mercury byArca(Anadara)SubcrenataLischke.Oceanolo et Limnologia Sinica, 1983, 14(1): 30- 34.
[15] De Wolf P.Mercury content of mussels from West European coasts.Marine Pollution Bulletin, 1975(6): 61- 63.
[16] Boyden C R.Trace element content and body size in molluscs.Nature, 1974(251): 311- 314.
[17] He B Y, Dai P J, Fan H Q.A Study on the Contents of the Heavy Metals in the Sediments and Macrobenthos of Yingluo Mangrove Swamps,Guangxi.Marine Environmental Science, 1983, 14(1): 30- 34.
[18] Cai L Z, Hong H S, Hong L.Accumulation of zinc and lead inRuditapesphilippinarumand its tolerance.Acta Scientiae Circumstantiae, 1999, 19(3): 319- 322.
[19] Zhao W H, Chen X G, Fei Z H, Qian B J.Preliminary study on ability of accumulation of heavy meatl in Different Mollusca and their different tissues and organs from Yancheng Seashore Botomland.Journal of Shanghai Jiao tong University(Agricultural Science), 2009, 27(1): 76- 78.
[20] Li J R, Li X P, Wang L, Duan Q Y.Advances in Uptake,Transportation and Bioaccumulation of Heavy Metal Ions in Bivalves.Fisheries Science, 2007, 26(1): 51- 55.
[21] Fischer H.Influence of temperature,salinity,and oxygen on the cadmium balance of musselsMytilusedulis.Mar Ecol Prog Ser, 1986(32): 265- 278.
[22] Watkins B, Simkiss K.The effect of oscillating temperatures on the metalion metabolism ofMytilusedulis.Journal of the marine biological association of the United Kingdom, 1988(68): 93- 100.
[23] Denton G R W, Burdon-Jones C.Influence of temperature and salinity on the uptake, distribution and depuration of mercury, cadmium and lead by the black-lip oysterSaccostreaechinata.Marine Biology, 1981, 64: 317- 326.
[24] Wang W X, Fisher N S, Luoma, S N.Kinetic determinations of trace element bioaccumulation in the musselMytilusedulis.Marine Ecology Progress Series, 1996, 140: 91- 113.
[25] Lee B G, Wallace W G, Luoma S N.Uptake and loss kinetics of Cd, Cr and Zn in the bivalvesPotamocorbulaamurensisandMacomabalthica: effects of size and salinity.Marine Ecology Progress Series, 1998, 175: 177- 189.
参考文献:
[1] 蔡立哲, 刘琼玉, 洪华生.菲律宾蛤仔在高浓度锌铅水体中的金属积累.台湾海峡, 1998, 17(4): 456- 461.
[2] 马藏允, 刘海, 姚波, 纪会敏, 王淑波, 张通.几种大型底栖生物对Cd,,Zn,Cu的积累实验研究.中国环境科学, 1997, 17(2): 151- 155.
[3] 陈锐, 沈介楚, 蔡道基.三种砷化物在鱼、贝内的积累、释放与控制.中国环境科学, 1985, 5(2): 19- 23.
[6] 刘明星, 李国基, 顾宏堪.渤海湾鱼类、甲壳动物、软体动物的痕量金属含量.环境科学学报, 1983, 3(2) : 149- 155.
[12] 崔可铎, 吴玉霖, 赵鸿儒.镉、铜、铅、镍、铬在毛蚶体内的累积、分布和排出的实验研究.海洋科学集刊, 1987, 28: 97- 107.
[13] 孙平跃, 王斌.季节变化和个体大小对河蚬积累重金属的影响.海洋通报, 2004, 23(2): 19- 24.
[14] 吴玉霖, 崔可铎, 刘玉梅, 侯兰英, 娄清香.毛蚶对汞积累和排出的室内试验.海洋与湖沼, 1983, 14(1): 30- 34.
[17] 何斌源, 戴培建, 范航清.广西英罗港红树林沼泽沉积物和大型底栖动物中重金属含量的研究.海洋环境科学, 1996, 15(1): 35- 41.
[18] 蔡立哲, 洪华生, 洪丽.菲律宾蛤仔对锌和铅的累积特征.环境科学学报, 1999, 19(3): 319- 322.
[19] 赵卫红, 陈献稿, 费正皓, 钱炳俊.盐城滩涂贝类及其不同组织器官对重金属富集能力的初步研究.上海交通大学学报(农业科学版), 2009, 27(1): 76- 78.
[20] 励建荣, 李学鹏, 王丽, 段青源.贝类对重金属的吸收转运与累积规律研究进展.水产科学, 2007, 26(1): 51- 55.
Effectsofageandenvironmentalconditionsonaccumulationofheavy-metalsCdandCuinTegillarcagranosa
WANG Zhaogen1,2,WU Hongxi2,3,*,CHEN Xiaoxiao2,4,GAO Yetian1,2
1ShanghaiOceanUniversity,Shanghai201306,China2ZhejiangMaricultureResearchInstitute,Wenzhou325005,China3ZhejiangKeyLabofExploitationandPreservationofCoastalBio-Resource,Wenzhou325005,China4EastChinaUniversityofScienceandTechnology,Shanghai200237,China
The effects of various animal ages, somatic tissues, exposure times, seawater temperatures, and salinities on the accumulation of heavy metals, cadmium and copper, inTegillarcagranosawere investigated in the present study. When exposed to 0.5 mg/L cadmium and 1mg/L copper respectively, the accumulations of cadmium and copper inT.granosawere significantly influenced by the age of tested animal and environmental conditions. (1) The accumulations of cadmium and copper in somatic tissues were shown to be negatively related to the age ofT.granosa. The elderT.granosa(three-years old) accumulated significant less heavy metal than the younger ones (one-year old). (2) During a seven days′ heavy metal exposure, the cadmium and copper accumulated in somatic tissues ofT.granosaincreased with the exposure time increased, and reached 118.293μg/g and 315.328μg/g for cadmium and copper, respectively. (3) The accumulations of cadmium and copper inT.granosawere positively correlated to the water temperature. The concentrations of heavy metals in somatic tissues ofT.granosareached 125.859μg/g and 576.504μg/g for cadmium and copper respectively in the highest temperature (30 ℃) experimental trials, which were significant greater than 44.524μg/g cadmium and 33.805μg/g copper accumulated in the lowest temperature (15℃) trials. (4) The accumulations of cadmium and copper inT.granosawere negatively affected by increased salinity. In the 10 ‰ salinity experimental trials, 69.958μg/g cadmium and 32.226μg/g copper were accumulated inT.granosa, which were significantly greater than 10.191μg/g cadmium and 12.564μg/g copper accumulated in the 30 ‰ salinity trials. (5) After 96 hours′ heavy metal exposure, there were significant heavy metal content differences in various tissues. Cadmium and copper are mainly accumulated in the mantle ofT.granosaand the concentrations reached 131.433μg/g and 289.432μg/g for cadmium and copper, respectively. Least cadmium (34.812μg/g) and copper (47.759μg/g) were accumulated in the adductor muscles. In general, the heavy metal accumulated in various tissues following decreasing order as mantle gt; viscera gt; gill gt; foot gt; adductor muscle for cadmium and mantle gt; gill gt; viscera gt; foot gt; adductor muscle for copper, respectively.
age;environmental conditions;Tegillarcagranosa;Cd;Cu;accumulation
浙江省近岸水域生物资源开发与保护重点实验室人才培养基金资助项目(2010F30003)
2012- 07- 02;
2012- 11- 19
*通讯作者Corresponding author.E-mail: whxchina@126.com
10.5846/stxb201207020922
王召根,吴洪喜,陈肖肖,高业田.年龄和环境条件对泥蚶富集重金属镉和铜的影响.生态学报,2013,33(21):6869- 6875.
Wang Z G,Wu H X,Chen X X,Gao Y T.Effects of age and environmental conditions on accumulation of heavy-metals Cd and Cu inTegillarcagranosa.Acta Ecologica Sinica,2013,33(21):6869- 6875.
