短期夜间低温胁迫对秋茄幼苗碳氮代谢及其相关酶活性的影响
2013-12-09郑春芳刘伟成陈少波仇建标黄晓林
郑春芳,刘伟成,陈少波,仇建标,黄 丽,彭 欣,黄晓林,王 宁
(浙江省海洋水产养殖研究所,浙江省近岸水域生物资源开发与保护重点实验室,温州海洋研究院,温州 325005)
短期夜间低温胁迫对秋茄幼苗碳氮代谢及其相关酶活性的影响
郑春芳,刘伟成,陈少波*,仇建标,黄 丽,彭 欣,黄晓林,王 宁
(浙江省海洋水产养殖研究所,浙江省近岸水域生物资源开发与保护重点实验室,温州海洋研究院,温州 325005)
-2℃夜间低温处理秋茄幼苗12 h后,白天温度升高到5℃再低温处理4 h,研究了低温16 h处理对秋茄幼苗叶片光合特性、色素含量、抗氧化系统、细胞膜透性以及碳氮代谢相关酶活性的影响。结果表明:(1)低温16 h内,秋茄的净光合速率、气孔导度、气孔限制值均显著降低,而胞间CO2浓度显著增加。(2)低温低于8 h,叶片叶绿素含量、类胡萝卜素含量以及Chl a/Chl b比值均未产生显著变化,而Car/Chl 比值显著增加。低温12、16 h,其叶片光合色素均下降,尤其白天下降幅度更大。(3)低温16 h内叶片可溶性总糖一直增加,而蔗糖含量、蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)活性均在低温12 h后下降。(4)低温16 h内叶片可溶性蛋白、游离氨基酸含量以及羧肽酶活性均增加,而低温8 h时叶片内肽酶活性就开始下降。(5)低温16 h内叶片相对电导率、MDA均增加,而叶片POD活性均下降,尤其夜间下降更明显。另外,低温4、16 h能显著降低叶片SOD活性。以上说明,低温16 h时秋茄叶片光合作用的下降主要是因为非气孔导度限制引起,这主要与光合色素下降、抗氧化酶活性降低有关。此外,短期夜间低温通过影响SS、SPS、内肽酶以及羧肽酶活性,从而抑制了秋茄自身的碳氮代谢调控能力。
秋茄;短期夜间低温;光合作用;蔗糖代谢相关酶;蛋白水解酶
光合作用是植物最基本的生命活动,也是植物合成有机质和获取能量的根本来源,而夜间低温降低了植物CO2同化率[1],导致电子难以传递到其后的电子传递体上,使得整个光合电子传递过程受阻,光系统Ⅱ(PSⅡ)功能下降[2]。另外,夜间低温也直接影响了白天植物光合产物的水解[3],而植物白天所得到的光合产物大部分以蔗糖的形式供应和运输,其中蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)不但是蔗糖代谢的关键酶,也是光合产物向蔗糖分配的关键调控点,直接影响植物的生长发育和光合产物分配[4]。研究发现,夜间低温抑制了黄瓜第2天的光合作用,反而提高了蔗糖和SPS活性[5]。也有人认为夜间低温对玫瑰叶片中SS和SPS的活性影响因叶片发育程度不同而存在差异[6]。此外,齐红岩等也指出番茄蔗糖含量、SS和SPS活性对短期夜间低温效应因不同低温类型而变化不同[7]。因此,短期夜间低温对植物碳代谢的影响是极为复杂的。
植物碳代谢与氮代谢关系密切,碳氮代谢的强度和平衡关系直接影响植物生长发育,因而参与氮代谢过程相关酶活性变化又是影响植物器官建成的关键。其中,内肽酶和羧肽酶是植物体内主要的蛋白水解酶,其活性高低影响了营养器官储存氮素的再利用程度[8]。目前,有关低温对植物氮代谢的研究甚少,且主要集中在氮素的同化方面[9- 10],而低温对植物内肽酶和羧肽酶活性影响的研究却未见报道。
秋茄(Kandeliacandel)是最耐寒的红树植物,也是我国分布最广的红树林种类,但全球气候变化引起的极端低温仍影响着秋茄的成活和生长,这成为我国红树林人工高纬度引种能否成功的主要因子之一。因此,如何提高秋茄抗寒性,维持低温条件下红树林的存活就成为红树林造林的关键。近年来,有关低温对红树林生理特征的影响研究有了一些相关报道。杨盛昌和林鹏[11]从抗寒力与水分、叶绿素、可溶性蛋白质含量及抗氧化酶活性的相关性探讨了秋茄的抗低温适应机制。陈鹭真等[12]系统调查了2008年极端气候对华南沿海各省的红树林区造成不同程度伤害。最近,雍石泉等又发现2010年冬季持续寒冷天气条件下闽江河口湿地引种秋茄可溶性总糖含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性均高于无瓣海桑和拉关木。然而,关于短期夜间低温影响红树林碳氮代谢的研究却甚少。因此,本研究以1年生秋茄幼苗为材料,较为系统地研究了短期夜间低温对植株光合功能、碳氮代谢相关酶活性影响,以期阐明秋茄幼苗碳氮代谢对夜间短期低温的响应机制,为抗寒红树植物品种的选育提供理论依据。
1 材料与方法
1.1 材料及其处理
2011年4月,插种秋茄胚轴于装有滩涂泥的塑料营养杯内,摆放在有潮水浸泡的温州龙湾区滩涂上,并做好保护措施。秋茄生长于青紫塥粘土,母质为近代浅海与江涂沉积物,质地轻粘,土壤pH值7.1,有机质2.8 g/kg,碱解氮111.2 mg/kg,速效磷(P2O5)35.1 mg/kg,速效钾(K2O)670.0 mg/kg,氯化钠1.18 g/kg。在2012年1月10日,选取大小基本一致的1年生秋茄幼苗移植到高为30cm,直径为20cm的聚乙烯塑料桶内,并装入滩涂淤泥自然风干土3.0kg。在自然环境下培养20 d,浇灌Hoagland′s营养液(NaCl浓度为10‰)。每桶幼苗3株。在智能光照培养箱内预培养14 d,设定温度20℃(夜)/25℃(昼),光照每天12 h,光照强度300μmol·m-2·s-1,相对湿度70%,定期浇灌,保持水层1—2 cm。
夜间处理:夜温设为20℃(对照)和-2℃,处理时间为19:00―23:00、23:00―翌日3:00、3:00―7:00,无光照,对照相对湿度不变,而低温相对湿度为60%―70%。白天对照温度由20℃升温到25℃,低温-2℃升温到5℃,处理时间为7:00―11:00,对照和低温处理的相对湿度和光照条件均分别为70%和300 μmol·m-2·s-1。选择顶端完全展开的倒二对叶片用于光合、生理测定,每次每个处理取3盆,作为3个重复。其中,光合参数仅在低温16 h时测定,而其他指标均在低温4、8、12以及16h测定。
1.2 测定项目与方法
1.2.1 光合参数的测定
在自然光照条件下(外界温度为13℃左右)恢复30 min,测定光合参数。用Li- 6400型便携式光合仪于10:30—11:30测定顶端完全展开的倒二对叶片的净光合速率(Pn)、细胞间隙CO2浓度(Ci)、气孔导度(Gs)、气体交换参数,并根据Ls=1-Ci/Ca计算叶片气孔限制值(Ls),式中Ca为环境CO2浓度。测定时设定光合有效辐射(PAR)为600 μmol·m-2·s-1(接近外界自然环境光强),CO2浓度均为(410±3)μmol/mol,叶片温度为15℃,光量子通量密度(PFD)为500 μmol·m-2·s-1。
1.2.2 光合色素的测定
称取0. 1 g叶片,分别剪成数段放入25 mL无水乙醇和丙酮(1∶1)提取液中,在25 ℃黑暗条件下提取24 h,测定提取液在665、649和470 nm处的吸光值,参照李合生[14]方法计算叶绿素a、叶绿素b、总叶绿素以及类胡萝卜素含量。
1.2.3 超氧化物歧化酶(SOD)、过氧化物酶(POD)活性和丙二醛(MDA)含量的测定
按Tan等[15]方法测定,分别取0.5 g叶片,加5 mL 50 mmol/L pH7.0磷酸提取液冰浴研磨,4 ℃ (10000×g)离心30 min,上清液为待测提取液。用氯化硝基四氮唑蓝(NBT)法,560 nm 比色测定SOD活性;愈创木酚法测定POD活性;按Du和Bramlage[16]方法测定MDA含量。
1.2.4 可溶性总糖、蔗糖、游离氨基酸以及可溶性蛋白含量的测定
采用蒽酮法[17]测定幼苗各器官的可溶性总糖含量,间苯二酚法测定蔗糖含量[18],采用茚三酮比色法[13]测定游离氨基酸含量,采用考马斯亮蓝G- 250染色法[19]。
1.2.5 蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)测定
参考汤章城[20]方法测定。取0.5 g叶片放入预冷的研钵中,研钵置于冰盒上。加入3 mL提取缓冲液于研钵中快速研磨成均匀糊状后,用2 mL提取介质清洗研钵两次,倒入4层纱布过滤,滤液定容至5 mL,4 ℃(12000×g)离心10min,取上清液进行SS和SPS酶活性测定。酶的活性单位为蔗糖μmol·g-1鲜重·h-1。
1.2.6 内肽酶和羧肽酶活性的测定
酶液提取和测定采用王东等[21]的方法。0.3 g鲜样加Tris-HCl缓冲液5 mL(pH 7.5,内含4 mmol/L DTT,1 mmol/L EDTA,1% PVP)冰浴研磨,4℃下15000×g离心30 min,上清液用于茚三酮反应,在570 nm下测内肽酶和羧肽酶活性。酶活性以单位反应时间内生成的氨基酸量表示。
1.3 数据分析
采用SPSS和SigmaPlot10.0软件对试验数据进行方差分析和显著性测验。数据结果为平均值±标准差(mean ± SD)。
2 结果与分析
2.1 短期夜间低温胁迫对秋茄幼苗叶片光合参数、光合色素的影响
由表1可知,与对照相比,低温胁迫处理显著降低了净光合速率(Pn)、气孔导度(Gs)以及气孔限制值(Ls)(Plt;0.05),却显著提高了胞间CO2浓度(Ci)(Plt;0.05)。

表1 短期夜间低温对秋茄幼苗叶片光合参数的影响
同列不同小写字母表示不同处理之间达显著性差异(Plt;0.05)

图1 短期夜间低温胁迫对秋茄幼苗叶片光合色素的影响Fig.1 Effects of short-term dark chilling on leaves photosynthetic pigments in Kandelia obovata seedling不同小写字母表示不同处理之间达到显著性差异(Plt;0.05)
由图1可知,秋茄幼苗叶片叶绿素、类胡萝卜素含量均随生育时间延长而增加。与对照相比,夜间低温胁迫4 h时,叶绿素、类胡萝卜素含量均增加,但未达到显著水平;当低温胁迫8 h时,叶绿素含量开始下降,而类胡萝卜素含量还在增加;当低温胁迫12 h时,叶绿素、类胡萝卜素含量均开始下降,但仅后者存在显著差异(Plt;0.05);当低温胁迫16 h时,叶绿素、类胡萝卜素含量分别下降14.9%和26.8%,均达到显著水平(Plt;0.05)。
在夜间,秋茄幼苗叶片叶绿素a/叶绿素b比并未随时间延长而产生较大变化,且处理间无显著差异,而白天时低温处理下其比值显著降低(Plt;0.05)。与叶绿素a/叶绿素b比变化趋势一样,无胁迫条件下秋茄幼苗叶片类胡萝卜素/叶绿素比变化平缓,但在连续16 h低温处理下其比值存在不同的变化差异。与对照相比,低温胁迫4、8 h时其比值升高,且在8 h时达到显著水平(Plt;0.05),而低温胁迫12、6 h时其比值又迅速下降,分别降低了26.2%和19.8%,均达到显著水平(Plt;0.05)。表明,夜间低温对秋茄幼苗叶片类胡萝卜素影响较叶绿素更显著。
2.2 短期夜间低温胁迫对秋茄幼苗叶片可溶性总糖、蔗糖及其相关酶活性的影响
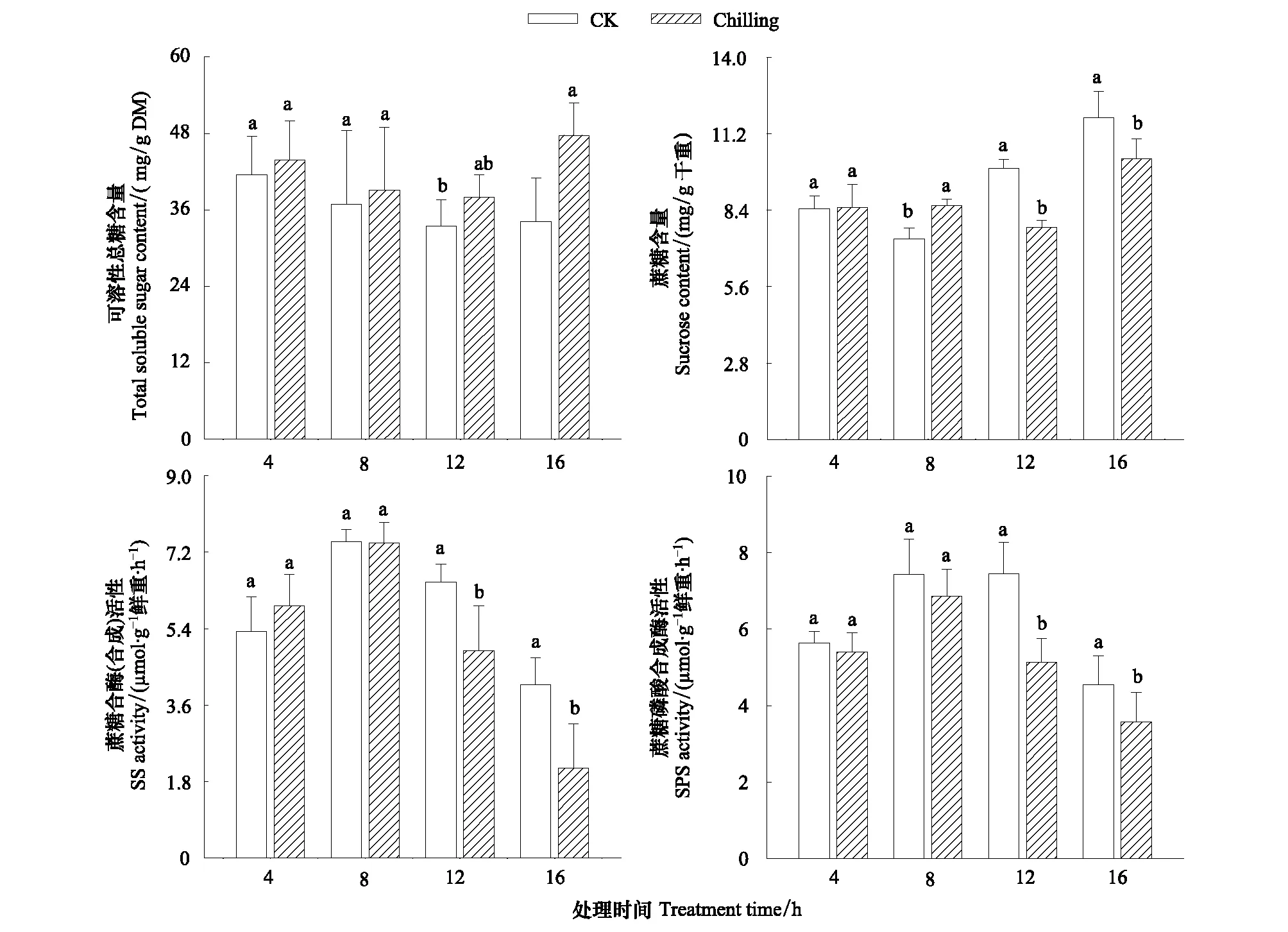
图2 短期夜间低温胁迫对秋茄幼苗叶片可溶性总糖、蔗糖、蔗糖合成酶以及蔗糖磷酸合成酶活性的影响Fig.2 Effects of short-term dark chilling on leaves contents of total soluble sugar and sucrose and activities of SS and SPS in Kandelia obovata seedling
秋茄幼苗叶片可溶性总糖、蔗糖含量均随生长时间延长呈先降后升的趋势(图2)。与对照相比,低温处理提高了秋茄幼苗叶片可溶性总糖,且在低温12、16 h时分别增加13.5%和39.5%,均达到显著差异(Plt;0.05)。与对照相比,蔗糖含量仅在低温8 h时显著增加(Plt;0.05),而随着低温时间延长其含量又迅速下降,且在低温12、16 h时分别比对照减少27.8%和14.6%,均达到显著水平(Plt;0.05)。秋茄幼苗叶片蔗糖合成酶和蔗糖磷酸合成酶活性随生长时间延长呈先增后降的趋势(图2),低温处理并未改变两种酶活性的变化趋势,但与对照之间仍存在不同差异。与对照相比,低温4 h时蔗糖合成酶迅速升高,而8 h时其酶活性又恢复正常。然而,当低温时间持续到12、16 h时,其酶活性又迅速下降,并分别降低为对照的75.2%和51.9%,均达到显著差异(Plt;0.05)。与对照相比,低温条件下秋茄幼苗叶片蔗糖磷酸合成酶活性一直下降,当低温12、16 h时其酶活性下降为对照的68.8%和78.5%,均达到显著差异(Plt;0.05)。
2.3 短期夜间低温胁迫对秋茄幼苗叶片可溶性蛋白、游离氨基酸及其相关酶活性的影响
正常情况下夜间秋茄幼苗叶片可溶性蛋白质含量变化较平缓,而白天其含量迅速升高(图3)。其中低温4、8、12和16 h时其可溶性蛋白质含量均升高,分别为对照的1.4、1.2、1.4和1.2倍,均达到显著水平(Plt;0.05)。与可溶性蛋白质含量变化不同,秋茄幼苗叶片游离氨基酸含量随生长时间延长呈先降后升的趋势(图3)。当低温4 h 和16h时,其含量分别为对照的1.2和1.1倍,均达到显著水平(Plt;0.05),而低温8 h 和12h时其含量与对照间并未有显著差异。

图3 短期夜间低温胁迫对秋茄幼苗叶片可溶性蛋白质、游离氨基酸、内肽酶以及羧肽酶活性的影响Fig.3 Effects of short-term dark chilling on leaves contents of soluble protein and free amino acid and activities of endoptidase and carboxypeptidase in Kandelia obovata seedling
无胁迫条件下秋茄幼苗叶片内肽酶活性与可溶性蛋白质含量变化一致(图3)。低温处理条件下内肽酶活性出现了较大变化。当低温4 h时,其酶活性迅速升高,为对照的1.6倍,达到显著水平(Plt;0.05),而低温8、12和16 h时其酶活性又均下降,分别为对照的77.9%、80.6%和77.8%,均达到显著差异(Plt;0.05)。无胁迫条件下秋茄幼苗叶片羧肽酶活性呈先增后降的趋势,且夜间其酶活性高于白天(图3)。低温处理能提高秋茄幼苗叶片羧肽酶活性,仅当低温4 h和16h时,才与对照有显著差异(Plt;0.05)。
2.4 短期夜间低温胁迫对秋茄幼苗叶片相对电导率和抗氧化系统的影响
无胁迫条件下秋茄幼苗叶片相对电导率随时间延长呈增加趋势(图4)。与对照相比,低温4、8、12和16 h时其相对电导率分别增加16.9%、10.1%、16.8%和9.8%,均达到显著水平(Plt;0.05)。夜间秋茄幼苗叶片MDA含量与相对电导率变化趋势一致,但白天时其含量迅速下降(图4)。夜间低温处理提高了MDA含量,但与对照间无显著差异,而白天时MDA含量显著增加(Plt;0.05)。
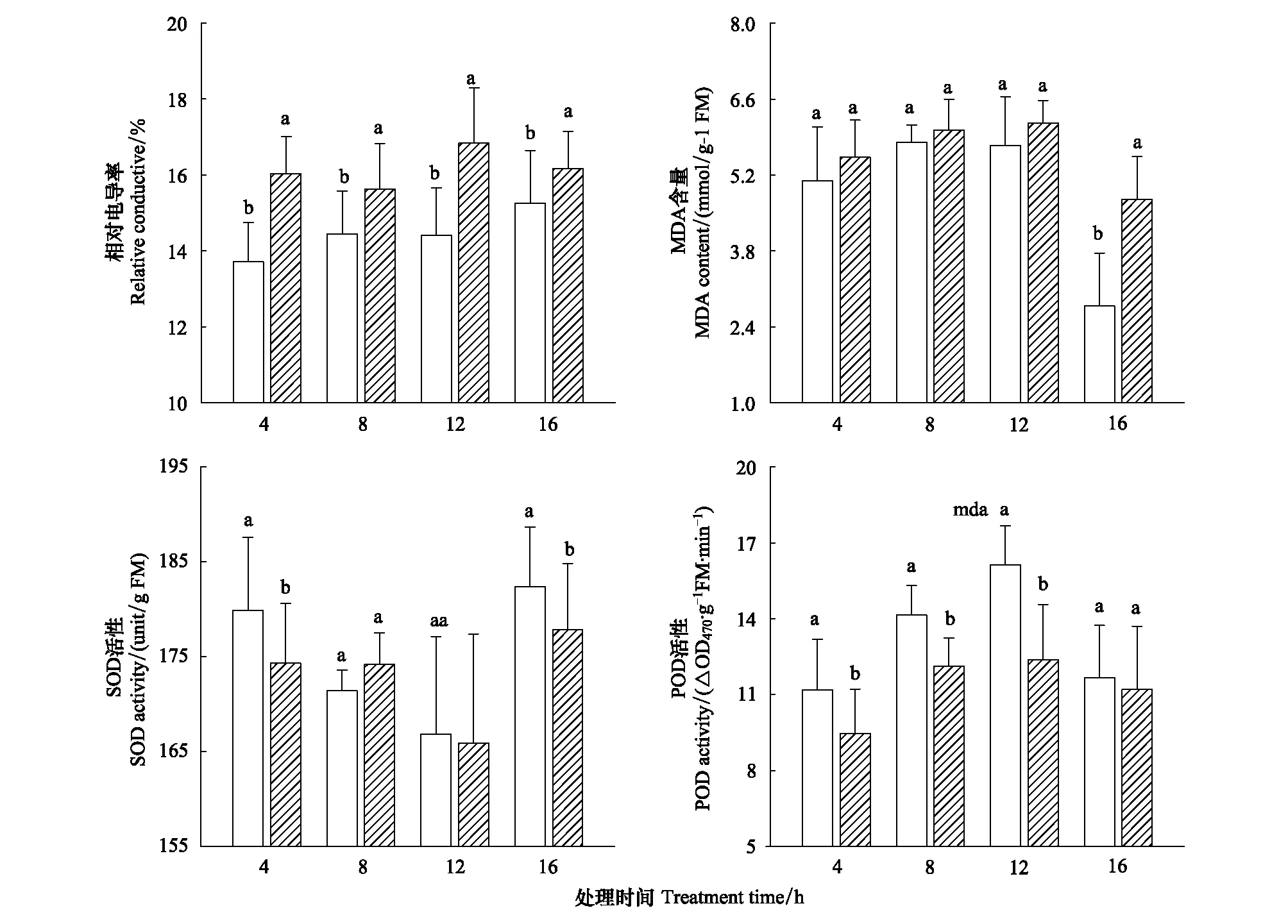
图4 短期夜间低温胁迫对秋茄幼苗叶片相对电导率、丙二醛含量、SOD和POD酶活性的影响Fig.4 Effects of short-term dark chilling on leaves relative conductive, MDA content and activities of SOD and POD in Kandelia obovata seedling
秋茄幼苗叶片SOD活性随生长时间延长呈先降后升,而POD活性却表现相反(图4)。与对照相比,低温4 h时其SOD活性显著下降,而低温8 h时其活性又迅速提高,但与对照间无显著差异。与对照相比,低温12 h时SOD活性开始下降,并在低温16 h时其活性下降为对照的91.1%,达到显著水平(Plt;0.05)。低温处理降低了秋茄幼苗叶片POD活性,与对照相比,夜间低温4、8和12 h时其POD活性分别下降了18.0、16.7 和30.3%,均达到显著水平(Plt;0.05),而低温16 h时其POD活性与对照间无显著差异。
3 结论与讨论
3.1 短期夜间低温条件下秋茄幼苗叶片光合特征
Kao等[22]研究不仅发现低温1 h降低了秋茄净光合速率和气孔导度,而且还指出光饱和速率下降的原因是因为低温诱导气孔关闭所致。杨盛昌等[23]也指出5℃夜间低温13 h条件下秋茄净光合速率的降低与气孔导率减少密切相关。在逆境胁迫下,引起植物叶片光合速率降低的原因主要分为气孔限制和非气孔限制两类。根据Farquhar和Sharkey[24]的观点,认为Ci和Ls这两个指标就可以来判断光合作用的限制因素:当Ci和Pn均减少,且Ls增大时,气孔因素为限制因子;否则,当Pn下降,Ci升高,且Ls减少,植物光合能力的降低则为非气孔限制。本研究中,低温16 h时秋茄幼苗叶片Pn和Gs均显著降低,Ci显著升高,Ls则显著减少,这表明短期低温处理下,秋茄幼苗叶片光合速率下降主要受非气孔因素限制。非气孔限制因素可能是由于CO2固定能力、光合色素含量、光合作用关键酶等因素的改变,致使叶肉细胞光合活性下降,引起Rubisco含量减少[25]。

Chla/Chlb比值的变化可以反映红树林抗寒力的越冬变化[11]。这主要因为:逆境条件下Chla/Chlb比值的降低能反映出类囊体膜的垛叠程度降低,而膜垛叠的减少降低了植物对光量子的有效吸收、传递和利用,导致光能转化为生物化学能的效率降低[28]。另外,Car/Chl比值是与植物清除活性氧的能力和忍受逆境的能力有关[29]。本研究发现,低温降低了Chl和Car含量,且在白天的时候尤其显著,表明白天低温严重抑制了秋茄幼苗叶片叶黄素循环,提高了叶绿素酶活性,促进叶绿素水解,这不同于陈鹭真等[30]研究,可能是与处理的材料、方式有关。此外,低温降低了秋茄幼苗叶片Chl a/Chl b比,而提高了低温4、8 h时叶片的Car/Chl比值,表明夜间低温减少秋茄幼苗叶片Chl的相对速度远远高于Car,这可能是极性分子受到明显影响,产生了色素交互作用[31]。当低温处理16 h时,秋茄幼苗叶片Chl a/Chl b、Car/Chl比均降低,表明秋茄白天受到低温胁迫影响后,其基粒类囊体垛叠数目迅速减少,叶绿素含量也快速降低。另一方面,白天温度上升到5 ℃后,尽管叶片Car/Chl比值减少,但并意味着低温体内的活性氧减少了,而是因为白天低温条件下叶绿素合成速度高于类胡萝卜素,并结合清除ROS的酶活性变化,发现夜间-2 ℃胁迫加剧了白天叶绿素的光氧化破坏。
3.2 短期夜间低温条件下秋茄幼苗叶片糖代谢特征
通常在植物叶片光合速率高、呼吸速率低、光合运转能力弱的条件下易出现总糖、淀粉、蔗糖、葡萄糖以及果糖的大量积累,而研究发现,陆地植物番茄在低温条件下不同糖类的累积与光合作用无关,但却与库源关系的改变以及其代谢相关的SS和SPS活性变化有关[32]。本研究发现,低温4、8 h时秋茄叶片可溶性总糖、蔗糖开始积累,同时,秋茄叶片SS活性也轻微上升,而SPS活性持续下降。表明,短期夜间低温条件下叶片SS起促进蔗糖合成的作用,且作用较大于SPS。当低温12、16 h时,秋茄叶片可溶性总糖仍显著上升,但蔗糖开始显著下降,同时叶片SS、SPS活性也均显著下降,这又说明一方面低温抑制叶片中糖类(果糖、葡萄糖)向蔗糖的合成,导致总糖含量的积累,另一方面又抑制蔗糖合成酶(SS、SPS)活性,导致蔗糖合成减少。
3.3 短期夜间低温条件下秋茄幼苗叶片氮代谢特征
抗寒锻炼过程中秋茄叶片内可溶性蛋白质含量增加,其原因可能有两方面:一方面是某些高分子蛋白质的降解,另一方面可能有抗寒新蛋白质的合成,但其原因仍未定论[11]。在本研究中,低温16 h内时秋茄叶片可溶性蛋白质、游离氨基酸含量均一直增加,其中前者增加幅度较大,并存在显著差异,而后者仅在低温4、16 h存在显著差异,这与叶片蛋白质水解酶(内肽酶和羧肽酶)有紧密关系。因为内肽酶在组织衰老期间能促进蛋白质降解,使叶片蛋白质降解为小肽,小肽则被外肽酶进一步水解为氨基酸[33]。本研究进一步发现,当短期夜间低温4 h时,内肽酶和羧肽酶活性均显著增加,结合可溶性蛋白质和游离氨基酸含量变化规律,说明短期低温促进秋茄叶片蛋白质快速降解。当低温8、12 h时,显著下降的内肽酶活性抑制了蛋白质分解为小肽,尽管羧肽酶活性增加了,但仍未能提高秋茄叶片游离氨基酸含量。当低温16 h时,内肽酶活性仍显著下降,由蛋白质降解为小肽的过程仍受到严重抑制,但羧肽酶活性却显著升高,仍能促进更多的小肽进一步水解为氨基酸,这也表明短期低温条件下秋茄羧肽酶在蛋白质水解过程中起着重要作用。
综上所述,低温16 h时光合作用的下降主要是因为非气孔导度限制引起,这与低温12 h后叶绿素、类胡萝卜素合成有关,同时,短期低温仍导致秋茄幼苗叶片细胞膜受损,产生膜脂过氧化伤害。另外,低温通过影响SS、SPS、内肽酶以及羧肽酶活性,秋茄的糖代谢和蛋白质水解过程均受到了抑制。
[1] Van Heerden P D R, Krüger G H J. Dark chilling inhibition of photosynthesis and symbiotic nitrogen fixation in soybean during pod filling. Journal of Plant Physiology, 2004, 161(5): 599- 609.
[2] Bertamini M, Muthuchelian K, Rubinigg M, Zorer R, Velasco R, Nedunchezhian N. Low-night temperature increased the photoinhibition of photosynthesis in grapevine (VitisviniferaL. cv. Riesling) leaves. Environmental and Experimental Botany, 2006, 57(1/2): 25- 31.
[3] Li G, Li T, Liu A. Recovery effect of tomato leaves photosynthesis and chloroplast ultrastructure after a short-term low nocturnal temperature. Chinese Journal of Applied Ecology, 2009, 20 (4): 798- 804.
[4] Hu R, Jiang H, Li Y. Research advance on sucrose synthesize enzymes. Northern Horticulture, 2012, (1): 167- 170.
[5] Miao M, Zhang Z, Xu X, Wang K, Cheng H, Cao B. Different mechanisms to obtain higher fruit growth rate in two cold-tolerant cucumber (CucumissativusL.) lines under low night temperature. Scientia Horticulturae, 2009, 119(4): 357- 361.
[6] Khayat E, Zieslin N. Effect of Night Temperature on the Activity of Sucrose Phosphate Synthase, Acid Invertase, and Sucrose Synthase in Source and Sink Tissues ofRosahybridacv Golden Times. Plant Physiol., 1987, 84(2): 447- 449.
[7] Qi H, Jiang Y, Hua L. Responses to short-term low night temperature of sucrose-metabolizing in domesticated tomato and wild relative. Acta Horticulture Sinica, 2012, 39(2): 281- 288.
[8] Wang P, Yin Y, Fu G, Guo Y, Cai R, Liang T, Geng Q, Wu Y, Wang Z. Effect of phosphorus on activities of enzymes of enzymes related to nitrogen metabolism in flag leaves and protein content of wheat grains. Plant Nutrition and Fertilizer Science, 2009, 15(1): 24- 31.
[9] Lu B, Yuan Y, Zhang C, Qu J, Zhou W, Lin Q. Modulation of key enzymes involved in ammonium assimilation and carbon metabolism by low temperature in rice (OryzasativaL.) roots. Plant Science, 2005, 169(2): 295- 302.
[10] Wang Y, Lü D, Qin S, Zhang Y, Ma H, Liu G, Meng Q. Effects of low-temperature on enzymes activities of nitrogen metabolism and free amino acids contents in root ofMalusbaccataBorkh. andMalushupehensisRehd. Seedlings. Acta Horticulture Sinica, 2010, 37(2): 179- 184.
[11] Yang S, Lin P. Cold-resistance ability of two mangrove speciesKandeliacandelandAegicerascorniculatumduring their overwintering period. Chinese Journal of Applied Ecology, 1997, 8 (6): 561- 565.
[12] Chen L Z,Wang W Q,Zhang Y H,Huang L, Zhao C L, Yang S C, Yang Z W, Chen Y C, Xu Hua L, Zhong C R, Su B, Fang B Z, Chen N M, Zeng C Z, Lin G H. Damage to mangroves from extreme cold in early 2008 in southern China. Chinese Journal of Plant Ecology, 2010, 34 (2): 186- 194.
[13] Yong S, Tong C, Zhuang C, Yang W, Li X, Zhang L, Huang J. Effects of cold weather on seedlings of three mangrove specicies planted in the Min River estuary during the 2010 winter. Acta Ecologica, 2011, 31(24): 7542- 7550.
[14] Li H S. Experimental Principle and Technique for Plant Physiology and Biochemistry. Beijing: Higher Education Press, 2000
[15] Tan W, Liu J, Dai T, Jing Q, Cao W, Jiang D. Alterations in photosynthesis and antioxidant enzyme activity in winter wheat subjected to post-anthesis waterlogging. Photosynthetica, 2008, 46 (1): 21- 27.
[16] Du Z, Bramlage W J. Modified thiobarbituric acid assay for measuring lipid oxidation in sugar-rich plant tissue extracts. Journal of Agricultural and Food Chemistry, 1992, 40 (9): 1566- 1570.
[17] Fales FW. The assimilation and degradation of carbohydrates by yeast cells. Journal of Biological Chemistry, 1951, 193 (1): 113- 124.
[18] Zhang Z, Qu W. Plant Physiology Experiment Guide. Beijing: Higher Education Press, 2003
[19] BradfordM M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the princip le of protein-dye binding. Annual Review of Biochemistry, 1976, 72: 248- 254.
[20] Tang Z. Modern Plant Physiology Experimental Guide. Beijing: Science and Technology, 1999
[21] Wang D, Yu Z, Wang X. Effects of sulfur on p rotein accumulation in kernels of winter wheat. Acta Agronomica Sinica, 2003, 29 (6): 878- 883.
[22] Kao Y, Shih C, Tsai T. Sensitivity to chilling temperatures and distribution differ in the mangrove speciesKandeliacandelandAvicenniamarina. Tree Physiology, 2004, 24(7): 859- 864.
[23] Yang S, Lin P, Li Z, Wang Q. Effect of low night temperature on Photosynthetic properties of mangrove seedling. Journal of Xiamen University (Natural Science), 1999, 38 (4): 617- 622.
[24] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology,1982,33: 317- 345.
[25] Zhan W, Sha W, Wang M, Shi S, Wen Q. Effects of the variations in precipitation and temperature on photosynthetic parameters and growth ofFraxinusmandshuricaseedlings in Changbai Mountains of Northeast China. Chinese Journal of Applied Ecology, 2012, 23(3):617- 624.
[26] Bertamini M, Muthuchelian K, Rubinigg M, Zorer R, Nedunchezhian N. Low-night temperature (LNT) induced changes of photosynthesis in grapevine (VitisviniferaL.) plants. Plant Physiology and Biochemistry, 2005, 43(7): 693- 699.
[27] Huang M, Guo Z. Responses of antioxidative system to chilling stress in two rice cultivars differing in sensitivity. Biologia Plantarum, 2005, 49 (1): 81- 84.
[28] Maslenkova LT, Zanev Y, Adaptation to salinity as monitored by PSⅡ oxygen evolving reactions in barley thylakoids. Journal of Plant Physiology, 1993, 142(5): 629- 634.
[29] Sairam R K, Rao KV, Srivastava GC. Differential response of wheat genotypes to long term salinity stress in relation to oxdative stress, antioxidant activity and osmolyte concentration. Plant Science, 2002, 163(5): 1037- 1046.
[30] Chen L, Du X, Lu L, Zheng S, Yang S. Synergistic effects of low temperature in winter and ebb tide at night on Sonneratia apetala seedlings growth and key eco-physiological traits.2012, 23(4): 953- 958.
[31] Demmig-Adams B, Winter K, Kruger A, Czygen F C. Zeaxanthin synthesis, energy dissipation and photoprotection of photosystem Ⅱ at chilling temperatures, Plant Physiology, 1989, 90(3): 894- 898.
[32] Liu Y, Li T, Jiao X. Effects of Short-term Sub-low Night temperature treatment and recovery on the photosynthesis and sucrose-metabolizing of tomato leaves. Acta Horticulture Sinica, 2011, 38(4): 683- 691.
[33] Dalling M J, Boland G, Wilson J H. Relation between acid p roteinase activity and redistribution of nitrogen during grain development in wheat. Australian Journal of Plant Physiology, 1976, 3(6): 721- 730.
参考文献:
[3] 李国强,李天来,刘爱群. 短期夜间低温后番茄光合作用及叶绿体超微结构的恢复效应. 应用生态学报,2009,20(4):798- 804.
[4] 胡瑞芳,姜慧,李玥莹. 蔗糖代谢相关酶的研究进展. 北方园艺,2012,(1):167- 170.
[7] 齐红岩,姜岩岩,华利静. 短期夜间低温对栽培番茄和野生番茄果实蔗糖代谢的影响. 园艺学报,2012,39(2):281- 288.
[8] 王平,尹燕杆, 付国占,郭莹,蔡瑞国,梁太波,耿庆辉,邬云海,王振林. 施磷对小麦旗叶氮代谢关键酶活性和子粒蛋白质含量的影响. 植物营养与肥料学报,2009,15(1):24- 31.
[10] 王英,吕德国,秦嗣军,张玉龙,马怀宇,刘国成,孟倩.低温对山定子和平邑甜茶幼苗. 低温对山定子和平邑甜茶幼苗根系氮代谢酶及游离氨基酸的影响. 园艺学报,2010,37(2):179- 184
[11] 杨盛昌,林鹏. 红树植物秋茄和桐花树抗寒力的越冬变化. 应用生态学报,1997,8(6):561- 565.
[12] 陈鹭真,王文卿,张宜辉,黄丽,赵春垒,杨盛昌,杨志伟,陈粤超,徐华林,钟才荣,苏博,方柏州,陈乃明,曾传志,林光辉. 2008年南方低温对我国红树植物的破坏作用. 植物生态学报,2010, 34 (2): 186- 194.
[13] 雍石泉,仝川,庄晨辉,杨渭平,李旭伟,张林海,黄佳芳.2010 年冬季寒冷天气对闽江口3 种红树植物幼苗的影响. 生态学报,2011,31 (24): 7542- 7550.
[14] 李合生. 植物生理生化实验原理和技术. 北京:高等教育出版社,2000
[18] 张志良,瞿伟菁.植物生理学实验指导.北京:高等教育出版社,2003
[20] 汤章城. 现代植物生理学实验指南. 北京:科学出版社,1999
[21] 王东,于振文,王旭东.硫素对冬小麦籽粒蛋白质积累的影响.作物学报,2003,29(6): 878- 883
[23] 杨盛昌,林鹏,李振基,王文卿. 夜间低温对红树幼苗光合特性的影响. 厦门大学学报(自然科学版),1999,38(4):617- 622.
[25] 战伟,沙伟,王淼,师帅,问青春. 降水和温度变化对长白山地区水曲柳幼苗生长和光合参数的影响. 应用生态学报,2012,23(3):617- 624.
[30] 陈鹭真,杜晓娜,陆銮眉,郑仕杰,杨盛昌. 模拟冬季低温和夜间退潮对无瓣海桑幼苗的协同作用. 应用生态学报,2012,23(4):953- 958.
[32] 刘玉凤,李天来,焦晓赤. 短期夜间亚低温及恢复对番茄光合作用和蔗糖代谢的影响. 园艺学报,2011,38(4):683- 691.
Effectsofshort-termdarkchillingonleavescarbonandnitrogenmetabolismandinvolvedactivitiesofenzymesinmangroveKandeliaobovataseedling
ZHENG Chunfang, LIU Weicheng, CHEN Shaobo*, QIU Jianbiao, HUANG Li, PENG Xin, HUANG Xiaolin, WANG Ning
ZhejiangKeyLaboratoryofExploitationandPreservationofCoastalBio-resource,WenzhouOceanResearchInstitute,ZhejiangMaricultureResearchInstitute,Wenzhou,Zhejiang325005,China
The frequency, duration and intensity of extreme cold events have been hypothesized to explain the current latitudinal limits of mangrove distribution. At present,Kandeliaobovatais the major mangrove species for forestation on the southeast coast of China, whose northern distribution boundary transplanted is in Yueqing county (28°25′N). Therefore, the incidence of extreme cold events is likely to be a factor limiting mangrove survival ratio.Kandeliaobovataseedling grown in a controlled-environment chamber equipped were exposed to two different night temperature regimes: (low temperature treatment)-2℃ and (control) 20℃ for 12 h. During the day, temperature were maintained in both treatments at a minimum of 5 ℃ and a maximum of 25 ℃ for 4 h. Our objective was to investigate the possible physiological mechanisms ofKandeliaobovatain responses to the short-term chilling 16 hours.Kandeliaobovataseedling were cultivated in the illuminating incubator to study the effects of short-term dark chilling on photosynthetic characteristic, photosynthetic pigment contents, antioxidation system, cell membrane permeability and involved activities of enzymes in carbon and nitrogen metabolism. The results obtained are as follows: (1) The leaf net photosynthetic rate (Pn), stomatal conductance (Gs) and stomatatal limitation (Ls) ofKandeliaobovatawere significantly decreased at low temperature 16 h, while leaf intercellular CO2concentration was increased. (2)The contents of chlorophyll, carotenoids, and Chl a/Chl b ratio in leaf had no significantly changes at low temperature less than 8 h, whereas leaf Car/Chl ratio was significantly improved. In addition, photosynthetic pigment contents were decreased at low temperature between 12 h and 16 h. (3) The leaf total soluble sugars was increased during low temperature 16 h, while sucrose content, sucrose synthase (SS) and sucrose phosphate synthase (SPS) activities were decreased after low temperature 12 h. (4) The contents of soluble protein and free amino acid and carboxypeptidase activity in leaf were increased during low temperature 16 h, while endopeptidase activity in leaf begun to drop at low temperature 8 h. (5) During low temperature 16 h, the relative conductivity and malondialdehyde (MDA) content in leaf were increased, while activity of POD was decreased, especially in dark. Also, low temperature both 4 h and 16 h treatments suppressed leaf superoxide dismutase (SOD) activity. These results demonstrate that non-stomatal restriction was cause for reducedKandeliaobovataphotosynthesis at low temperature 16 h, which was mainly associated with reduced photosynthetic pigment and depressed antioxidant enzyme activity. Moreover, short-term low night temperature restrained leaf carbon and nitrogen metabolic self-regulation inKandeliaobovataby affecting activities of SS, SPS, endopeptidase and carboxypeptidase.
Kandeliaobovata; short-term dark chilling; photosynthesis; sucrose-metabolizing enzymes; proteolytic enzymes
国家海洋公益性行业科研专项经费项目(201005012,200805072);浙江省自然科学基金资助项目(LQ13C030002);浙江省近岸水域生物资源开发与保护重点实验室开放资助项目(2010F30003);浙江省科技厅创新团队建设与人才培养资助项目(2011F20032);浙江省海洋与渔业资助项目(高纬度红树林生态恢复关键技术应用示范);温州市科技计划资助项目(S20110007)
2012- 05- 16;
2012- 10- 26
*通讯作者Corresponding author.E-mail: chenshaobo@hotmail.com
10.5846/stxb201205160730
郑春芳,刘伟成,陈少波,仇建标,黄丽,彭欣,黄晓林,王宁.短期夜间低温胁迫对秋茄幼苗碳氮代谢及其相关酶活性的影响.生态学报,2013,33(21):6853- 6862.
Zheng C F, Liu W C, Chen S B, Qiu J B, Huang L, Peng X, Huang X L, Wang N.Effects of short-term dark chilling on leaves carbon and nitrogen metabolism and involved activities of enzymes in mangroveKandeliaobovataseedling.Acta Ecologica Sinica,2013,33(21):6853- 6862.
