坏死细胞释放IL-1对血管平滑肌细胞增殖及炎性反应的影响
2013-12-09孟亮葛华蒋红军赵东晖车行素
孟亮 葛华 蒋红军 赵东晖 车行素
血管重构(Vascular remodeling,VR)是血管为适应体内外环境变化而发生的形态结构和功能改变的动态反应过程,包括细胞增殖、迁移、凋亡和细胞基质的合成、降解及重排等一系列的动态变化,与高血压、动脉粥样硬化以及血管术后再狭窄等多种心血管疾病密切相关。缺血、缺氧和机械损伤等引起的血管平滑肌细胞损伤、凋亡和坏死是血管重构类疾病的常见病理改变[1]。在病理条件下,坏死的血管平滑肌细胞能够分泌多种炎性因子,并刺激周围正常细胞,引起细胞增殖。我们在前期研究中发现,坏死的血管平滑肌细胞上清液能够显著增强正常血管平滑肌细胞的增殖能力[2],但机制不明确。本实验拟采用坏死细胞培养上清液作为条件培养液,进一步探讨坏死细胞培养上清液的促炎和促进细胞增殖的机制,以期为心血管疾病的恢复及治疗提供理论依据。
1 材料与方法
1.1 细胞株与试剂
人主动脉平滑肌细胞(上海生命科学研究院生物化学与细胞生物学研究所);IL-1、IL-1RA(Prospec 公司),MTT、DMSO(Sigma 公司),总 RNA提取试剂盒、TIAN Script cDNA第一链合成试剂盒(北京天根生化科技有限公司),细胞核细胞浆蛋白抽提试剂盒(碧云天公司),NF-kB抗体、IkB抗体(Santa Cruz公司),引物委托生工生物(上海)有限公司合成,其他试剂均为国产分析纯。
1.2 细胞培养
将人主动脉平滑肌细胞接种于含10%胎牛血清、100 U/mL 青霉素、100 μg/mL 链霉素的低糖DMEM培养液中,在37℃、5%CO2、饱和湿度条件下培养,细胞贴壁生长。2~3 d更换一次培养基,待细胞生长至80%~90%融合时进行传代。
1.3 坏死细胞培养上清液的制备及实验分组
按照文献[2]的方法,将无血清无糖培养基通入5%CO2、10%H2、85%N2混合气体饱和 15min, 即制成无血清无糖低氧溶液。将对数生长期的血管平滑肌细胞接种于此条件溶液后,置于含上述混合气体的厌氧培养箱中培养,48 h后离心收集细胞培养上清液,即为坏死血管平滑肌细胞上清液。实验设置坏死上清干预组(NCS)、IL-1干预组(IL-1)、坏死上清与IL-1RA联合干预组(NCS+IL-1RA)以及无血清低糖DMEM培养的对照组(Control)。
1.4 细胞增殖检测
取对数生长期的血管平滑肌细胞以5000个/孔的浓度接种至96孔细胞培养板,置于37℃,5%CO2培养箱内培养。待细胞贴壁后无血清同步化于G0期。换液为各组条件培养液,培养48 h。每孔加入20μL浓度为5 mg/mL的MTT,细胞培养箱中孵育4h,吸去上清,加入200μL DMSO溶解细胞形成的结晶。酶标仪上测定各组细胞在490 nm处的OD值,分析细胞增殖情况。
1.5 RT-PCR
培养48 h后收集各组细胞。TRIzol法提取总RNA,按照cDNA第一链合成试剂盒说明书中的方法进行反转录。以管家基因β-actin为内参,进行PCR反应,MCP-1的上、下游引物为:5'-CAATCAATGCCCCAGTCACCT-3',5'-AATCCTGAACCCACTTCTGCTT-3';扩增片段长度为177 bp。IL-6的上、下游引物序列分别为:5'-AATAACCACCCCT GACCCAAC-3',5'-CCAGAAGAAGGAATGCCCATT-3';扩增片段长度为198 bp。IL-8的上、下游引物序列为:5'-AGGAATTGAATGGGTTTGC-3',5'-CTGTGAGGTAAGATGGTGGCTAA-3';扩增片段长度为229 bp。β-actin的上、下游引物序列为:5'-ACGTTGACATC CGTAAAGAC-3',5'-GAAGGTGGACAGTGAGGC-3’;扩增片段长度为200 bp。采用2×Taq PCR Master Mix试剂盒进行PCR反应,反应体系为:cDNA 模板 2μL,上、下游引物各1μL,2×Taq PCR Master-mix 10μL,ddH2O 补足总体积至20μL。 反应条件为:95 ℃预变性 5min,95 ℃变性20 sec;57℃退火 20 sec;72℃延伸 30 sec,共 30个循环,最后72℃延伸5min,反应结束后于1.5%琼脂糖凝胶上进行电泳,利用凝胶成像系统将图片扫描入电脑并进行灰度分析。
1.6 IL-6、MCP-1和IL-8表达检测
培养48h后收集各组细胞的上清液,采用ELISA检测各组IL-6、MCP-1和IL-8的表达。按照试剂盒说明书中的方法绘制标准曲线,根据各组样品在450 nm处的吸光值计算IL-6、MCP-1和IL-8的含量,每个样品重复3次。
1.7 Western blot
按试剂盒说明书抽提各组细胞的核蛋白及胞浆蛋白,BCA法定量蛋白。利用上样缓冲液调平蛋白,100℃煮沸5min使蛋白变性。配置聚丙烯酰胺凝胶,进行SDS-PAGE。电泳结束后,电转移至PVDF膜上。将PVDF膜置于5%脱脂奶粉中封闭,加入一抗后4℃孵育过夜,TTBS洗膜4次,加入稀释的二抗后,37℃孵育45min。ECL底物发光法曝光胶片,并扫描入电脑,以β-actin为内参进行灰度分析。
2 结果
2.1 坏死细胞上清液对细胞增殖能力的影响
以OD值表示各组细胞的增殖能力,NCS组和IL-1组细胞增殖能力均显著高于对照组(P<0.01),NCS+IL-1 β组细胞增殖能力显著低于NCS组和IL-1 组,差异具有显著性(P<0.01)(图 1)。

图1 细胞增殖能力的比较Fig.1 Comparison of cell proliferation
2.2 坏死细胞上清液对MCP-1、IL-6和IL-8 mRNA表达的影响
RT-PCR结果表明,NCS组和IL-1组MCP-1、IL-8、IL-6的表达均显著高于对照组,差异具有统计学意义(P<0.05)。 NCS+IL-1组 MCP-1、IL-6和IL-8的表达均显著低于NCS组和IL-1组,差异具有统计学意义(P<0.05)(图 2)。
2.3 坏死细胞上清液对MCP-1、IL-6、IL-8的影响
ELISA检测结果提示,各组MCP-1、IL-6和IL-8的分泌情况与mRNA的表达结果基本一致,即NCS组和IL-1组显著高于对照组,差异具有统计学意义(P<0.05)。NCS+IL-1RA 组 MCP-1、IL-6和 IL-8的分泌显著低于NCS组和IL-1组,差异具有统计学意义(P<0.05)(图 3)。
2.4 坏死细胞上清液对NF-kB活性的影响
NCS组和IL-1组核蛋白中NF-kB的表达显著高于对照组(P<0.05),NCS+IL-1RA组则显著低于NCS组和IL-1组(P<0.05)。与对照组相比,NCS组和IL-1组的表达显著降低(P<0.01),NCS+IL-1组显著高于 NCS组和IL-1组(P<0.05)(图 4)。
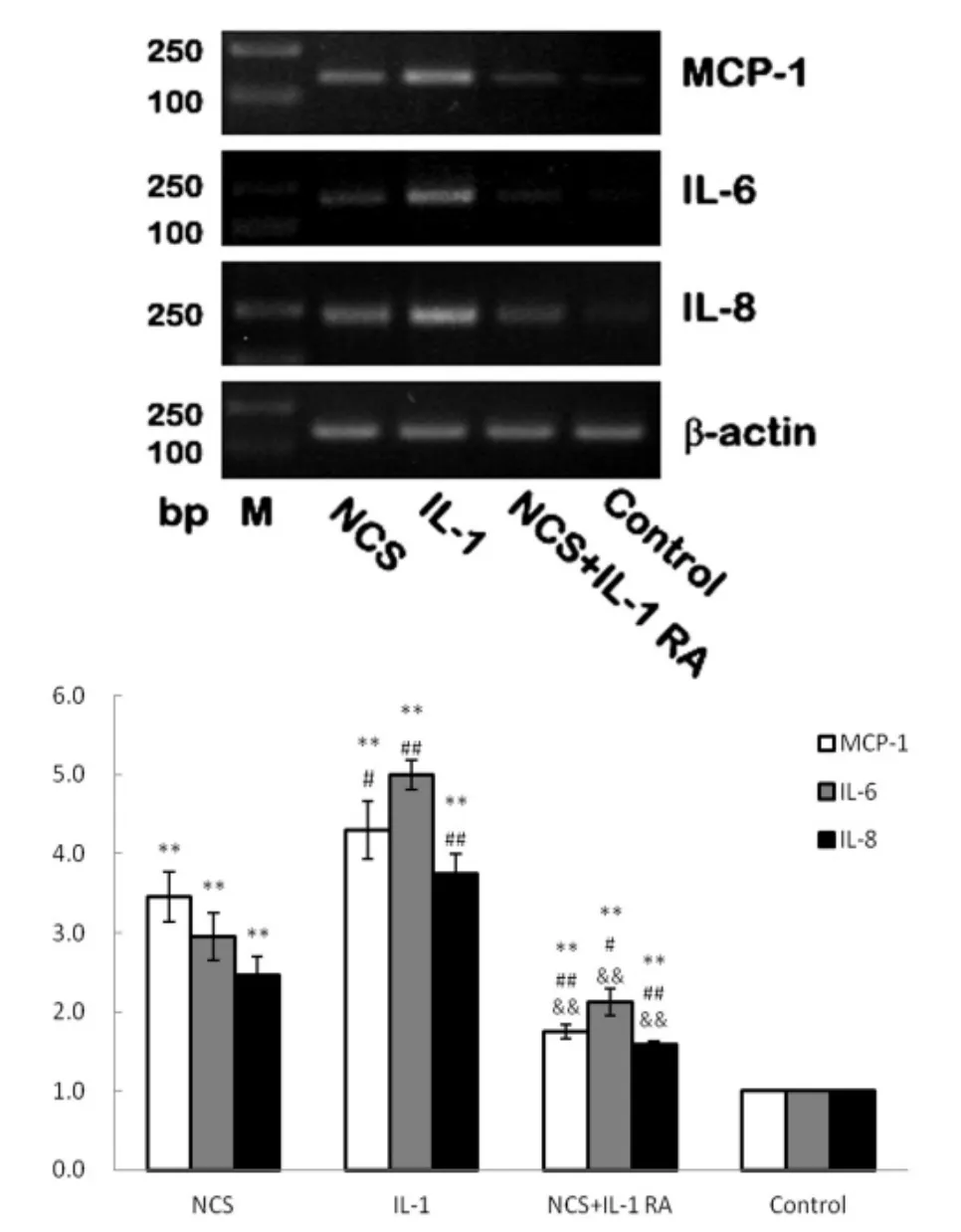
图2 MCP-1、IL-6和IL-8 mRNA的表达Fig.2 mRNA expression of MCP-1,IL-6 and IL-8

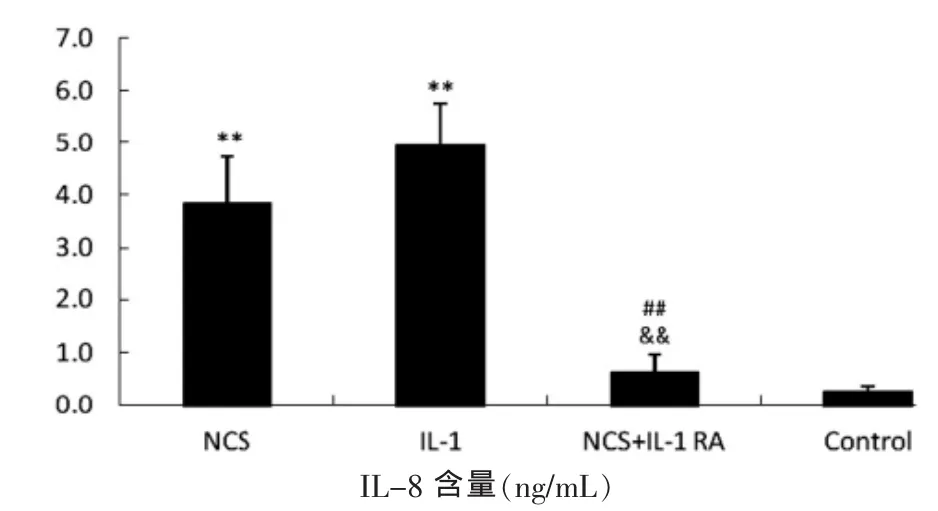
图3 MCP-1、IL-6和IL-8的表达Fig.3 Expression of MCP-1,IL-6 and IL-8
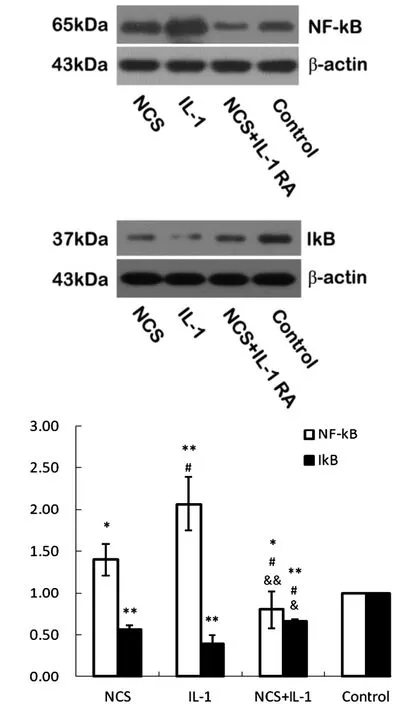
图4 各组NF-kB的活性Fig.4 NF-kB activity
3 讨论
正常生理条件下,血管平滑肌细胞的增殖和凋亡保持动态平衡,病理条件下内环境中某些因子的改变会导致血管平滑肌细胞的增殖失控,是临床常见心血管疾病的主要病理基础。血管平滑肌细胞存在两种不同的表型,即收缩型和合成型。收缩型在神经及激素的影响下调节血管壁张力,维持组织的血流量;合成型血管平滑肌细胞能够在血管壁的形成和损伤修复,以及生长因子的刺激下,进行分裂和增殖。在生长因子、细胞外基质、机械性作用力和细胞间的相互作用下,收缩型血管平滑肌细胞向合成型转变,是血管平滑肌细胞病理性增殖的主要表现[3]。
IL-1调控多种炎症因子和生长因子的表达,是冠状动脉重构过程中主要的活性细胞因子之一[4],在血管损伤后的新生内膜中表达增加,表明IL-1在新生内膜的形成过程中发挥着重要作用[5-6]。内皮细胞、平滑肌细胞和巨噬细胞分泌IL-1β,进一步诱导了细胞因子的表达,激活细胞黏附和增殖能力,是动脉粥样硬化和术后再狭窄等病变的关键[7],IL-1β基因敲除小鼠,动脉粥样硬化症状明显减轻[8],表明IL-1β在重塑类血管病变中发挥着重要作用。坏死的血管平滑肌细胞能够释放IL-1α和β,并促进周围细胞产生促炎因子[9]。本实验中,坏死细胞上清液和IL-1都显著促进正常细胞增殖和炎性因子的表达;而在坏死上清中加入IL-1RA,则明显抑制了其促增殖和促炎性分子分泌的作用。据此推测,坏死的血管平滑肌细胞可能释放大量IL-1,进而促进了周围正常细胞的增殖以及炎性因子的表达。
单核细胞趋化蛋白-1(Monocyte chemoattractant protein-1,MCP-1)和IL-8是主要作用于单核细胞和中性粒细胞的趋化因子,分别促进单核细胞和中性粒细胞的迁移和转化,能够损伤内皮细胞,分泌炎性因子,加剧血管壁内的炎症反应,在动脉粥样硬化等血管疾病的发生和发展中起着关键作用[10-11]。本实验中,NCS组和 IL-1组MCP-1、IL-6和IL-8的表达增加,而坏死上清中加入IL-1RA能够降低其表达,提示坏死细胞可能通过释放IL-1而加重周围正常细胞的炎性反应。
NF-kB是炎症反应的核心调节因子,血管炎症反应过程中的许多基因都是受NF-kB激活的。NF-kB可介导细胞产生各种细胞因子、黏附分子和生长因子,影响细胞周期和凋亡,促使平滑肌细胞增生并向内膜下迁移[12]。本实验中,NCS组和IL-1组NF-kB活性增强,而NCS中加入IL-1RA显著抑制了NF-kB的活性,表明坏死细胞可能通过释放IL-1而激活NF-kB,进一步诱导了多种细胞因子的释放。
[1]Kavurma MM,Bhindi R,Lowe HC,Chesterman C,et al.Vessel wall apoptosis and atherosclerotic plaque instability[J].Thromb Haemost,2005,3(3):465-472.
[2]Liang Meng,Bo Yu.Oxygen-and glucose-deprived culture promotes cell proliferation and inbasion of vascular smooth muscle cells[J].International Journal of Molecular Medicine,2011,28(5):777-783.
[3]Padro T,Mesters RM,Dankbar B,et al.The catalytic domain of endogenous urokinase-type plasminogen actibator is required for the mitogenic activity of platelet-derived and basic fibroblast growth factors in human vascular smooth muscle cells[J].J Cell Sci,2002,115(9):1961-1971.
[4]Taglieri C,Lombardo E,Feola M,et al.Prevention of left ventricular remodeling after myocardial infarction:efficacy of physical training[J].Monaldi Arch Chest Dis,2008,70(2):51-58.
[5]Ohashi N,Matsumori A,Furukawa Y,et al.Role of p38 mitogenactivated protein kinase in neointimal hyperplasia after vascular injury[J].Arterioscler Thromb Vasc Biol,2000,20(12):2521-2526.
[6]I Isoda K,Shiigai M,Ishigami N,et al.Deficiency of interleukin-1 receptor antagonist promotes neointimal formation after injury[J].Circulation,2003,108(5):516-518.
[7]Fearon WF,Fearon DT.Inflammation and cardiovascular disease:role of the interleukin-1 receptor antagonist[J].Circulation,2008,117(20):2577-2579.
[8]Chamberlain J,Evans D,King A,et al.Interleukin-1 beta and signaling of interleukin-1 in vascular wall and circulating cells modulates the extent of neointima formation in mice[J].Am J Pathol,2006,168(4):1396-1403.
[9]Murray CH,Sara Talib,Nichola L,et al.Vascular smooth muscle cell apoptosis induces interleukin-1-directed inflammation:effects of hyperlipidemia-mediated inhibition of phagocytosis[J].Circulation Research,2010,106(2):363-372.
[10]Kim HY,Kang YJ,Song IH,et al.Upregulation of interleukin-8/CXCL8 in vascular smooth muscle cells from spontaneously hypertensive rats[J].Hypertens Res,2008,31(3):515-523.
[11]Wang M,Monticone RE,Lakatta EG.Arterial aging:a journey into subclinical arterial disease[J].Curr Opin Nephrol Hypertens,2010,19(2):201-207.
[12]Brand K,Page S,Rogler G,et al.Activated transcription factor nuclear factor kappa B is present in the atherosclerotic lesion[J].J Clin Invest,1996,97(7):1715-1722.
