特定序列寡核苷酸对人骨髓间充质干细胞体外扩增及成骨分化的影响
2013-12-09刘春秀满大鹏杜晓岩康宁董平肖苒王丽颖
刘春秀 满大鹏 杜晓岩 康宁 董平 肖苒 王丽颖
人骨髓间充质干细胞 (Human bone marrow mesenchymal stem cells,hBMSCs)是组织工程重要的种子细胞,来源广泛,取材方便,但在骨髓中的含量很少。目前,应用生长因子促进BMSCs体外扩增及成骨分化的研究取得了一定成果,同时也暴露出一些问题,如生长因子不易人工合成、价格昂贵,需要通过构建不同的载体才能进入细胞内发挥作用等。ODN是指含有50个以下核苷酸单体的多核苷酸链,具有高效低毒、性质稳定、易于合成等优点。研究发现,人工合成的ODN能够显著促进大鼠BMSCs的增殖及成骨分化,并且能够促进大鼠成骨细胞、人成骨样细胞、人牙周膜干细胞及脂肪干细胞的增殖[1-4],本实验选取一种前期研究中作用明显的ODN进行研究,观察其对人骨髓间充质干细胞增殖及成骨分化的影响,为ODN用于骨组织工程种子细胞扩增与成骨分化的可行性提供理论参考。
1 材料与方法
1.1 实验仪器及材料
倒置荧光显微镜(Nikon公司),流式细胞仪(BD公司),多标记微孔板检测系统(PerkinElmer公司)。
人骨髓间充质干细胞(北京协和医院整形外科医院研究中心惠赠),寡核苷酸(吉林大学基础医学院王丽颖教授惠赠,大连宝生物公司合成),Ficoll淋巴细胞分离液(GE Healthcare公司),干细胞培养基(Sciencell公司),DMEM 低糖培养基、DMEM 高糖培养基、青霉素-链霉素溶液、胰蛋白酶、磷酸盐缓冲液(Hyclone公司),特级胎牛血清(GIBCO公司),CCK-8(Dojindo研究所,日本),碱性磷酸酶试剂盒(南京建成研究所)。
1.2 方法
1.2.1 hBMSCs体外分离、培养及鉴定
自患者髂前上棘抽取5 mL骨髓血(获知情同意,患者各项指标均正常),Ficoll梯度密度离心法收取单核细胞层,用10 mL干细胞培养基吹打混匀,接种至75 cm2的培养皿中,37℃、5%CO2饱和湿度培养箱孵育,待细胞汇合至80%~90%时,1∶3传代,观察细胞形态;传代后,取第2代生长良好的hBMSCs,消化离心,用含1%BSA的PBS洗涤3次后计数, 分别加入 CD73、CD90、CD105、CD34 单克隆抗体,同时每管样品设立同型阴性对照,避光冰上孵育45min,用含1%BSA的PBS洗涤细胞3次,以除去未结合抗体,用200μL含1%BSA的PBS重悬细胞,流式细胞仪检测分析;第3代hBMSCs汇合至80%~90%后,消化离心,以5000/cm2的密度接种至6孔板中,待细胞汇合至60%~70%后分别更换成骨(LG-DMEM,10%胎牛血清,1%青链霉素,10 mM β-甘油磷酸钠,10-8M地塞米松,0.05 mM维生素C)及成脂诱导液(HG-DMEM,10%胎牛血清,1%青链霉素,10-7M地塞米松,10 μM胰岛素,0.5 mM吲哚美辛,0.5 mM 3-异丁基-1-甲基黄嘌呤),72 h换液一次;取细胞悬液滴至6孔板中的细胞爬片上,贴壁后加入完全培养基,第2天更换成软骨诱导液(LG-DMEM,1%胎牛血清,1%青链霉素,10 μg/L TGF-β1,0.1 M L-脯氨酸,1× ITS),72 h 换液一次。
1.2.2 ODN MT01对hBMSCs体外扩增的影响
第3代hBMSCs汇合至80%~90%时,消化离心,干细胞培养基重悬,并计数,将细胞浓度调整为2000个/孔,接种至96孔板中,对照组和实验组均设5个复孔,周围孔加PBS以防止边缘效应产生。24h细胞全部贴壁后,实验组加入1 μg/mL ODN MT01(5'-ACCCCCTCTACCCCCTCTACCCCCTCT-3'),对照孔加入等量PBS。48 h换液一次,24h取一板,将10μL CCK-8加入各孔中,37℃避光孵育4h,多标记微孔板检测系统检测。
1.2.3 ODN MT01对hBMSCs成骨分化的影响
当第3代hBMSCs汇合至80%~90%时,消化离心,用完全培养基重悬,并细胞计数,调整细胞浓度为8000个/孔接种至六孔板,对照组和实验组均设3个复孔,待细胞完全贴壁后换成骨诱导液,实验组加入 1 μg/mL ODN MT01,对照孔加入等量 PBS,72 h换液一次,于第4、7、14、21天 用ALP试剂盒检测。
1.3 统计学处理
SPSS 17.0统计学分析软件进行处理,均采用多样本单因素方差分析。P<0.05为差异有统计学意义,P>0.01为差异有显著统计学意义。
2 结果
2.1 细胞生长与形态学特征
倒置显微镜下观察,原代细胞培养24h可见圆形透明的细胞贴壁,4 d后见细胞呈集落样生长,细胞逐渐伸展开,呈单核的小多角形或短梭形,8~10 d后细胞可达80%汇合,且出现细胞聚集成群现象,传代后细胞生长逐渐稳定,3~4 d可形成单层汇合,细胞分布呈束状或漩涡状(图1)。流式细胞仪检测CD73、CD90、CD105表达呈阳性,阳性率分别为94.4%、91.3%、87.8%;CD34表达阴性,阳性率为0.04%(图2)。成骨诱导14 d后,茜素红染色可见矿化结节;成脂诱导后14 d,油红O染色可见脂滴;成软骨诱导14 d,甲苯胺蓝染色可见蓝色异染颗粒,细胞外基质染成浅蓝色的软骨细胞(图1)。
2.2 ODN MT01对hBMSCs体外扩增的影响
检测hBMSCs接种后7 d的OD值,发现ODN MT01组在第3、4、5天的OD值与对照组相比有统计学差异(P<0.05),第6、7 d的OD值与对照组差异明显(P>0.01)(图 3)。
2.3 ODN MT01对hBMSCs成骨分化的影响
成骨诱导后第4、7、14、21 d的碱性磷酸酶吸光度值分析发现,成骨诱导第 4、14、21天,ODN MT01组ALP的OD值与对照组比较有统计学意义,第7天实验组与对照组相比无明显差别(图4)。

图1 hBMSCs形态学观察及多向分化鉴定Fig.1 Morphology observation and multi-differentiation identification of hBMSCs

图2 人骨髓间充质干细胞表面标志物的表达Fig.2 The expression of surface markers of human bone marrow mesenchymal stem cells
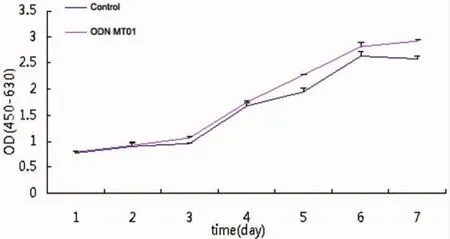
图3 ODN MT01对hBMSCs增殖的影响(*:与对照组比较 P<0.05;**:与对照组比较 P<0.01)Fig.3 The influences of ODN MT01 on the proliferation of hBMSCs(*:vs control group P<0.05;**:vs control group P<0.01)
3 讨论
BMSCs是骨组织工程重要的种子细胞,梯度密度筛选法分离BMSCs虽然操作繁琐,但纯度较高[5]。2006年,国际间充质干细胞委员会提出了MSCs的三条最低标准:塑料黏附性、特定的表面抗原表达和多向分化潜能[6]。本实验利用Ficoll梯度密度离心法分离纯化hBMSCs后,从形态学观察、表面标志物检测及多向诱导鉴定三方面证实了所分离纯化出的细胞具备干细胞特征。

图4 ODN MT01作用于hBMSCs第 4、7、14、21天 ALP表达OD值比较(*:与对照组相比P<0.05)Fig.4 Comparison of ALP activity of hBMSCs deal with ODN MT01 at 4,7,14,21 day(*:P<0.05,vs control group)
BMSCs增殖和成骨分化因子的研究,如成纤维细胞生长因子(bFGF)[7-8]、骨形成蛋白 2(BMP2)[9-10]、富血小板血浆(PRP)[11-12]等,都取得了一定的成果。但大多因子需要载体运载,价格昂贵。ODN存在于自然界某些低等生物基因组的DNA中,且哺乳动物本身的DNA分子不具有免疫刺激作用[13-15]。根据ODN的免疫调节作用,可将其分为3型:免疫刺激性的CpG ODN、中和性CpG ODN和不含CG基序的抑制性ODN。CpG ODN目前被广泛研究,在哮喘、变态反应性疾病、感染性疾病和肿瘤的治疗中效果良好[16-18];不含CG基序的抑制性ODN MT01能够调控一些重要成骨相关因子,如TNF-α、IFN-γ、RANKL、OPG、Osterix等,改变成骨细胞和破骨细胞的平衡影响骨代谢过程[1,19]。本实验将人工合成的ODN MT01直接加入到干细胞培养基中,能够持续稳定促进hBMSCs的增殖,加入到成骨诱导液中能够有效增强碱性磷酸酶活性,特别是在14 d后,常规成骨诱导液中的细胞ALP活性降低,而ODN组的ALP活性仍能维持在较高水平,成骨活性较强,可能是ODN促进了细胞的增殖,使细胞数量增加,也可能是ODN通过调控成骨相关因子促进成骨分化,或两者共同作用的结果。
综上所述,特定浓度的ODN MT01对hBMSC的体外扩增和成骨分化具有一定的促进作用,但是关于ODN MT01促进hBMSC的增殖和成骨分化的机制尚未明确,我们将进行更为深入的研究。
[1]Shen YQ,Feng ZY,Lin CT,et al.An oligodeoxynucleotide that induces differentiation of bone marrow mesenchymal stem cells to osteoblasts in vitro and reduces alveolar bone loss in rats with periodontitis[J].Int J Mol Sci,2012,13(3):2877-2892.
[2]冯志远.寡核苷酸(ODN)促成骨细胞增殖活化的作用及机制研究[D].长春:吉林大学,2011.
[3]秦雁雁,申玉芹,任春霞,等.不同序列CpG ODN对牙周膜细胞的促增殖作用[J].吉林大学学报(医学版),2012,38(5):876-879.
[4]王敏.MicroRNAs调控人脂肪源性干细胞成骨分化及ODN影响其调控的研究[D].长春:吉林大学,2010.
[5]王彤,吴燕峰,万智,等.骨髓间充质干细胞临床研究进展[M].北京:人民卫生出版社,2010,9-11.
[6]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent Mesenchymal stromal cells.The international society for cellular therapy position statement[J].Cytotherapy,2007,9(3):315-317.
[7]Zheng YH,Su K,Jian YT,et al.Basic fibroblast growth factor enhances osteogenic and chondrogenic differentiation of human bone marrow mesenchymal stem cells in coral scaffold constructs[J].J Tissue Eng Regen Med,2011,5(7):540-550.
[8]Qu D,Li J,Li Y,et al.Angiogenesis and osteogenesis enhanced by bFGF ex vivo gene therapy for bone tissue engineering in reconstruction of calvarial defects[J].J Biomed Mater Res A,2011,96(3):543-551.
[9]Huang W,Carlsen B,Wulur I,et al.BMP-2 exerts differential effects on differentiation of rabbit bone marrow stromal cells grown in two-dimensional and three-dimensional systems and is required for in vitro bone formation in a PLGA scaffold[J].Exp Cell Res,2004,299(2):325-334.
[10]Dong Y,Zhang Q,Li Y,et al.Enhancement of tendon-bone healing for anterior cruciate ligament(ACL)reconstruction using bone marrow-derived mesenchymal stem cells infected with BMP-2[J].Int J Mol Sci,2012,13(10):13605-13620.
[11]卢萌,陈伟辉,曲延征.富血小板凝胶的制备及骨修复作用[J].中国组织工程研究与临床康复,2008,12(23):4493-4496.
[12]Lucarelli E,Beretta R,Dozza B,et al.A recently developed bifacial platelet-rich fibrin matrix[J].Eur Cell Mater,2010,20:13-23.
[13]Bird AP.CpG-rich islands and the function of DNA methylation[J].Nature,1986,321(6067):209-213.
[14]Klinman DM,Barnhart KM,Conover J.CpG motifs as immune adjuvants[J].Vaccine,1999,17(1):19-25.
[15]Bird AP,Taggart MH,Nicholls RD,et al.Non-methylated CpG-rich islands at the human alpha-globin locus:implications for evolution of the alpha-globin pseudogene[J].EMBO J,1987,6(4):999-1004.
[16]Senti G,Johansen P,Haug S,et al.Use of A-type CpG oligodeoxynucleotidesasan adjuvantin allergen-specific immunotherapy in humans:a phase I/II a clinical trial[J].Clin Exp Allergy,2009,39(4):562-570.
[17]Bai JY,Yang YT,Zhu R,et al.CpG oligodeoxynucleotides discriminately enhance binding capacity of human naive B cells to Hepatitis B virus epitopes[J].Can J Microbiol,2012,58(6):752-759.
[18]Lou YY,Liu CW,Lizée G,et al.Antitumor activity mediated by CpG:the route of administration is critical[J].J Immunother,2011,24(3):279-288.
[19]Chang JH,Chang EJ,Kim HH,et al.Enhanced inhibitory effects of a novel CpG motif on osteoclast differentiation via TREM-2 down-regulation[J].Biochem Biophys Res Commun,2009,389(1):28-33.
