Kir2.1/Kir2.3 嵌合体的构建与表达
2013-12-07赵志英朱宏谦张国红
赵志英,朱宏谦,张 璇,刘 丽,张国红
(1.河北医科大学药理学教研室,教育部血管与神经生物学重点实验室,河北省新药药理毒理研究重点实验室,河北石家庄 050017;2.河北省公安厅国内安全保卫总队,河北石家庄 050051)
内向整流钾通道 (inwardly rectifying potassium channel,Kir)的特征是钾离子容易由细胞外向细胞内流动,表现出强烈的电压依赖性内向整流特性,这种通道的整流作用有利于维持细胞的静息电位并参与复极化过程[1]。Kir通道至少由7个家族组成,它们在各种组织中广泛分布,Kir2.0家族是它的重要一员,主要存在于心脏、泌尿系统、神经系统、骨骼肌等许多组织。Kir2.1和Kir2.3是Kir2.0家族中的重要成员,在心脏,Kir2.1和Kir2.3是心脏内向整流钾电流的重要组成部分,对维持心肌细胞动作电位起重要作用;在肾脏,Kir2.1和Kir2.3是肾皮质集合管内向整流钾电流的重要组成部分,对维持肾脏的泌钾、滤过重吸收等生理功能起重要作用。Kir2.1钾通道是目前Kir2.0家族中发现的唯一一个与离子通道病有关的通道。编码Kir2.1钾通道的基因突变,将会引起安德森综合征(Andersen’s syndrome,AS),典型的临床表现为周期性麻痹、室性心动过速性心律失常和明显的结构异常[2]。研究Kir2.1和Kir2.3的调控机制对研究整个内向整流钾通道家族的调控机制有重要意义[3]。在研究过程中人们发现Kir2.3可以被细胞内或细胞外的许多信号分子如Mg2+、多胺、H+、蛋白激酶C(PKC)、磷脂酰肌醇4,5二磷酸(PIP2)、花生四烯酸、植物雌激素、ATP等所调控[4-6],而这些调控因素都对 Kir2.1没有作用或作用很弱,因此我们设想构建不同的Kir2.1和Kir2.3通道嵌合体,为进一步研究Kir2.3的调控机制和通道特异性阻断剂提供实验基础。
1 材料与方法
1.1 主要试剂与仪器 Kir2.3,Kir2.1的cDNA克隆在质粒pGEMHE中。pGEMHE质粒DNA由美国纽约大学西奈山医学院生理学系Diomedes Logothetis教授馈赠。Pyrobest DNA polymerase、EcoRI、BamHI等限制性核酸内切酶购自日本TaKaRa公司,琼脂糖凝胶回收试剂盒购自美国Promega公司。基因扩增仪购自德国Biometra公司,Nanoliter Injector RNA注射仪购自美国WPI公司,Geneclamp 500B放大器购自美国Axon公司。
1.2 方法
1.2.1 嵌合体构建 以 N1P3C3为例说明 Kir2.1/Kir2.3嵌合体构建过程。将Kir2.3通道的氨基末端替换为Kir2.1通道的氨基末端,根据GenBank发表的Kir2.1和Kir2.3通道的序列设计出扩增Kir2.1通道氨基末端的引物和扩增Kir2.3通道孔区、跨膜区、羧基末端的引物。Kir2.1-N上游引物包含一个 BamHI酶切位点为:5'-CGGGGATCCATGGGCAGTGTGAGAACC-3';下游引物为:5'-GAGACAAGGAAGGCCGCGGAGAAGATAACCAGCATCCACC-3';以 Kir2.1-pGEMHE质粒DNA为模板,PCR扩增条件为94℃预变性5 min;94℃ 1 min,58℃ 1 min,72℃ 1 min,25 个循环;72℃延伸10 min。Kir2.3-PC上游引物为:5'-GTGGATGCTGGTTATCTTC TCCGCGGCCTTCCTTGTCTCC-3';下游引物包含一个 EcoRI酶切位点为:5'-GATGAATTCGATCCGGGGACCTAGAGAGCCAC-3';以Kir2.3-pGEMHE质粒DNA为模板,PCR扩增条件为94℃预变性5 min;94℃ 1 min,60℃ 1 min,72℃ 1 min,25个循环;72℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳进行分析,切胶纯化,并作为模板进行重叠延伸PCR,扩增条件为94℃预变性5 min;94℃ 1 min,55℃ 1 min,72℃ 1 min,8 个循环;72℃延伸 10 min。再加入 Kir2.1-N上游引物和Kir2.3-PC下游引物进行扩增,扩增条件为94℃预变性 5 min;94℃ 1 min,58℃ 1 min,72℃ 1 min,25 个循环;72℃延伸10 min。PCR产物纯化后与pGEMHE质粒DNA进行 EcoRI和 BamHI双酶切,酶切后进行纯化,在T4DNA连接酶作用下进行连接,连接产物转化TOP10感受态细胞,挑取阳性克隆,扩菌增菌,抽提质粒进行酶切鉴定,送基因测序公司进行测序分析,挑选没有突变的克隆,命名为N1P3C3。采用同样的方法构建其它的嵌合体质粒。
1.2.2 嵌合体通道表达 嵌合体通道质粒DNA用限制性核酸内切酶NheI将其线性化,采用RibomaxTMLarge Scale RNA Production Systems-SP6 and T7 Kit试剂盒体外转录得到cRNA。分离爪蟾卵母细胞,将cRNA注入爪蟾卵母细胞,在18℃培养1-2天后,用双电极电压钳记录电流是否表达。灌流液 ND96(mmol·L-1):NaCl 96,KCl 1,MgCl21,CaCl21.8,HEPES 5,用 NaOH 调 pH 为7.4;ND96K(mmol·L-1):KCl 96,NaCl 1,MgCl21,CaCl21.8,HEPES 5,用 KOH 调 pH为7.4。
1.2.3 记录电流 室温下(22℃ ~24℃)记录电流,放大器Mode设为SETUP状态。按下按钮Zero V1和Zero V2使两电极电位显示为零,用R1和R2测量电极电阻。刺入电极,将放大器Mode调为Voltage clamp状态,记录通道电流。信号的采集和分析软件为pClamp 9.0。实验所用protocol为:先将膜电位钳制在0mV,然后从-90 mV逐渐增加(ramp)到+90 mV。
1.2.4 数据处理 采用 Clampfit 9.0(美国Axon公司)和OriginPro 7.0(美国Origin Lab公司),Adobe Illustrator 10等软件进行图像处理及数据分析。
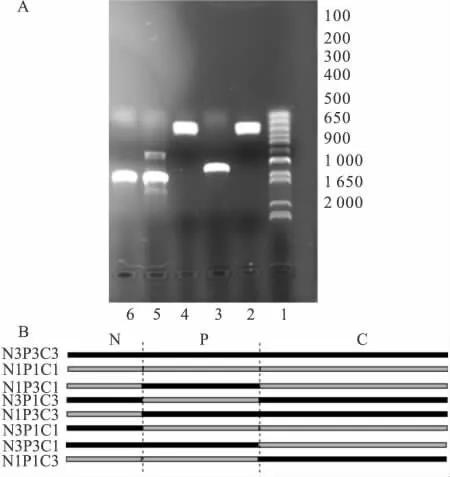
Fig 1 Construction of Kir2.1/Kir2.3 chimeras by over-lap extension PCR
2 结果
2.1 嵌合体构建 由于Kir2.1和Kir2.3通道都属于同一个Kir2.0亚家族,他们的氨基酸序列具有58%的同源性,因此构建Kir2.1和Kir2.3通道的嵌合体产生功能性通道的可能性很大。根据已知的Kir通道结构,他们以一个较短的氨基末端(N)在细胞内起始,经过两次跨膜折叠(M1,M2)后,以一个较长的羧基末端(C)在细胞内终止[7]。构建嵌合体通道时首先考虑将通道的氨基和羧基末端进行互换。通道命名原则如下:数字1和3分别代表Kir2.1和Kir2.3通道,字母N代表氨基末端,字母C代表羧基末端,字母P代表两个跨膜区和孔区。我们首先构建一个嵌合体通道N1P3C3,即通道的氨基末端来源于Kir2.1通道,通道的两个跨膜区和孔区、羧基末端来源于Kir2.3通道。以Kir2.1质粒DNA为模板,扩增出Kir2.1通道氨基末端,以Kir2.3质粒DNA为模板,扩增出Kir2.3通道跨膜区和孔区、羧基末端,经重叠延伸PCR,扩增产物为N1P3C3,产物长度为1 450 bp,经过胶回收,双酶切纯化后与pGEMHE载体DNA连接,得到N1P3C3-pGEMHE,经测序验证,挑选没有碱基突变的克隆。至此,嵌合体通道N1P3C3构建成功(Fig 1 A)。以类似的方法分别将通道的氨基末端、羧基末端、跨膜区和孔区进行互换,成功构建 N3P1C1,N3P3C1,N1P1C3,NIP3C1,N3P1C3 等几个嵌合体通道。N1P3C3和N3P1C1是将通道的氨基末端进行了互换,N1P3C3是指通道的氨基末端来源于Kir2.1通道,通道的两个跨膜区和孔区、羧基末端来源于Kir2.3通道;N3P1C1是指通道的氨基末端来源于Kir2.3通道,通道的两个跨膜区和孔区、羧基末端来源于 Kir2.1通道。N3P3C1和N1P1C3是将通道的羧基末端进行了互换。NIP3C1和N3P1C3是将通道的氨基末端和羧基末端同时进行了互换(Fig 1 B)。
2.2 电压钳记录嵌合体电流 将嵌合体通道N1P3C3表达于卵母细胞,双电极电压钳记录电流,观察电流特征。灌流液为ND96K(在此溶液所记录到的内向电流最大),钳制电压为由-90 mV渐变成+90 mV,根据电流随电压的变化可得到N1P3C3通道的电压电流关系曲线,横坐标上方的电流为外向电流,横坐标下方的电流为内向电流(Fig 2)。由Fig 2可以看出N1P3C3通道的内向电流明显大于外向电流,且内向电流与电压有明显的线性关系,而外向电流则没有这种线性关系,反转电位在ND96K灌流情况下为0 mV左右。Ba2+是钾通道的阻断剂,用含 0.3 mmol·L-1BaCl2的ND96K灌流N1P3C3通道。为了更清楚地观察电流,我们选取观察高钾情况下电流幅度较大的-80 mV时的电流,+80 mV的电流为对照,结果显示Ba2+能够有效抑制N1P3C3的电流(Fig 3)。这些结果表明N1P3C3的电流特征没有改变,符合内向整流钾通道的电流特征。将其它嵌合体通道N3P1C1,N3P3C1,N1P1C3,NIP3C1,N3P1C3 同样表达于非洲爪蟾卵母细胞,记录电流,得到了相同的结果,嵌合体通道的电流特性均未改变(结果未显示)。
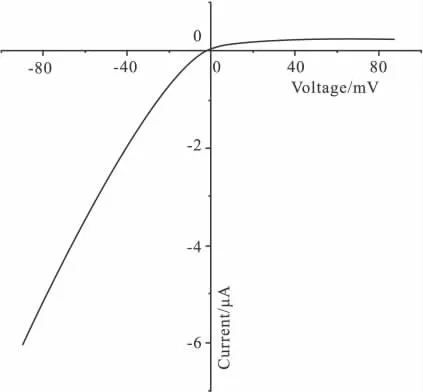
Fig 2 Current-voltage relationship of Kir2.3 currents in high-K+solution(ND96K)
3 讨论
内向整流钾通道在各种组织广泛分布,其电流特征为钾离子流入细胞内远比流出细胞外容易。Kir通道是由4个同源或异源亚基组成的四聚体,每个亚基都是由氨基末端、孔区和跨膜区、羧基末端组成,结构相似,因此构建Kir2.1和Kir2.3的嵌合体通道可行性很高,产生功能性通道的几率很大[7]。

Fig 3 Whole-cell Kir2.3 currents recorded by two electrodes voltage clamp(TEVC)
Kir2.1和Kir2.3是Kir2.0家族重要成员,在神经系统、心血管系统等许多组织都有分布,起着重要的生理作用,许多调控因子对他们都有调节作用。但近年来的研究发现调控因子对Kir2.1和Kir2.3调控作用大相径庭。PIP2是细胞信号传导的重要分子[8],PIP2水解使Kir2.3通道电流明显下降,对Kir2.1通道电流影响不大,但PIP2抑制Kir2.3通道电流的具体机制尚不明确;共同表达Kir2.3通道蛋白与Gβγ亚单位于非洲爪蟾卵母细胞,可以发现Gβγ亚单位能够完全抑制Kir2.3通道电流,而对Kir2.1通道电流却没有作用[9];氢离子在Kir2.3的门控机制中起重要作用,高CO2和低pH值抑制Kir2.3通道电流,对Kir2.1没有作用;在非洲爪蟾卵母细胞,PKC的激活剂佛波醇酯(PMA)明显抑制Kir2.3通道电流,对Kir2.1没有作用[4];花生四烯酸是一种多不饱和脂肪酸,能够明显且可逆地增大在中国仓鼠卵巢上皮细胞表达的Kir2.3通道电流,对Kir2.1没有作用[6];如此可见,许多调控因子对Kir2.3通道电流都有作用,对Kir2.1通道电流没有作用或作用较弱。Kir2.1和Kir2.3通道同源性很高,而我们的实验证实,将通道的氨基末端、羧基末端、孔区和跨膜区进行互换,构建的嵌合体通道都产生了功能,电流特性没有发生改变,这为以后进一步研究调控因子对Kir2.1和Kir2.3通道的作用,确定通道与调控因子的作用位点打下了基础。先将调控因子作用于嵌合体通道,分析通道的氨基、羧基、孔区和跨膜区哪些片段与调控因子对通道的调节作用有关,在此基础上分析这些片段上哪些位点的氨基酸是调控因子作用的关键位点。
我们对于Kir2.0通道功能的了解主要通过研究人类疾病引起的通道变化、基因敲除小鼠等。由于一直没有通道特异性阻断剂,不同亚型Kir2.0通道的研究进展受到了很大限制。已有报道编码Kir2.1钾通道的基因突变引起安德森综合征。但是Kir2.1钾通道是目前Kir2.0亚家族中发现的唯一一个与离子通道病有关的通道,目前还没有关于编码Kir2.3钾通道的基因突变引起临床疾病的报道。因此通道特异性阻断剂的研发必将会成为Kir2.0家族通道生理功能研究、药物特性研究的里程碑事件。然而,到目前为止,Kir2.0通道的阻断剂仅限于钡离子、铯离子,许多非特异性药物比如:植物雌激素、抗组胺药、卡维地洛、抗疟药甲氟喹、盐酸米帕林[5,10-13]等都可以明显抑制 Kir2.3 通道电流,对Kir2.1没有作用或作用较弱。因此我们可以通过构建Kir2.1和Kir2.3通道的嵌合体,在上述药物对Kir2.3通道电流特异性抑制作用的基础上,进一步研究药物对Kir2.3通道的作用机制,找到它们的作用位点,进而为下一步找到通道的特异性阻断剂,研究通道的生理病理意义打下基础。
一些内向整流钾通道功能改变可能引起某些非遗传性病理生理变化比如房颤[14,15]。由于Kir2.1和Kir2.3的广泛分布及其在神经细胞和心肌细胞等的电生理活动中起重要作用,进一步明确Kir2.1和Kir2.3的功能,了解与通道偶联的受体、第二信使及其他信号分子对Kir2.1和Kir2.3的调控,研究 Kir2.1和 Kir2.3通道的特异性阻断剂十分重要[15]。而本实验成功构建的Kir2.1和Kir2.3通道的嵌合体为此打下了坚实的基础。
[1]Guo D,Ramu Y,Klem A M,Lu Z.Mechanism of Rectification in inward rectifier K+Channels[J].J General Physiol,2003,121(4):261-775.
[2]何海燕,尹永强,李宏杰,等.牛磺酸镁对缺氧/复氧致大鼠心肌细胞内向整流钾通道异常的影响[J].中国药理学通报,2012,28(12):1751-6.
[2]He H Y,Yin Y Q,Li H J,et al.Effects of taurine magnesium coordination compound on abnormal inward rectifier potassium channel current induced by hypoxia reoxygenation in cardiomyocytes of rats[J].Chin Pharmacol Bull,2012,28(12):1751-6.
[3]Kulzer M,Seyler C,Welke F,et al.Inhibition of cardiac Kir2.1-2.3 channels by beta3 adrenoreceptor antagonist SR 59230A[J].Biochem Biophys Res Commun,2012,424(2):315-20.
[4]杜肖娜,何宏涛,王 川,张海林.PKC对两种表达系统中内向整流性钾通道调节的不同及机制研究[J].中国药理学通报,2008,24(12):1615-9.
[4]Du X N,He H T,Wang C,Zhang H L.Study of the mechanism of different regulation of Kir current in two expressions systems by PKC[J].Chin Pharmacol Bull,2008,24(12):1615- 9.
[5]Zhao Z Y,Liu B Y,Zhang G H,et al.Molecular basis for genistein-induced inhibition of Kir2.3 currents[J].Pflugers Arch-Eur J Physiol,2008,456(2):413-23.
[6]Wang C,Mirshahi U L,Liu B Y,et al.Arachdonic acid activates Kir2.3 channels by enhancing channel-PIP2 interactions[J].Mol Pharmacol,2008,73(4):1185-94.
[7]Hibino H,Inanobe A,Furutani K,et al.Inwardly rectifying potassium channels:their structure,function,and physiological roles[J].Physiol Rev,2010,90(1):291-366.
[8]陈兴娟,张熙东,张 璇,等.蛋白激酶C和磷脂酰肌醇4,5二磷酸之间相互调节作用的研究进展[J].中国药理学通报,2012,28(11):1497-9.
[8]Chen X J,Zhang X D,Zhang X,et al.Progress in the research of mutual regulation between PKC and PI(4,5)P2[J].Chin Pharmacol Bull,2012,28(11):1497-9.
[9]Cohen N A,Sha Q,Makhina E N,Inhibition of an inward rectifier potassium channel(Kir2.3)by G-protein betagamma subunits[J].J Biol Chem,1996,271(50):32301-5.
[10]Liu B Y,Jia Z F,Geng X,et al.Selective inhibition of Kir currents by antihistamines[J].Eur J Pharmacol,2007,558(1- 3):21-6.
[11]Ferrer T,Ponce-Balbuena D,Lopez-Izquierdo A,et al.Carvedilol inhibits Kir2.3 channels by interference with PIP2-channel interaction[J].Eur J Pharmacol,2011,668(1-2):72-7.
[12]Lopez-Izquierdo A,Ponce-Balbuena D,Moreno-Galindo E G,et al.The antimalarial drug mefloquine inhibits cardiac inward rectifier K+channels:evidence for interference in PIP2-channel interaction[J].J Cardiovasc Pharmacol,2011,57(4):407-15.
[13]López-Izquierdo A,Aréchiga-Figueroa I A,Moreno-Galindo E G.Mechanisms for Kir channel inhibition by quinacrine:acute pore block of Kir2.x channels and interference in PIP2 interaction with Kir2.x and Kir6.2 channels[J].Pflugers Arch,2011,462(4):505-17.
[14]Ehrlich J R.Inward rectifier potassium currents as a target for atrial fibrillation therapy[J].Cardio-vasc Pharmaco,2008,52(2):129-35.
[15]De Boer T P,Houtman M J,Compier M,et al.The mammalian K(IR)2.x inward rectifier ion channel family:expression pattern and pathophysiology[J].Acta Physiol(Oxf),2010,199(3):243-56.