抑癌基因PTEN与肿瘤血管生成研究进展
2013-12-07沈存思范方田陈文显王爱云
沈存思,范方田,陶 丽,陈文显,2,王爱云,2,陆 茵,2
(1.南京中医药大学药学院;2.江苏省中药药效与安全性评价重点实验室,江苏南京 210023)
1997年由三个研究小组分别从10q23.3上定位克隆了同一种抑癌基因,并从各自角度给予了命名,称为抑癌基因PTEN,另外也叫MMACI或TEP1。该基因自发现起就一直在肿瘤治疗研究中受到重视和关注,如今已发现PTEN在肿瘤增殖,侵袭,迁移过程中发挥极其重要的作用。近年来,国内外愈来愈多的研究发现PTEN与肿瘤血管生成的关系十分密切,它可以通过激活PI3K信号通路,调控缺氧诱导因子1(HIF1),血管内皮生长因子(VEGF)等,起到抑制肿瘤血管生成的作用。本文就近年来关于抑癌基因PTEN在肿瘤血管生成中的作用及其分子调节信号通路进行的概述,期望对肿瘤血管抑制剂的研发及肿瘤血管生成机制的研究提供参考。
1 PTEN突变或缺失可引起肿瘤发生和发展
PTEN抑癌基因是双特异蛋白磷酸酶家族(DSPs)的成员,具有脂质磷酸酶和蛋白酪氨酸磷酸酶活性[1],PTEN被发现在多数恶性肿瘤中缺失,突变或者被抑制。它的突变首先影响了PTEN磷酸酶区域并且导致许多疾病,如小脑发育不良性节细胞瘤,BRR综合征,并增加了乳腺,甲状腺,子宫等器官癌变发生[2]。随着相关研究的不断深入,近年来研究发现PTEN突变可以促进肿瘤血管生成导致肿瘤的发展。
2 抑癌基因PTEN调控肿瘤血管生成途径促肿瘤的发展
PTEN的表达主要受miRNA(如miR-21),磷酸化,乙酰化,泛素化等转录后调控[3]。大量的研究表明,PTEN基因的缺失在肿瘤的发生发展中起到了重要的作用,而它对肿瘤的血管生成过程可以通过影响磷脂酰肌醇-3激酶(PI3K)/丝-苏氨酸激酶(AKT)信号途径来实现[4-5],主要过程是:PTEN通过其脂质磷酸酶活性,可逆转PI3K的磷酸化作用,将磷脂酰肌醇-3磷酸(PIP3)的磷酸基团移除,使之还原成磷脂酰肌醇-2磷酸(PIP2),维持胞内低PIP3水平。到目前已有大量的实验研究报道了PTEN对肿瘤血管生成过程部分关键信号都有调控作用,下面分别进行阐述。
2.1 PTEN与HIF1信号的关系 HIF1与肿瘤血管生成密切相关,肿瘤的发展开始被限制在1~2 mm3是由于供氧,供能不足,肿瘤在低氧状态下会优先首先触发血管生成机制HIF1信号通路,它是血管生成信号途径的关键性的转录调控因子[6]。在研究中发现PTEN在胶质母细胞瘤中有抑制HIF1的稳定以及它的转录因子活性。此外,一些研究报道在肾透明细胞癌中,HIF1通路中2个重要的调控者VHL和PTEN基因都会有相伴性的丢失[7-8]。另外又有研究证明了在卵巢肿瘤细胞中PTEN表达上调会导致HIF1α,VEGF,和增殖细胞核抗原表达的下调[9]。胃癌的微阵列芯片分析实验显示PTEN的表达与VEGF以及MMPs的表达呈现负相关[10],在一些胰腺癌中,miR-21对于提高VEGF和MMPs的表达也有着重要作用,而这些影响通过PI3K抑制剂治疗有可能被消除[11]。更广泛的细胞系(如PC-3,HepG2等细胞)进行的相关实验[12-13]也得到了类似的结果,综合上述实验提示,PTEN影响肿瘤血管生成的机制之一有可能是通过调控PI3K通路影响来HIF1信号进而调控VEGF的表达,基于这一点,基于HIF1信号途径为靶点的肿瘤血管生成的药物研究应考虑对PTEN的调控。
2.2 PTEN对血管生成中Ang/Tie2体系的影响 Ang/Tie2(促血管生成素/血管紧张素2)体系在肿瘤血管生成也起到了重要的作用。该途径主要作用机制:VEGF会引起血管的出芽生长,但此时血管腔不完整,通透性高,缺少周细胞等。Ang1的表达增高后,能够募集周细胞和平滑肌细胞等使血管稳定。Ang2则起到双重作用,既可阻断Ang1的血管稳定作用,导致血管床退化,血管外基质降解。还可促进血管新生,其机制可能是Ang2结合Tie2,抑制Ang1的活性,诱导血管旁细胞从内皮细胞上分离,增加内皮细胞的凋亡。Ang2的活化导致肿瘤血管数量的大规模减少和血管直径增大。血管的减少导致缺氧,进而上调肿瘤细胞 VEGF的表达,导致肿瘤的周围明显的血管生成[14]。另外也有研究报道VEGF被抑制后,Ang1/tie2有利于肿瘤的生长以及血管生存[15]。近年相关研究发现Ang-1刺激Tie-2触发了PI3K通路的激活[16]。初步揭示了Ang/Tie-2体系与PI3K通路的关联性。另外,有相关研究报道称脱落的Tie2受体能与Ang-1和Ang-2结合,从而抑制Tie2的磷酸化作用以及激活,而这一过程的调控是通过VEGF依赖性的PI3K通路激活来实现的,并证明 PTEN的过表达增加了 Tie-2的释放[17]。该研究进一步提示了是PTEN可能调控了Ang/Tie-2体系,进而影响肿瘤血管生成,并且VEGF是该途径的一个重要参与者。因此,以Ang/Tie靶向治疗肿瘤血管生成的药物也应考虑到PTEN的影响因素。
2.3PTEN与钠氢交换调控因子1(NHERF1)的关系 钠氢交换调控因子1(NHERF1)是一种氨基酸组成的多功能连接蛋白,其分布位置与表达水平将决定其功能。当其位于细胞膜上,可能表现为一个肿瘤抑制因子。当其处于细胞质中,可能成为致癌蛋白,其功能机制主要是通过调控血小板衍生因子(PDGF)、外向整流氯离子通道(ORCC)等信号通路等促进肿瘤发生以及肿瘤血管生成[18]。PTEN定位在细胞内部也是PTEN调控作用的一部分,因为在细胞膜上缺损PTEN的转位会削弱它对PI3K的信号的控制[19-20]。另外一些研究发现链接蛋白NHERF1与细胞膜上PTEN转位是有关联的。它们也证实了缺损PTEN的转位会导致持续的Akt激活。有研究发现NHERF1能够引起一些受体酪氨酸激酶(RTK)间的相互作用,例如 PDGFR,EGFR[21],它们都在肿瘤血管生成中发挥着重要作用,PTEN可能通过影响NHERF1的途径干预肿瘤血管生成过程,另外有研究发现PTEN在细胞膜上的转位不仅仅与RTK下游信号的调控有关,还与自身的表达调控相关[22],可作为一个新的肿瘤血管生成研究切入点进行深入探究。
2.4 PTEN对血管内皮细胞(EC)的影响 血管内皮细胞在肿瘤血管生成中起到起关键作用,肿瘤组织新生血管需要募集血管内皮细胞,包括邻近已有的内皮细胞出芽,增殖和迁移经过重塑形成的肿瘤血管,或者肿瘤细胞自身形变贴附血管壁发生血管生成拟态以及骨髓源性内皮祖细胞整合到局部肿瘤血管分化为成熟内皮细胞。PTEN对内皮细胞的行为也具有调控作用。一些实验表明在大部分的细胞基质和内皮细胞中扰乱PTEN的表达,这样能够减少PTEN信号在内皮细胞中PI3K的激活,并导致了内皮细胞增殖,生存以及迁移能力的增加,这些变化往往都是肿瘤血管生成重要因素及标志[23]。此外最近有相关研究也显示PTEN可能影响到内皮细胞的周期[24],进而影响其分化增殖。该相关研究表明在肿瘤血管生成过程中,PTEN对内皮细胞在肿瘤血管生成中的行为的影响不仅是间接的,还有可能使是直接的作用。
2.5PTEN与内皮一氧化氮合成酶(eNOS)、NO关系 近年的研究表明[25],eNOS来源的NO参与了肿瘤新生血管的生成,有文献报道eNOS在肿瘤组织中有广泛的表达。并通过生成NO来调节内皮细胞的状态以及骨髓内皮祖细胞(EPC)的动员和归巢[26]。NO在血管生成中也促成了脉管膨胀。又有人通过eNOS的基因敲除或抑制其活性,抑制了外周血管内皮祖细胞的归巢以及肿瘤新生血管的生成[27],也再次验证了氧化产物在肿瘤血管生成中的重要性。有文献报道了在肿瘤细胞以及内皮细胞中,PTEN都参与了eNOS的调控,另外又有证明VEGF诱导的内皮NO产物能维持急性髓细胞白血病细胞的生长,并且发生机制涉及到 PI3K通路[28]。上述研究揭示了癌细胞和内皮细胞中PTEN与内皮含氮氧化物合酶调控是相关的,并且影响到了肿瘤血管生成,进一步的作用机制有待探究。
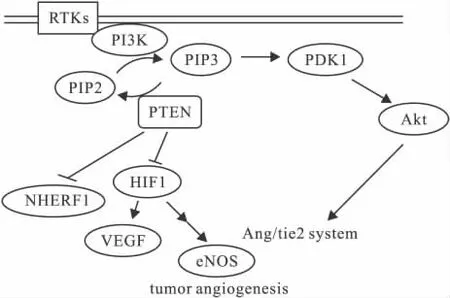
Fig 1 PTEN participates in regulation of tumor angiogenesis
3 PTEN与肿瘤的抗血管生成治疗
综上所述,PTEN与多种影响肿瘤血管生成的因素相关,尽管PI3K途径被认为在肿瘤血管生成中是一个重要的信号调控节点,而PTEN对PI3K的信号又起到了重要的调控因素,从而与PI3K具有同等调控肿瘤血管生成的作用,也被视为调控肿瘤血管生成的一个关键节点。目前,临床上针对肿瘤血管生成的治疗主要集中在对抗VEGF,EGF等信号的过度活化,例如单克隆抗体针对VEGF-A如贝伐单抗,VEGFR的络氨酸酶抑制剂如索拉菲尼。然而长期治疗会出现肿瘤耐药的问题。这些耐药性机制通常与VEGF,bFGF或EGF诱导HIF-1和PI3K信号通路相关[29-30]。值得注意的是临床研究证实肿瘤细胞对抗抗EGFR治疗的效果与PTEN相关,并且抗EGFR治疗效果与PTEN表达量呈正相关。这为EGFR耐药的问题提供了新的思路[31-32]。与此同时,临床研究还发现MMPs的过表达是耐药的又一机制,而PTEN和MMPs表达也呈负相关,因此此类抗TKI的耐药也可能通过上调PTEN解决。目前抗酪氨酸激酶抑制剂(TKI)耐药的研究热点主要集中在PI3K,AKT和mTOR抑制剂,但均处于临床试验阶段[33-34]。但是目前为止没有发现PTEN的诱导剂进入临床试验研究,庆幸的是针对PTEN的基因治疗已处实验阶段,有报道野生型PTEN转染到人类前列腺癌细胞,可以减少肿瘤血管生成[35]。虽然这项工作是一个巨大的挑战,却能为抗TKI耐药带来希望。
4 结语与展望
肿瘤血管生成是在肿瘤发生发展过程中的一个关键因素。抗肿瘤血管生成是目前抗肿瘤治疗其中一个重要的有效的手段。抑癌基因PTEN自发现以来一直作为抗肿瘤研究中一个重要的研究对象,随着国内外对PTEN与肿瘤关系研究的不断深入,逐步发现了PTEN与肿瘤血管生成机制中关键因素HIF1﹑VEGF﹑Ang/Tie-2体系﹑NHERF1、EC以及eNOS等都有着密切联系,从而综合调控影响了肿瘤血管的新生,但是目前的研究也存在一些问题,PTEN调控因素较多,被影响的这些分子信号相互关系网络复杂,它们是否具有更深层次的关联性尚不十分明确,有待更深入研究。本文通过对于近年来PTEN与肿瘤血管生成关系较全面的综述,PTEN很可能成为治疗靶点,应用于研究肿瘤抗血管生成机制以及抗肿瘤血管生成相关药物的研发中,为癌症的治疗提供一个新的可行途径。
[1]刘伦华,楼丽广.PTEN功能调节的研究进展[J].中国药理学通报,2005,21(7):778-81.
[1]Liu L H,Lou L G.Recent advance in the regulation of PTEN’s function[J].Chin Pharmacol Bull,2005,21(7):778-81.
[2]Wang X,Jiang X.Post-translational regulation of PTEN[J].Oncogene,2008,27(41):5454-63.
[3]Meng F,Henson R.Wehbe-Janek H.MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J].Gastroenterol,2007,133(2):647-58.
[4]许成芳,李小毛,李 田,等.紫杉醇对PTEN不同状态的子宫内膜癌细胞株的作用及其机制探讨[J].中国药理学通报,2011,27(11):1528-32.
[4]Xu C F,Li X M,Li T,et al.The effect of taxol on endometrial cancer cells with different PTEN status[J].Chin Pharmacol Bull,2011,27(11):1528-32
[5]Maehama T,Taylor G S.Dixon J E.PTEN and myotubularin:novel phosphoinositide phosphatases[J].Annual Review of Biochemistry,2001,70:247-79 .
[6]Sonveaux P,Copetti T,De Saedeleer C J,et al.Targeting the lactate transporter MCT1 in endothelial cells inhibits lactate-induced HIF-1 activation and tumor angiogenesis[J].PLoS One,2012,7(3):e33418.
[7]Von Teichman A,Comperat E,Behnke S,et al.VHL mutations and dysregulation of pVHL-and PTEN-controlled pathways in multilocular cystic renal cell carcinoma[J].Modern Pathol,2010,24(4):571-8.
[8]Frew I J,Thoma C R,Georgiev S,et al.pVHL and PTEN tumour suppressor proteins cooperatively suppress kidney cyst formation[J].EMBO J,2008,27(12):1747-57.
[9]Takei Y,Saga Y,Mizukami H,et al.Overexpression of PTEN in ovarian cancer cells suppresses i.p.dissemination and extends survival in mice[J].Mol Cancer Ther,2008,7(3):704- 11.
[10]Zheng H,Takahashi H,Murai Y,et al.Expressions of MMP-2,MMP-9 and VEGF are closely linked to growth,invasion,metastasis and angiogenesis of gastric carcinoma[J].Anti Res,2007,26(5):3579-83.
[11]Sekuklu S D,Donoghue T A,Spillane C.miR-21 as a key regulator of oncogenic processes[J].Biochemical Society Transactions,2009,37(4):918-25.
[12]Fang J,Ding M,Yang L,et al.PI3K/PTEN/AKT signaling regulates prostate tumor angiogenesis[J].Cellular Signalling,2007,19(12):2487-97.
[13]Tian T,Nan K J,S.Wang S H,et al.PTEN regulates angiogenesis and VEGF expression through phosphatasedependent and-independent mechanisms in HepG2 cells[J].Carcinogenesis,2010,31(7):1211-9.
[14]Wu X,Liu N.The role of Ang/Tie signaling in lymphangiogenesis[J].Lymphol,2010,43(2):59-72.
[15]Huang J,Bae J,Tsai J P.Angiopoietin-1/tie-2 activation contributes to cascular survival and tumor growth during VEGF blockade[J].Int J Oncol,2009,34(1):79-87.
[16]DeBusk L M,Hallahan D E,Lin P C.Akt is a major angiogenic mediator downstream of the Ang1/Tie2 signaling pathway[J].Exp Cell Res,2004,298(1):167-77.
[17]Findley C M,Cudmore M J,Ahmed A,et al.VEGF induces Tie2 shedding via a phosphoinositide 3-kinase/Akt-dependent pathway to modulate Tie2 signaling[J].Arterioscler Thromb Vasc Biol,2007,27(12):2619-26.
[18]Theisen C S,Wahl J K 3rd,Johnson K R,et al.NHERF lnks the N-Cadherin/Catenin complex to the platelet-derived growth factor receptor to modulate the actin cytoskeleton and regulate cell motility[J].Mol Biol Cell,2007,18(4):1220-32.
[19]Vazquez F,Devreotes P.Regulation of PTEN function as a PIP3 gatekeeper through membrane interaction[J].Cell Cycle,2007,5(14):1523-7.
[20]Molina J R,Morales F C,Hayashi Y,et al.Loss of PTEN binding adapter protein NHERF1 from plasma membrane in glioblastoma contributes to PTEN inactivation[J].Cancer Res,2010,70(17):6697-703.
[21]Takahashi Y,Morales F C,Kreimann E L,et al.PTEN tumor suppressor associates with NHERF proteins to attenuate PDGF receptor signaling[J].EMBO J,2007,25(4):910 –920.
[22]Vivanco I,Rohle D,Versele M,et al.The phosphatase and tensin homolog regulates epidermal growth factor receptor(EGFR)inhibitor response by targeting EGFR for degradation[J].Proc National Acad Sci United States Am,2010,107(14):6459-64.
[23]Trimboli A J,Cantemir-Stone C J,Li F,et al.Pten in stromal broblasts suppresses mammary epithelial tumours[J].Nature,2009,461(7267):1084-91.
[24]Tarnawski A S,Pai R,Tanigawa T,et al.PTEN silencing reverses aging-related impairment of angiogenesis in microvascular endothelial cells[J].Biochem Biophys Res Commun,2010,394(2):291-6.
[25]Fukumura D,Kashiwagi S,Jain R K.The role of nitric oxde in tumor progression[J].Nat Rev Cancer,2006,6(6):521-34.
[26]Beleslin-Cokic B B,Cokic V P,Yu X,et al.Erythropoietin and hypoxia stimulate erythropoietin receptor and nitric oxide production by endothelial cells[J].Blood,2004,104(7):2073-80.
[27]Lim K H,Ancrile B B,Kashatus D F,et al.Tumor maintenance is mediated by eNOS[J].Natue,2008,452(7187):646-9.
[28]Church J E,Qian J,Kumar S,et al.Inhibition of endothelial nitric oxide synthase by the lipid phosphatase PTEN[J].Vascular Pharmacol,2010,525(6):191-8.
[29]Alessi P,Leali D,Camozzi M,et al.Anti-FGF2 approaches as a strategy to compensate resistance to anti-VEGF therapy:long-pentraxin3 as a novel antiangiogenic FGF2-antagonist[J].European Cytokine Network,2009,20(4):225-34.
[30]Shi Y H,Bingle L,Gong L H,et al.Basic FGF augments hypoxia induced HIF-1-alpha expression and VEGF release in T47D breast cancer cells[J].Pathol,2007,39(4):396-400.
[31]Martinelli E,Troiani T,Morgillo F,et al.Synergistic anti-tumor activity of sorafenib in combination with epidermal growth factor receptor inhibitors in colorectal and lung cancer cells[J].Clin Cancer Res,2010,16(20):4990-5001.
[32]Cohen E E,Davis D W,Karrison T G,et al.Erlotinib and bevacizumab in patients with recurrent or metastatic squamous-cell carcinoma of the head and neck:a phase Ⅰ/Ⅱ study[J].The Lancet Oncol,2009,10(3):247-57.
[33]Engelman J A.Targeting PI3K signalling in cancer:opportunities,challenges and limitations[J].Nature Rev Cancer,2009,9(8):550-62.
[34]Marone R,Cmiljanovic V,Giese B,et al.Targeting phosphoinositide 3-kinase—moving towardstherapy[J].Biochim Biophys Acta,2008,1784(1):159-85.
[35]Anai S,Goodison S,Shiverick K,et al.Combination of PTEN gene therapy and radiation inhibits the growth of human prostate cancer xenografts[J].Human Gene Therapy,2006,17(10):975-84.