大麻素受体在肝星状细胞活化中的作用及姜黄素干预效应
2013-12-07张自力王妤清倪雯霞孔德松郑仕中
张自力,张 涉,郭 瑶,王妤清,倪雯霞,张 衍,孔德松,郑仕中,3
(南京中医药大学1.药学院、2.中药学一级学科;3.江苏省中药药效与安全性评价重点实验室,江苏南京 210023)
肝纤维化(hepatic Fibrosis,HF)是继发于各种形式慢性肝损伤之后组织修复过程中的代偿反应,也是慢性肝病发展为肝硬化必经的病理过程。肝纤维化发生时肝星状细胞(hepatic stellate cells,HSCs)异常活化增殖,并合成与分泌大量的细胞外基质(extracellular matrix,ECM),最终导致ECM的过度沉积[1-2]。抑制 HSCs增殖、促进其凋亡已然成为当前抗肝纤维化治疗的主要策略[3-4]。
内源性大麻素及其受体—大麻素受体1(cannabinoid receptor type 1,CBR1)和大麻素受体2(cannabinoid receptor type 2,CBR2)共同构成了内源性大麻素系统。最近的研究表明内源性大麻素系统参与急性与慢性肝病以及如肝性脑病等引起的并发症改善与恢复过程,并被认为可能是抗肝纤维化的潜在治疗靶点[5-6]。姜黄素(Curcumin)是姜黄属(Curcuma L.)植物姜黄、莪术、郁金等的根茎中提取的一种天然活性成分,用于疾病的治疗已经有悠久的历史。随着研究的深入,姜黄素治疗肝纤维化及其作用机制的研究已成为国内外研究的热点[7]。那么大麻素受体在姜黄素治疗肝纤维化的过程中扮演何种角色,目前尚未见诸报端,我们对其进行了深入的探讨。
1 材料与方法
1.1 主要试剂与仪器 SPF级♂ SD大鼠若干只(上海斯莱克公司,SCXK(沪)2011-0005),姜黄素(SIGMA,No.045K0933,含量≧99.8%),DMEM 培养基(Gibco),小牛血清(Gibico),BCA试剂盒(Pierce),MTT(Promega),一抗 MAPK(ERK,p-ERK,JNK,p-JNK,p38,p-p38,Cell Signaling),CBR1和 CBR2(Bioword),α1(I)collagen和 Fibronectin(Epitomics),β-actin(Sigma);FITC 绿色荧光二抗(武汉博士德)。恒温水浴槽(成都仪器厂,型号HSS-1B),恒流泵(上海青浦沪西仪器厂,型号HL-2),全自动高压灭菌锅(SANYO,型号 MLS-3020),莱卡倒置荧光显微镜 (德国莱卡公司,型号DM1L),超低温冰箱(美国纽艾尔公司,型号Nu-6511),CO2细胞培养箱(FORMA,型号3111),纯水仪(Spring,型号 S/N020579),核酸蛋白分析仪(BECKMAN,型号DU640),电泳槽(Bio-Rad,型号525BR027843)。
1.2 原代大鼠HSCs的分离与培养 按照改良的原代酶消化循环灌流法[8],Nycodenze密度梯度离心分离提取大鼠原代HSCs,将分离的HSCs进行通过使用DMEM重悬的方法进行简单的分离、纯化,然后采用含20%胎牛血清的低糖DMEM培养基培养所得的原代细胞,传代4~8代用于实验。细胞分为实验组与空白对照组,实验组加入相应的药物与刺激物,空白对照则加入DMEM做为阴性对照。实验过程中对动物的处置经过南京中医药大学动物伦理委员会的审批且符合科技部有关善待实验动物的规定。
1.3 MTT检测 传代的HSCs调整细胞悬液浓度后接种于96孔板,每孔 180 μl,1×104个/孔。置37℃、5%CO2恒温箱培养,待细胞贴壁后除对照组外各组分别加入相应浓度的CBR1与CBR2激动剂与拮抗剂进行干预处理24 h,每组6个复孔。作用时间结束后加入5μg·L-1MTT 溶液 20 μl,继续培养4 h。移除上清,每孔加入200 μl DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的OD值。评价药物对细胞的增殖抑制作用。
1.4 Western blot检测 HSCs经药物干预处理后,用冰冷的RIPA裂解缓冲液进行细胞裂解,收集细胞裂解物,-80℃储藏过夜。蛋白混合液融化,于4 ℃、12 000 r·min-1下离心15 min,吸取上清 BCA法测定蛋白浓度。蛋白上样量为50 μg,进行12%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,NC转膜,非特异性封闭;加入相应一抗,4℃过夜,加入辣根过氧化物酶标记的二抗进行杂交。加入ECL发光剂1 ml,曝光、显影、定影,灰度扫描以定量。
1.5 细胞免疫荧光分析 将HSCs接种多聚赖氨酸包被载玻片,培养细胞至60% ~80%融合率,药物干预处理24 h后,固定、洗涤、封闭,以兔抗CBR1抗体(1∶200,Bioword),4℃孵育过夜,空白对照以磷酸盐缓冲溶液(phosphate buffered saline,PBS)孵育过夜。PBS洗3遍,以羊抗兔(1∶60,武汉博士德)FITC标记的荧光二抗孵育1 h,PBS洗3遍后,进行Hochest染色以标记细胞核。荧光封片剂封片,荧光显微镜观察、拍照。
2 结果
2.1 CBR1、CBR2受体激动剂与拮抗剂对 HSCs增殖活性的影响 应用MTT实验探讨CBR1激动剂(NADA)与拮抗剂(AM251),CBR2激动剂(JWH015)与拮抗剂(AM630)的对HSCs增殖的作用效果。结果表明激动CBR1可促进HSCs的增殖,相反拮抗CBR1后则可以抑制HSCs的增殖(P<0.05)。同时激动CBR2也可抑制HSCs的增殖(P<0.05),但抑制CBR2时对HSCs的增殖就没有明显的影响(P>0.05)(Fig 1)。由此可见大麻素受体在HSCs的增殖活化中具有重要作用。
2.2 CBR1受体拮抗剂对HSCs中MAPK信号通路的影响 CBR1与CBR2在HSCs中都有表达,但CBR1在HSCs活化与增殖中起主要调控作用,而CBR2主要分布在免疫细胞中[9]。因此,我们应用CBR1拮抗剂AM251作用于HSCs,观察其对HSCs中MAPK信号通路的影响。结果表明,CBR1拮抗剂能够明显抑制ERK与JNK的磷酸化,并呈剂量依赖性的关系(P<0.05),但对P38蛋白的表达没有什么影响(P>0.05)。
2.3 姜黄素对CBR1与CBR2蛋白表达的影响我们的前期研究证实姜黄素在体内外对肝纤维化具有明显的治疗效果,可上调HSCs中的PPARγ,抑制TGF-β信号通路[10]。本次实验我们又通过Western bolt与细胞免疫荧光检测了姜黄素对HSCs中两种类型大麻素受体CBR1与CBR2蛋白表达的影响,结果表明姜黄素可抑制HSCs中CBR1的表达(P<0.05),但对CBR2的蛋白表达没有明显的影响(P>0.05)。
2.4 姜黄素对CBR1激动剂与拮抗剂的刺激下HSCs表达ECM成分α1(I)collagen和Fibronectin的影响 为进一步研究大麻素受体信号通路在姜黄素抑制HSCs活化增殖中的作用。我们分别加入CBR1的激动剂NADA与拮抗剂AM251,观察姜黄素对HSCs表达ECM成分α1(I)collagen和Fibronectin的影响。结果表明姜黄素可呈剂量依赖性的抑制CBR1激动剂导致的ECM成分表达的上升,并可协同CBR1拮抗剂抑制HSCs表达ECM成分的作用(P<0.05,P<0.01)。
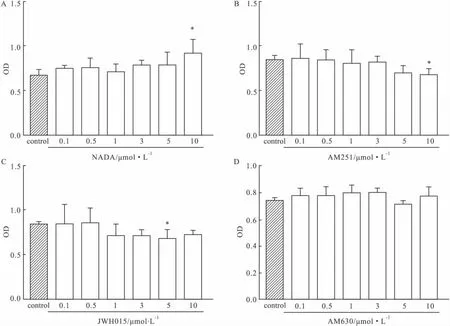
Fig 1 Cell proliferation detection
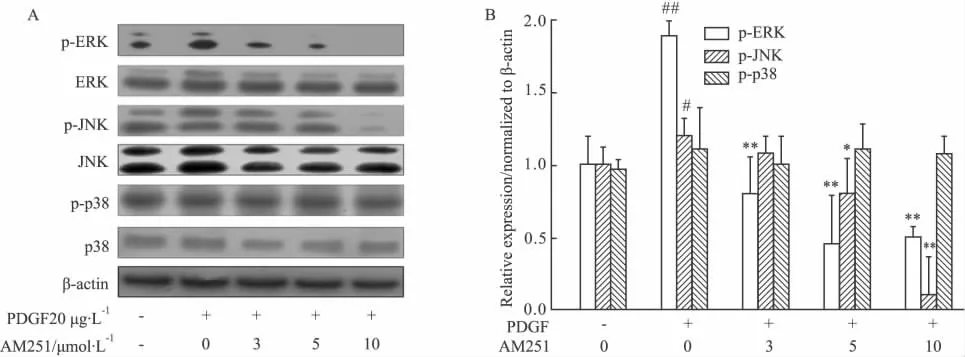
Fig 2Inhibitory effects of CBR1 antagonist AM251 on MAPK pathway in HSCs(±s)
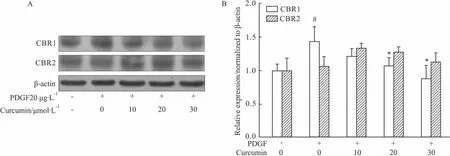
Fig 3Influence of curcumin on CBR1 and CBR2 protein expression(±s)

Fig 4 Effect of curcumin on protein expression of CBR1 by the fluorescence microscope
3 讨论
我国是肝病大国,肝纤维化已经成为影响人们身体健康的重大疾病。多年来学者们一直致力于寻找安全、有效的抗肝纤维化的药物。已有研究证实姜黄素具有确切的预防和治疗纤维化的作用,可明显减轻多种损伤因子导致的肝脏损伤,并能明显改善四氯化碳(CCl4)所致大鼠纤维化的病理学改变[7,11]。进一步加强姜黄素对参与HSCs活化信号通路调控及ECM沉积干预机制的研究,对于阐明肝纤维化发病机制及开发新型、有效抗肝纤维化药物至关重要。
以往对内源性大麻素系统的研究主要集中在神经系统和免疫系统,但近年来研究发现内源性大麻素及其相应的受体在肝纤维化的发生发展中也起一定作用。动物实验研究发现,CCl4或酒精诱导的肝纤维化动物模型中,给予CBR2受体拮抗剂可以使肝纤维化的发生发展速度加快,纤维化程度明显加重,而激活CBR2受体可以有效抑制肝纤维化的发生发展[12]。对CBR1受体研究发现,激活CBR1受体可以促进肝纤维化发展,给予CBR1受体拮抗剂(例如:SR141716A)可以减轻肝脏急性损伤时肝组织损伤修复反应,抑制肝纤维化的发展进程,给予CBR1基因敲除小鼠CCl4或酒精诱导肝纤维化,CBR1基因敲除小鼠肝脏纤维化发生发展较正常组小鼠的速度明显减慢,其纤维化程度也较正常组的减轻[6]。我们的研究发现体外激动或者拮抗HSCs大麻素受体,则同样能够获得与体内实验相同的结果。这表明大麻素受体信号通路在肝纤维化的发生与发展过程的确实具有重要的作用。

Fig 5 Curcumin inhibited the expression of ECM components in HSCs stimulated by CBR1 agonist NADA(±s)
在肝纤维化发生时大麻素受体可能参与HSCs中的MAPK信号通路的调控[13-14]。在本研究中我们发现 CBR1的拮抗剂 AM251可抑制 HSCs中ERK、JNK的磷酸化水平。应用姜黄素干预HSCs时,会导致CBR1表达降低。进一步应用大麻素受体激动剂与拮抗剂分别进行干预处理并观察姜黄素对HSCs表达ECM成分的影响,姜黄素不仅能剂量依赖性的抑制CBR1激动剂导致的ECM成分表达的上升,并可协同 CBR1拮抗剂抑制HSCs表达ECM成分的作用。结果表明姜黄素抑制肝星状细胞活化与增殖的作用部分依赖于对大麻素受体信号通路的干预作用。我们的研究证实了大麻素受体在姜黄素抑制HSCs增殖、活化中的重要作用。本研究为肝纤维化的研究及治疗提供了新的思路,丰富了中药在治疗肝纤维化方面的机制研究,对推进中药治疗肝纤维化的研究具有重要意义。但本研究同样还有很多未解决的问题,比如:姜黄素是通过何种途径影响大麻素受体表达的?大麻素受体又是怎样影响ECM合成的等等,还需要进一步的深入研究。
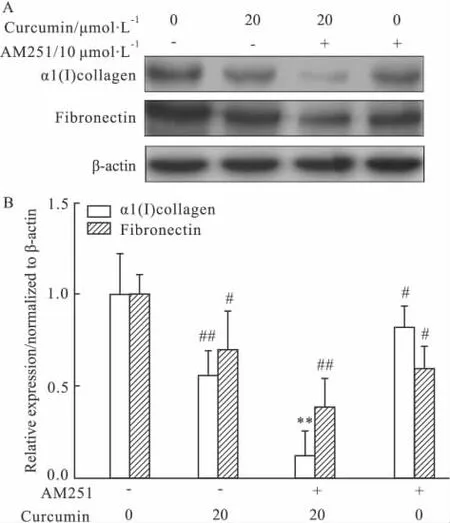
Fig 6 HSCs were treated with DMEM,or,curcumin and/or AM251 at the indicated concentrations for 24 h(±s)
[1]Pinzani M.Foreword to liver fibrosis[J].Best Pract Res Clin Gastroenterol,2011,25(2):193-4.
[2]Friedman S L.Mechanisms of hepatic fibrogenesis[J].Gastroenterology,2008,134(6):1655-69.
[3]Anthony B,Allen J T,Li Y S,McManus D P.Hepatic stellate cells and parasite-induced liver fibrosis [J].Parasi Vectors,2010,3(1):60.
[4]张 怡,平 洁,汪 晖.肝星状细胞凋亡信号途径及其药物治疗的研究进展[J].中国药理学通报,2009,25(1):16-8.
[4]Zhang Y,Ping J,Wang H.The research progress of hepatic stellate cell’s apoptosis signaling pathway and the relative drugs[J].Chin Pharmacol Bull,2009,25(1):16-8.
[5]Julien B,Grenard P,Teixeira-Clerc F,et al.Antifibrogenic role of the cannabinoid receptor CB2 in the liver[J].Gastroenterology,2005,128(3):742-55.
[6]Teixeira-Clerc F,Julien B,Grenard P,et al.CB1 cannabinoid receptor antagonism:a new strategy for the treatment of liver fibrosis[J].Nat Med,2006,12(6):671-6.
[7]何 航,华海婴,戈士文,等.姜黄素对四氯化碳诱导大鼠肝纤维化的影响[J].郑州大学学报(医学版),2009,44(5):986-90.
[7]He H,Hua H Y,Ge S W,et al.Effect of curcumin on rathepatic fibrosis induced by carbon tetrachoride[J].J Zhengzhou Univ(Med Sci),2009,44(5):986-90.
[8]丁 芹,顾 琳,马会慧,等.SD大鼠肝脏星状细胞分离培养及方法的改进[J].实用医学杂志,2007,23(18):2830-2.
[8]Ding Q,Gu L,Ma H H,et al.Improvement in isolation and culture of SD rat heptic stellate cells[J].J Pract Med,2007,23(18):2830-2.
[9]Siegmund S V,Schwabe R F.Endocannabinoids and Liver Disease.Ⅱ.Endocannabinoids in the pathogenesis and treatment of liver brosis[J].Am J Physiol Gastrointest Liver Physiol,2008,294(2):G357-62.
[10]Zheng S,Chen A.Activation of PPARgamma is required for curcumin to induce apoptosis and to inhibit the expression of ECM genes in hepatic stellate cellsin vitro[J].Biochem J,2004,384(Pt1):149-57.
[11]陈 华,薛常镐,陈铁辉,等.姜黄及姜黄素对微囊藻粗毒素致急性肝损伤的化学预防作用[J].中国药理学通报,2005,21(12):1517-9.
[11]Chen H,Xue C G,Chen T H,et al.Chemopreventive effect of curcuma and curcumin on liver injury induced by microcystins in mice[J].Chin Pharmacol Bull,2005,21(12):1517-9.
[12]Cudaback E,Marrs W,Moeller T,et al.The expression level of CB1 and CB2 receptors determines their efficacy at inducing apoptosis in astrocytomas[J].PLoS One,2010,5(1):e8702.
[13]杨 莉,赵连英,刘彦超,等.大麻素受体1和细胞外信号调节激酶在肝纤维化小鼠肝组织中的表达及意义[J].临床肝胆病杂志,2012,28(9):681-4.
[13]Yang L,Zhao L Y,Liu Y C,et al.CB1 and ERK gene expression in liver tissue of rats with experimental hepatic fibrosis[J].J Clinical Hepatol,2012,28(9):681-4.
[14]Lotersztajn S,Julien B,Teixeira-Clerc F,et al.Hepatic fibrosis:molecular mechanisms and drug targets[J].AnnuRev Pharmaco l Toxicol,2005,45:605-28.