紫薯色素的微波提取及其稳定性和抗氧化活性的研究
2013-12-06杨恒拓葛亚龙田光辉
余 凡,杨恒拓,葛亚龙,田光辉
(陕西理工学院化学与环境科学学院,陕西汉中723000)
紫薯(Solanum tuberodsum L.)俗称紫山芋、黑薯,薯肉呈紫色至深紫色,煮熟后肉味紫黑色,故又叫“紫黑薯”,现已经在国内广泛种植,有良好的经济效益,在国内外市场上十分走俏,应用和发展前景广阔。紫薯中营养成分丰富多样[1-2],含有淀粉、蛋白质、粗脂肪、多糖[3]、膳食纤维素,还含有多种维生素、胡萝卜素、色素[4]、绿原酸以及钙、磷、铁等微量元素[5]。紫薯色素是一种从紫薯中提取的水溶性紫红色素[6],在紫薯的块根、茎、叶和薯皮含量都较高,属于天然花青类色素,该类色素清除自由基的能力是维生素C的20倍、维生素E的50倍,还具有强耐热性和耐光性,稳定性好,抗突变性强,对动物的肝功能阻碍具有缓解作用[6],是广泛应用的功能性食品添加剂和保健食品的好原料。紫薯花青素分子结构中含有多个酚羟基,生物活性显著,也已将紫薯色素应用于化妆品和纺织品染织中,由于天然色素安全可靠用途广泛,且种类繁多,不少天然色素兼有营养和药理作用,具有非常广阔的开发应用前景[7]。目前提取紫薯色素已有微波或超声等方法的研究报道,但对紫薯色素的稳定性和抗氧化性的研究还尚少。本研究采用微波辅助提取紫薯色素,可以大幅度地提高紫薯色素的溶出率,简化提取操作步骤,节约溶剂,缩短生产周期,通过单因素实验和正交实验,确定紫薯色素最佳提取工艺,使紫薯中色素提取达到一个较高水平。对紫薯色素在常见氧化剂、还原剂、食品添加剂以及一些金属离子等存在下测试其稳定性,并进行了体外抗氧化实验,探讨其清除羟自由基·OH的能力,为紫薯色素天然色素的工业化提取及规模化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
紫薯 收集于秦巴山区优质种植地基,漂洗干净,研碎,避光低温密封备用;柠檬酸、葡萄糖、蔗糖、氯化钠、甲酸钠、无水乙醇、双氧水、亚硫酸钠、明矾、维生素C、FeSO4·7H2O、Fe2(SO4)3、CuSO4·5H2O、CaCl2、Na2SO4、MgSO4、K2SO4、ZnSO4·7H2O、MnSO4·H2O、邻二氮菲等试剂 均为国产分析纯,西安试剂厂;水 为超纯水。
UWave-1000型微波反应仪 上海新仪微波化学科技有限公司;UV-6300PC型紫外可见分光光度计
上海美谱达仪器有限公司;DOB-2003型光电分析天平 重庆实验设备厂;PHS-3C型数字显示酸度计 上海精密科学仪器有限公司雷磁厂;SHB-III型循环水式多用真空泵 郑州长城科工贸有限公司;101型电热鼓风干燥箱 北京科伟永兴仪器有限公司;HH-系列恒温水浴锅 河北省黄骅市渤海电器厂;800型离心机 上海磁极器材厂;LRH-250A型生化培养箱 广东省医疗器械厂。
1.2 实验方法
1.2.1 紫薯色素的提取 将紫薯洗净,切成小块在研钵中研碎,然后用电子天平准确称取1.5g,加入一定浓度的柠檬酸提取液,微波提取一定的时间,抽滤,再重复提一次,合并滤液并定容,在450nm处测其吸光度。
1.2.2 紫薯色素最大吸收峰的确定 用电子天平准确称取1.5g研碎的紫薯,加入15mL 5%的柠檬酸溶液,微波提取额15min,抽滤,滤渣再重复提取一次,再次抽滤,合并滤液并定容在50mL的容量瓶中,取15mL溶液稀释至100mL。然后取一定量的溶液放入1cm的比色皿中,在波长为300.00~700.00nm范围内进行扫描,测定吸光度,筛选最大吸收波长。
1.2.3 单因素实验
1.2.3.1 微波温度对紫薯色素提取的影响 在微波功率为100W、提取时间为15min、柠檬酸浓度为5%、料液比为1∶10的条件下,温度依次为10、20、30、40、50、60℃下提取,测定其在最大吸收波长处的吸光度。
1.2.3.2 时间的影响 在微波功率为100W、温度为30℃、柠檬酸浓度为5%、料液比为1∶10的条件下,时间将依次为3、6、9、12、15、18min下提取,测定其在最大吸收波长处的吸光度。
1.2.3.3 柠檬酸浓度对紫薯色素提取的影响 在微波功率为100W、温度为30℃、时间为15min、料液比为1∶10的条件下,柠檬酸浓度将依次为0.5%、1%、5%、10%、15%下提取,测定其在最大吸收波长处的吸光度。
1.2.3.4 微波功率对紫薯色素提取的影响 在温度为30℃、柠檬酸浓度为5%、料液比为1∶10、时间为15min的条件下,微波功率为25、50、75、100、125W下提取,测定其在最大吸收波长处的吸光度。
1.2.3.5 料液比对紫薯色素提取的影响 在微波功率为75W、温度为30℃、柠檬酸浓度为5%、时间为15min的条件下,料液比依次为1∶5、1∶10、1∶15、1∶20、1∶25下提取,测定其在最大吸收波长处的吸光度。
1.2.4 正交实验的设计 在单因素实验中选取温度、时间、料液比、柠檬酸浓度4个影响较大的因素对紫薯色素提取率的影响进行考察,设计四因素三水平L9(34)的正交实验,寻求最佳提取工艺条件,正交实验设计如表1所示。

表1 正交实验因素表Table 1 Factor level of orthogonal design
1.2.5 紫薯色素的稳定性 选取正交实验中温度、时间、柠檬酸浓度、料液比的最优结果,进行提取,用50%的乙醇提取一定量的紫薯色素溶液,稀释至所需浓度备用。色素稳定性(用加入其他溶液后其溶液中色素保留率表示)的计算:色素保留率(%)=加其他溶液以后的吸光度/加蒸馏水的吸光度×100。
1.2.5.1 温度对紫薯色素稳定性的影响 取3mL紫薯色素溶液,加入7mL蒸馏水,分别在室温(25℃)、35、45、55、65、75℃下放置2h,测定其在450nm处的吸光度,并计算色素保留率。
1.2.5.2 食品添加剂对紫薯色素稳定性的影响 取3mL紫薯色素提取液,分别加入7mL 0.001、0.002、0.003mol/L的食盐、柠檬酸、葡萄糖、蔗糖、乙酸钠和VC溶液,另取一支加7mL蒸馏水,室温下放置12h,分别测定其在450nm处的吸光度,计算色素保留率。
1.2.5.3 常见的饮料对紫薯色素稳定性的影响 取3mL紫薯色素提取液,分别加入7mL碳酸饮料、苏打水、矿泉水(均无色),另取一支加7mL蒸馏水室温下放置12h,分别测定其在450nm处的吸光度,计算色素保留率。
1.2.5.4 不同pH对紫薯色素稳定性的影响 取3mL紫薯色素提取液,分别加入7mL pH为3、4、5、6、7、8、9、10、11的溶液,另取一支加7mL蒸馏水,室温下放置4h,分别测定其在450nm处的吸光度,计算色素保留率。
1.2.5.5 氧化剂和还原剂对紫薯色素稳定性的影响 取3mL紫薯色素提取液,分别加入7mL浓度为1%、2%、3%的H2O2,浓度为1%、2%、3%的Na2SO3溶液,另取一支加7mL蒸馏水,室温下放置4h,分别测定其在450nm处的吸光度,计算色素保留率。
1.2.5.6 常见的金属离子对紫薯色素稳定性的影响 取3mL紫薯色素提取液,分别加入7mL 0.001、0.002、0.003mol/L的只含有Mg2+、Na+、K+、Ca2+、Al3+、Cu2+、Mn2+、Zn2+、Fe3+和Fe2+的溶液,另取一支加7mL蒸馏水,室温下放置12h,分别测定其在450nm处的吸光度,计算色素保留率。
1.2.6 体外清除·OH作用的实验 体外抗氧化活性实验采用H2O2/Fe2+体系法[8-9]。将紫薯色素配成浓度为1.54mg/L的乙醇溶液,取8支试管分别加入0.75mmol/L邻二氮菲溶液1mL、200mmol/L pH为7.4的PBS(Phosphate Buffered Saline混合磷酸盐缓冲剂)1.5mL,充分混匀后再加入0.75mmol/L FeSO41mL立即混匀,然后向8支试管分别加入不同梯度的紫薯色素溶液,混匀,最后向其中加入0.01%的H2O21mL,摇匀。另2支分别为损伤管和未损伤管,这两支试管不加紫薯色素溶液,除0.01%的H2O2外依次加入与前面8只试管中等量的不同溶液,最后在损伤管中加入0.01%的H2O21mL,未损伤管不加H2O2,对10支试管都以二次蒸馏水补充到相同的体积,将10支试管置于生化培养箱中,在37℃保温1h,测A510值。重复三次取平均值。对·OH清除率计算公式为:
·OH清除率(%)=(A2-A1)/(A0-A1)×100
式中,A0为未损伤管吸光度;A1为损伤管吸光度;A2为加入紫薯色素溶液的吸光度。
2 结果与讨论
2.1 紫薯色素最大吸收峰的确定
以紫薯色素吸收的波长为横坐标,以不同波长下的吸光度为纵坐标,在不同波长下的吸光度如图1所示,紫薯色素光谱吸收曲线图,紫薯色素最大吸收峰长为450nm。
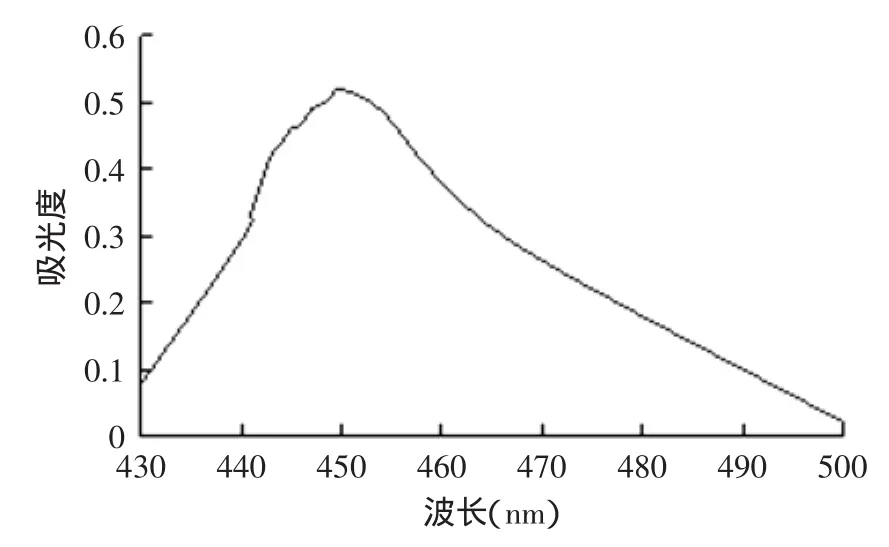
图1 紫薯色素的光谱吸收图Fig.1 Purple sweet potato pigment spectral absorption in Figure
2.2 单因素实验
2.2.1 温度对紫薯色素提取的影响 如图2所示,表明紫薯色素在10~30℃时提取率(用吸光度表示,下文同)随温度升高而增大,在30℃时,紫薯色素的提取率最大,超过30℃提取率会随温度升高而降低,可能是由于微波温度过高将紫薯色素破坏了。所以从经济及提取率角度考虑,30℃的提取温度最佳。
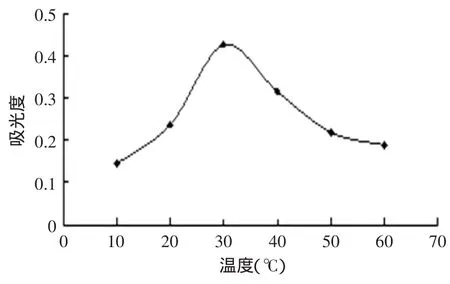
图2 不同温度对紫薯色素的提取的影响Fig.2 The impact of different temperatures on the extraction of the pigment of the purple sweet potato
2.2.2 时间对紫薯色素提取的影响 如图3所示,微波时间对紫薯色素提取率随时间增大;在15min时,紫薯色素提取率达到最大;超过15min增幅不明显,18min时开始有小幅度的下降,可能原因是搅拌的时间过长,将紫薯色素中一些易碎物搅碎了。综合经济考虑,紫薯色素的最佳提取时间为15min。

图3 不同时间对紫薯色素的提取的影响Fig.3 Different time on the extraction of the pigment of the purple sweet potato
2.2.3 柠檬酸浓度对紫薯色素提取的影响 如图4所示,在柠檬酸浓度小于5%时,随着柠檬酸浓度的增大,紫薯色素的提取率有显著的提高,柠檬酸浓度为5%时,紫薯色素的提取率最大,但柠檬酸浓度超过5%时基本保持不变,从经济的角度考虑,紫薯色素提取时柠檬酸浓度在5%是最经济实惠的。
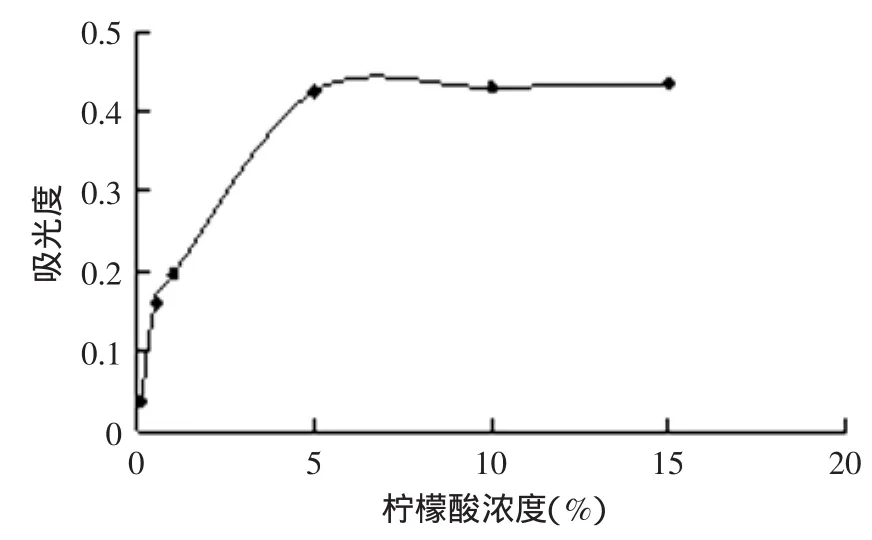
图4 不同的柠檬酸浓度对紫薯色素提取率的影响Fig.4 Different concentrations of citric acid on the purple sweet potato pigment extraction
2.2.4 微波功率对紫薯色素提取的影响 如图5所示,微波功率小于75W时,紫薯色素的提取率随功率的升高而增大,75W时紫薯色素的提取率最大,但当功率超过75W时随着功率的升高紫薯色素的提取率会下降,原因可能微波功率过大会对紫薯色素造成破坏。所以紫薯的最佳微波功率为75W。
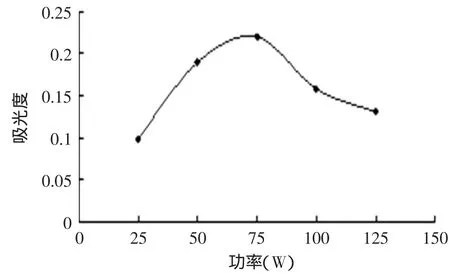
图5 不同的微波功率对紫薯色素提取率的影响Fig.5 Different microwave power on the purple sweet potato pigment extraction
2.2.5 料液比对紫薯色素提取的影响 如图6所示,当料液比在1∶10左右时,紫薯色素提取率基本稳定,超过1∶10基本保持不变,从经济角度考虑,最佳料液比为1∶10。

图6 不同的料液比对紫薯色素提取率的影响Fig.6 The impact of different solid-liquid ratio of purple sweet potato pigment extraction
2.3 紫薯中色素提取的优化
将温度、时间、柠檬酸浓度、料液比四个因素各取三个水平,正交实验结果及分析如表2所示。

表2 正交实验结果与分析Table 2 Results and analysis of orthogonal test
由表2直观分析可知,紫薯色素提取工艺的影响因素次序大小是D>A>C>B,由此可知适当的料液比对提取率的影响很大,其次是温度、柠檬酸浓度、时间;结合各因素k值可知紫薯色素的最佳提取条件是A2B2C3D3,即温度为30℃,时间为15min,柠檬酸浓度为10%,料液比为1∶15,在最优条件下,经验证提取率(以吸光度表示)可高达0.462,均高于表2中其他组合的提取率,比普通浸提高(普通浸提为用蒸馏水室温浸提24h,吸光度为0.225)。
2.4 紫薯稳定性的研究
2.4.1 温度对紫薯色素稳定性的影响 如表3所示,可以看出紫薯色素在65℃以下稳定性较好,但在65℃以上稳定性会显著降低,因此其在保存和使用的过程中应尽量避免高温。

表3 温度对紫薯色素稳定性的影响Table 3 The influence of temperature on pigment stability of the purple sweet potato
2.4.2 食品添加剂对紫薯色素稳定性的影响 如表4所示,紫薯色素在食盐、柠檬酸、葡糖糖、蔗糖、乙酸钠、VC溶液中都较稳定,因此,说明紫薯色素是一种极好的天然食品着色剂。

表4 食品添加剂对紫薯色素稳定性的影响Table 4 The impact of food additives on the stability of the pigment of the purple sweet potato
2.4.3 常见的饮料对紫薯色素稳定性的影响 如表5所示,可以看出常见的苏打水和矿泉水对紫薯色素的稳定性影响很小,但碳酸饮料对其影响有利。

表5 常见的饮料对紫薯色素稳定性的影响Table 5 Common beverages on the stability of the pigment of the purple sweet potato
2.4.4 不同pH对紫薯色素稳定性的影响 如表6所示,紫薯色素在酸性条件下稳定性较好且在酸性条件时随pH的增大稳定性减小,在碱性条件下随pH的增大,稳定性先增大后减小。在实验中还观察到紫薯色素在酸性条件下呈红色,在中性条件下呈紫色,在碱性条件下呈蓝色。

表6 不同pH对紫薯色素稳定性的影响Table 6 The impact of pH on the stability of the pigment of the purple sweet potato
2.4.5 氧化剂和还原剂对紫薯色素稳定性的影响如表7所示,紫薯色素在有氧化剂存在的条件下极不稳定,可能已被氧化成其他物质,在有还原剂存在的条件下较稳定,所以,紫薯色素在使用的过程中应尽量避免与氧化剂一起使用,以防止其稳定性被破坏。

表7 氧化剂和还原剂对紫薯色素稳定性的影响Table 7 Oxidizing and reducing agents on the stability of pigment of the purple sweet potato
2.4.6 常见的金属离子对紫薯色素稳定性的影响如表8所示,紫薯色素在Na+、Ca2+、Al3+的溶液中较稳定,在有K+、Zn2+离子的溶液中会形成一种非沉淀的配合物,在Mg2+、Cu2+、Mn2+、Fe2+、Fe3+的溶液中会生成沉淀,所以在使用时应注意不要和这些离子混用。
2.5 紫薯色素体外清除·OH的作用
按照1.2.6的方法确定紫薯色素对·OH的清除作用,结果如图7所示,结果说明紫薯色素对H2O2/Fe2+体系通过Fenton反应产生的·OH有明显的清除作用,且随着加入量的增加清除率呈上升趋势,清除率和紫薯色素的用量存在一定的量效关系。羟基自由基是造成组织细胞损伤的主要活性氧之一,能引起膜过氧化,蛋白质交联变性,核酸损伤等,许多疾病如肿瘤、炎症、癌症、衰老、动脉硬化等的引发大多数和羟基自由基有关,紫薯色素对·OH有清除作用,是一种待开发且非常具有前景的天然保健色素。
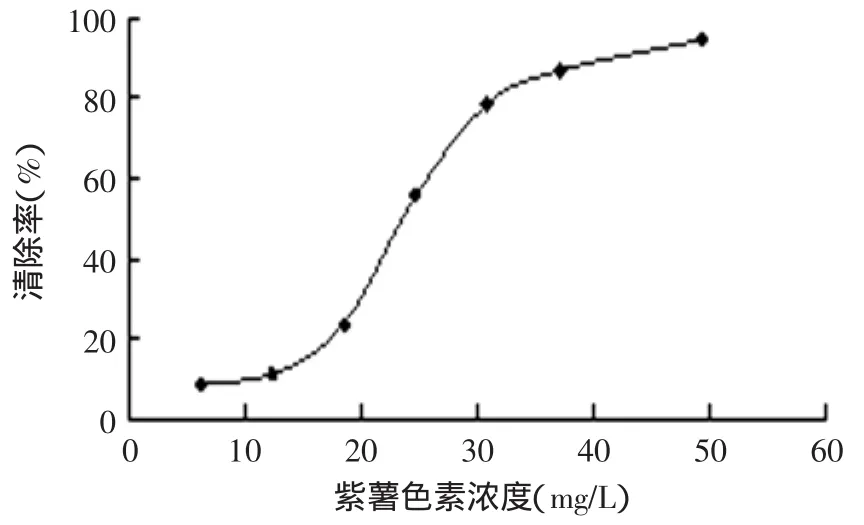
图7 紫薯色素体外清除·OH作用Fig.7 Purple sweet potato pigment to clear the role of·OH in vitro
3 结论
紫薯色素在提取过程中用10%的柠檬酸较好,对环境无危害,温度、柠檬酸浓度、料液比、时间、微波功率对紫薯色素提取率影响较大。紫薯色素的提取温度不宜太高,在常温下最好,也很节能,时间为15min,微波功率为75W时提取效果较好,较为绿色节能。紫薯色素在室温下较稳定,易保存,在一些常见的食品添加剂和常见的饮料中也较稳定,是一种很好的天然食品着色剂,会有很好的市场;在酸性介质中较为稳定,而且呈现出鲜艳的红色,在碱性下也较稳定,颜色会随着介质酸碱性的改变而发生变化;和还原剂共存时也很稳定,但在氧化剂中易被氧化成其他物质;在Mg2+、Cu2+、Mn2+、Fe2+、Fe3+的溶液中会有沉淀生成,所以使用时应避免这些不利的因素。紫薯色素是一种待开发且具有前景的天然保健色素,在保健食品或饮品开发方面具有较大的应用空间,其具体的应用还需要进一步深入探讨。
[1]Alexander A T Johnson,Richard E Veilleux.Integration of transgenesinto sexualpolyploidization schemesforpotato(Solanum tuberodsum L.)[J].Euphytica,2003,133(1):125-138.
[2]K V Boris,N N Ryzhova,E Z Kochieva.Identification and characterization ofintraspecific variability ofthe sucrose synthase gene Sus4 of potato(Solanum tuberodsum) [J].Russian Journal of Genetics,2011,47(2):168-175.
[3]姚惠伶,蒋林彬.超声波提取紫薯多糖的工艺优化[J].安徽农业科学,2011(14):8357-8358.
[4]万莹,杨青,谢鑫,等.膜技术用于紫薯花色苷色素分离纯化的工艺研究[J].中国食品添加剂,2012(2):86-89.
[5]邵兵.火焰原子吸收法测定紫薯中的微量元素[J].中国现代医生,2011(2):81-82.
[6]朱美娟,姚勇芳,韩雪钗,等.紫薯色素的提取及其稳定性的研究[J].安徽农业科学,2009,7(36):17885-17887.
[7]田光辉,雷迎,贺磊,等.云芝紫色素的提取及其稳定性研究[J].食品工业科技,2011(8):343-345.
[8]刘存芳.三种真菌子实体脂溶性成分的研究[J].食品工业科技,2009,30(3):172-174.
[9]刘存芳.秦巴山区5种花挥发性物质抗氧化和抗菌活性研究[J].中国实验方剂学杂志,2011(3):103-107.
