水相组分差异对大豆蛋白-磷脂复合乳化体系的影响
2013-12-06江连洲张雅娜
王 妍,李 杨,江连洲,张雅娜
(东北农业大学食品学院,黑龙江哈尔滨150030)
传统豆制品在加工中易形成乳化体系,其中存在的大豆蛋白与磷脂的交联作用对乳化体系有一定影响。大豆贮藏蛋白主要成分为7S和11S。它们占贮藏蛋白70%左右。7S疏水性氨基酸含量高,11S含硫氨基酸含量高[1]。由于7S球蛋白和11S球蛋白在亚基组成、氨基酸组成等方面均有较大差异,使它们对大豆蛋白的功能特性产生不同的贡献[2]。大豆蛋白作为食品工业中不可或缺的原配料,所具有的各种功能特性不断被发现,其中乳化性是较为重要的一种性质,其原理是利用蛋白质分子结构中的亲水、亲油基,吸附在油-水界面上,形成一层膜,从而阻止油滴的聚集,达到稳定乳化的作用[3]。乳状液的制备需要乳化剂,近年来,人们对乳状液的使用和形成产生很大兴趣。大多数文献研究了乳状液的形成,稳定及其他性质。众所周知,磷脂可以充当乳化剂制备乳状液,Akhtar和Dickinson用卵磷脂充当乳化剂制备复合乳状液[4]。Fang和Dalgleish发现低浓度磷脂可以提高O/W乳状液稳定性[5],近年发现溶液中表面窗体顶端活性剂和不同蛋白质可以相互作用,形成具有不同特性的蛋白质-表面活性剂复合物[6]。Catharina研究发现蛋白质-磷脂交互作用有利于提高牛乳的热稳定性[7]。Annett Knoth研究发现当问含有磷脂的乳状液中加入乳清蛋白时,乳状液的粒径大小和稳定性均有变化[8]。基于大豆蛋白的组成和结构是影响乳化性的一个重要因素,该研究通过分离纯化出大豆分离蛋白及其主要组分7S及11S球蛋白,对不同蛋白与磷脂混合形成复合乳化体系的乳化性及流变性进行测定,从而找出7S、11S对大豆蛋白-磷脂复合乳化体系乳化性的影响。
1 材料与方法
1.1 材料与仪器
脱脂豆粕 哈高科提供;大豆磷脂 深圳康之源生物有限公司;金龙鱼大豆调和油 超市购买;SDS、磷酸盐 均为分析纯。
pH S-25酸度计 上海伟业仪器厂;电子分析天平 梅勒特-托利多仪器(上海)有限公司;T18 basic高速乳化均质机 英国IKA公司;722S分光光度计上海精密科学仪器有限公司;微量取样器 上海荣泰生化工程有限公司;磁力搅拌器、机械搅拌器 广州仪科实验仪器有限公司;流变仪 英国马尔文仪器有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白SPI的提取 采用Molina Ortiz等的方法[9]。脱脂大豆粉→搅拌(料液比1∶20,提取时间2h,25℃)→离心→上清液(2mol/L HCl调至pH4.5在4℃静置2h)→离心20min(2000r/min)→沉淀(复溶于5倍蒸馏水)→冷冻干燥→SPI
1.2.2 7S和11S的提取 7S和11S的提取参考Nagano的实验方法[10]。脱脂豆粉→提取(15倍水,2mol/L NaoH调pH7.5,室温提取1h)→离心(9000×g 20min)→上清液→加NaHSO3,2mol/L HCl调至pH6.4,4℃过夜→离心(6500×g,20min,4℃)→沉淀(11S)
↓
上清液→用NaCl调离子浓度0.25mol/L,2mol/L HCl调至pH5.0,静置1h→离心(9000×g,30min,4℃)→上清液→用水稀释两倍,2mol/L HCl调至pH4.8→离心(6500×g,20min,4℃)→7S
1.2.3 7S/11S的确定 采用不连续十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)方法[11],浓缩胶和分离胶中SDS浓度为0.1%、过硫酸铵浓度为0.075%、四甲基乙二胺(TEMED)浓度为0.075%,聚丙烯酰胺浓度分别为2.5%和10%,浓缩胶中缓冲液浓度为0.125mol/L Tris-HCl(pH6.8),分离胶中缓冲液浓度为0.375mol/L Tris-HCl(pH8.8),贮液槽中缓冲液浓度为0.025mol/L Tris-HCl/0.192mol/L甘氨酸(pH8.3)。用0.0625mol/L Tris-HCl(pH6.8)样品缓冲液(该缓冲液同时含有2%SDS、5%2-巯基乙醇、10%甘油、0.002%溴酚蓝)溶解一定量分离蛋白粉,配成浓度为1mg/mL的溶液。超声波水浴处理45min,在沸水中加热3min。点样量为15μL,稳压电压50V进行电泳。电泳结束后,进行固定、染色、脱色。电泳谱图采用CS910型薄层扫描仪进行扫描后,用ScionImage软件进行处理分析。
1.2.4 大豆基本指标测定 水分及挥发物含量测定[12]:GB/T 5009.3-2003,直接干燥法;灰分含量测定[13]:GB/T 5009.4-2003,灼烧称量法;粗蛋白含量测定[14]:GB/T 5009.5-2003,半微量凯氏定氮法。
1.2.5 乳状液的制备 精确称取1g样品,溶解于100mL 0.1mol/L磷酸钠缓冲溶液中,室温下1000r/min搅拌1h制备蛋白溶液,取0.1g磷脂溶解于大豆油中,室温下1000r/min搅拌1h。取15mL搅拌均匀的蛋白溶液与5mL溶有磷脂的大豆油混合,在高速乳化均质机下13500r/min乳化2min后倒入25mL烧杯中。
1.2.6 乳化性及乳化稳定性的测定 乳化性的测定参考Molina等[15]的实验方法,分别于0、30min时,在烧杯底部取样20μL乳状液与5mL 0.1%的SDS溶液均匀混合,在500nm处测定其吸光值。
式中:T=2.303;N:稀释倍数(250);C:乳化液形成前蛋白质水溶液中蛋白质浓度(g/mL);φ:乳化液中油相体积分数(0.25);A0:0min时吸光值;A30:30min时吸光值。
1.2.7 乳状液黏度的测定 采用Bohlin-CVO流变仪,4/40椎板,测定温度25℃,剪切速率从0.01s-1到100s-1测定表观粘度。
1.2.8 粒径的测定 采用Malvern激光粒度分析仪测定粒度分布,测定温度25℃。
2 结果与讨论
2.1 大豆基本指标测定
按照1.2.4方法测得的大豆基本指标,如表1所示。

表1大豆基本指标Table 1 Basic index of soybean
2.2 凝胶电泳图谱分析
大豆7S、11S球蛋白及SPI凝胶电泳图谱见图1。通过对SDS-PAGE谱图中的谱带进行Scion Image扫描分析,7S的纯度达到78.2%,11S的纯度达到88.7%,SPI中7S和11S比例约为4∶6。

图1 7S、11S球蛋白及SPI电泳图谱Fig.1 SDS-polyacrylamide gel electrophoresis of 7S、11S globulin and SPI fractions
2.3 乳化性及乳化稳定性分析

图2 蛋白-磷脂复合体系的乳化性Fig.2 The EAI of soybean protein-lec complex emulsions
不同蛋白与磷脂交互形成的复合乳化体系乳化性及乳化稳定性见图2和图3。从图中可看出乳化能力:7S>SPI>11S,稳定性:7S>SPI>11S。蛋白与磷脂相互作用形成一种蛋白质-卵磷脂复合物,7S的疏水氨基酸含量高,在它的表面存在大量的疏水区,所以它能较快的吸附在油滴的表面,并且在油滴的表面与磷脂形成一种更稳定的复杂结构。而11S因其内部含有亚基间和亚基内的二硫健,使氨基酸残基重排从而降低了吸附在油滴表面的速度。另外11S带高电荷也是造成吸附延误的原因。因此7S更易与磷脂形成7S-磷脂复合物,导致7S-磷脂复合乳化体系乳化性比11S-磷脂高。有研究证明,7S在任何pH下都比11S有更好的降低表面张力的能力[16],所以复合乳化体系的水相添加7S比11S稳定性也更好。而SPI-磷脂复合乳化体系的乳化性和乳化稳定性是7S和11S共同作用的结果。

图3 蛋白-磷脂复合乳化体系的乳化稳定性Fig.3 The ESI of soybean protein-lec complex emulsions
2.4 黏度分析
通过流变仪测得不同蛋白与磷脂交互形成的复合乳化体系的黏度,见图4。从图4中可看出,7S-磷脂复合乳化体系黏度低于11S-磷脂复合乳化体系。复合体系的粘度有两个主要影响因素,一是连续相的浓度,二是连续相的连续性。通过乳状活性的测定,证实7S更易与磷脂形成一种蛋白质-卵磷脂复杂物,形成的这种结构破坏了连续相的连续性,因此7S与磷脂交互形成的乳状液体系的黏度最低,11S最高,SPI是7S和11S共同作用的结果。另一方面,蛋白质是高分子体系,溶解后具有一定的凝胶性,使得溶液黏度增加。在中性范围内,大豆蛋白11S蛋白含有18~20个双硫键,疏水性基团也多于7S蛋白,酸性亚基和碱性亚基通过双硫桥键连接,分子所形成的空间网状结构比较复杂,也比较牢固,有利于蛋白质的膨胀,使得溶液的黏度也随之增加。
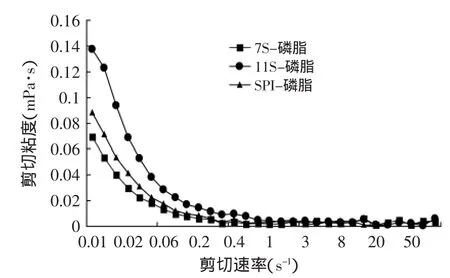
图4 蛋白-磷脂复合乳化体系的流变曲线Fig.4 The flow curves of soybean protein-lec complex emulsions
2.5 粒径分析
由图5可看出,粒径分布曲线都出现双峰现象,双峰的出现表明乳状液的分布不均匀,分散性不是很好,这可能是由于均质不均匀造成的。
水相添加7S形成的乳状液不存在过大的凝聚颗粒,小颗粒液滴的数量较多,乳状液的平均粒径小于11S,可能是磷脂与7S作用后形成的7S-磷脂复合物比与11S作用后形成的11S-磷脂复合物能更好的降低界面张力,而且7S比11S有更好的乳化活性,因此促进小尺寸的液滴形成。而SPI的粒径大小由7S和11S共同决定,从粒径分布曲线可看出其粒径大小处于7S和11S之间。
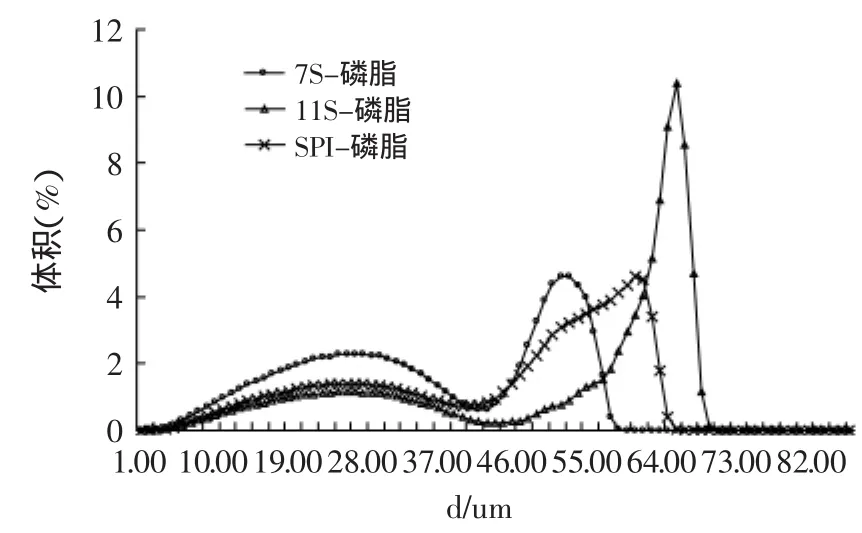
图5 蛋白-磷脂复合乳化体系的粒径分布曲线Fig.5 The particle size distribution of soybean protein-lec complex emulsions
3 结论
用含有磷脂的大豆油当油相,制备乳状液时,水相添加物不同蛋白分子对复合乳化体系的性质影响显著,当水相添加7S时有助于复合乳化体系的形成,形成的液滴粒径较小,黏度较低,形成的复合乳化体系稳定性也比添加11S更好。
[1]孟祥勋.大豆种子贮藏蛋白的研究[J].东北农业大学学报,1997,28(2):201-207.
[2]Fukushima D.Structures of plant storage proteins and their functions[J].Food Reviews International,1991,7(3):353-379.
[3]莫文敏,曾庆孝.蛋白质改性研究进展[J].食品科学,2000,21(6):6-9.
[4]Akhtar M,Dickinson E.Water-in-oil-in-water multiple emulsions stabilized by polymeric and natural emulsifiers[J].Food Colloids,2001,258:133-143.
[5]Fang Y,Dalgleish D G.Casein adsorption on the surfaces of oil-in-water emulsions modified by lecithin[Z].Colloids and Surfaces B:Biointerfaces,1993,1:357-364.
[6]Van Nieuwenhuyzen W,Szuhaj B.Effect of lecithins and proteins on the stability of emulsions[Z].Fett/Lipid,1998,10:282-291.
[7]Catharina H, McCrae.Heat stability of milk emulsions:phospholipid-protein interactions[J].International Dairy Journal,1999,9(3):227-231.
[8]Annett Knoth, Inta Scherze, Gerald Muschiolik.Stability of water-in-oil-emulsions containing phosphatidylcholine-depleted lecithin[Z].Food Hydrocolloids,2005,19:635-640.
[9]Molina Ortiz S E,Puppo M C,Wagner J R.Relationship between structural changes and functional properties of soybean protein isolates-carrageenan systems[J].Food Hydrocolloids,2004,18:1045-1053.
[10]Takao Nagano,Motohiko Hirotsuka,Hiroyuki Mori.Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J].Journal of Agricultural and Food Chemistry,1992,40 (6):941-944.
[11]哈密斯.蛋白质的凝胶电泳实践方法[M].北京:科学出版社,1994.
[12]中华人民共和国卫生部.GB/T 5009.3-2003食品中水分的测定[S].北京:中国标准出版社,2003.
[13]中华人民共和国卫生部.GB/T 5009.4-2003食品中灰分的测定[S].北京:中国标准出版社,2003.
[14]中华人民共和国卫生部.GB/T 5009.5-2003食品中蛋白质的测定[S].北京:中国标准出版社,2003.
[15]Molina E,Papadopoulou A,Ledward D A.Emulsifying properties of high pressuretreated soy protein isolate and 7S and 11S globulins[J].Food Hydrocolloid,2001,15(3):263-269.
[16]Jorge R Wagner,Jacques Gueguen.Surface functional properties of native,acid-treated,and reduced soy glycinin.2.Emulsifying propeties[J].Agric Food Chem,1999,47(6):2181-2187.
