纳豆芽孢杆菌蛋白酶对大豆分离蛋白凝胶性的影响
2013-12-06刘敬媛韩建春谭顺丹
刘敬媛,韩建春,冯 镇,姜 帆,谭顺丹
(东北农业大学食品学院,黑龙江哈尔滨150030)
蛋白质分子经过适度水解,形成有规则的具有凝胶性的空间网状结构,此过程称为凝胶作用[1]。天然大豆蛋白分子是高度压缩折叠的,并具有复杂结构,水解可将其各级结构破坏,一般认为水解时分子中的肽链变短,网状结构消失,溶解性增强,凝胶性减弱。但是1987年,Katsumi第一次提出有些微生物所产的酶制剂可使大豆蛋白酶解后形成凝胶[2]。1999年M.Yasuda报道了从腐乳中分离得到一株名为Bacillus pumilusTYO-67的菌,它可产生能促使大豆蛋白形成凝胶的蛋白酶,并对该微生物蛋白酶进行了分离纯化及性质的研究[3]。2006年前后唐传核等[4-6]对微生物转谷氨酰胺酶进行了深入的研究。由此可见,利用微生物蛋白酶对大豆蛋白进行适度水解,改善其凝胶特性具有很大的研究空间。纳豆芽孢杆菌在发酵过程中可分泌多种胞外酶,包括脂肪酶、淀粉酶、纳豆激酶以及蛋白酶等[7]。对于该菌的研究主要集中于其溶栓保健作用和纳豆激酶的开发等方面。然而,对其他胞外酶的研究鲜见报道,仅有少数学者对胞外蛋白酶的组分及催化特性进行探讨[8]。本实验利用纳豆芽孢杆菌,在优化培养条件的基础上收集其所产生的微生物蛋白酶,催化蛋白质分子间发生交联,产生流变学性质,以提高大豆分离蛋白的凝胶特性,并探究改性大豆蛋白的流变学特性与水解度的关系。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白(SPI) 哈高科食品有限责任公司;纳豆芽孢杆菌 实验室分离保藏菌种。
TGL-16aR型飞鸽高速冷冻离心机 上海安亭科学仪器厂;TU-1810型紫外可见分光光度计 北京普析通用仪器有限责任公司;Gemini II型高级旋转流变仪 英国马尔文公司;DYY-6B型稳压稳流电泳仪 北京市六一仪器厂。
1.2 实验方法
1.2.1 纳豆芽孢杆菌种子活化 在250mL的三角瓶中,加入50mL种子培养液(蔗糖12g/L,蛋白胨10g/L,牛肉膏5g/L,NaCl 5g/L,pH7.0)。灭菌后取1环菌种接入其中,在30℃条件下150r/min的摇床上培养1d。
1.2.2 液态发酵 在500mL三角瓶中装入150mL发酵培养基(豆粕3.0g/L、麦芽糖50 30~40g/L、吐温T80 0.35g/L,pH8.0[9])。灭菌冷却后接种4mL活化的液体种子,置于恒温摇床中于30℃,发酵3d。
1.2.3 蛋白酶的制备 液态发酵完毕后,发酵液在10000r/min、4℃冷冻离心20min,保留上清液。用旋转蒸发仪在50℃将上清液浓缩至一定浓度,既得粗酶液。
1.2.4 酶活的测定 采用重氮四唑酪蛋白(以下简称DHT-酪蛋白)法[10]。
1.2.4.1 DHT-酪蛋白全显色标准曲线的绘制 DHT-酪蛋白溶液0.5mL(含0.5~2.5mg DHT-酪蛋白)中加4mL 0.2mol/L pH8.8的Na2CO3缓冲液,再加0.5mL 0.01%NiSO4·7H2O溶液显色,在540nm处测定吸光值。计算每mg DHT-酪蛋白的显色值。此值与DHT-酪蛋白酶经酶全水解后用镍锌试剂显色值基本相同。
1.2.4.2 酶活力的测定 2mL l%DHT-酪蛋白、0.2mL EDTA和0.6mL水,40℃预保温10min后迅速加入0.2mL的微生物蛋白酶酶液,40℃反应10min,加2mL镍锌试剂以停止反应并显色,搅匀后经滤纸过滤,上清液在540nm处测吸光值。所得吸光值与标准曲线对照,即得DHT-肽的质量。
将一分钟内1mg DHT-酪蛋白转化成1mg DHT-肽所需的酶量定义为一个酶活力单位U。
1.2.5 不同酶浓度的SPI溶液的制备及流变学特性的测定 取三种不同酶浓度的酶液与大豆分离蛋白进行充分混合,使得SPI浓度为7%。用0.1mol/L的NaOH溶液将体系pH调节为8,随即取适量样品进行测试。流变仪参数设置[11]:平板直径60mm,平板间距1000μm,应变为2%的条件下扫描频率1Hz,下底板温度为30、40、50℃。
1.2.6 大豆分离蛋白水解度的测定 茚三酮显色法测水解度:取水解蛋白液0.50mL定容至50mL。取0.40mL稀释液于试管中并加入1.60mL蒸馏水、1.00mL显色剂。混匀后置沸水浴中加热15min,同时作空白实验。冷却后,加入5.00mL 40%乙醇溶液混匀,放置15min在570nm处测定吸光值[12]。
1.2.7 SDS聚丙烯酰胺凝胶电泳对蛋白酶解模式的分析 SDS-PAGE电泳根据Laemmli[13]的方法,并参照汪家政等[14]和郭尧君[15]的方法。4%浓缩胶、12.5%分离胶,上样量为10μL,电泳初电压70V,样品进入分离胶时电压120V。采用含0.25%的考马斯亮蓝R-250染色,在甲醇、冰醋酸、水的比例为454∶75∶471的溶液中进行脱色。见清晰条带后进行分析。
2 结果与讨论
2.1 蛋白酶活力的测定
2.1.1 DHT-酪蛋白全显色标准曲线 实验以DHT-酪蛋白mg数为横坐标,吸光度A为纵坐标,绘制DHT-酪蛋白全显色标准曲线,如图1所示,得到标准曲线方程为:y=0.1957x+0.0016,R2=0.9979。

图1 DHT-酪蛋白全显色标准曲线Fig.1 Standard cure of full chromogenic reaction for DHT-casein
2.1.2 酶活的测定及计算 由标准曲线方程可知:DHT-酪蛋白mg数=生成DHT-肽mg数=(A-0.0006)/0.1979,则:

式中:A-样品测得的OD值;0.2-取0.2mL蛋白酶酶液;10-体系反应10min。
根据样品蛋白酶浓度公式可计算出各蛋白体系的酶浓度,分别为1.613、1.072、0.597U/mL。
2.2 微生物蛋白酶浓度对SPI凝胶流变学特性的影响
在微生物蛋白酶的作用下大豆分离蛋白被部分降解,构象发生变化,分子内或分子间交联或连接特殊功能基团形成网状结构,表现出凝胶性[16]。通过流变仪可监测体系形成凝胶的过程,其流变学参数储能模量(G’)和损耗模量(G’’)随时间的变化可客观地描述样品的凝胶特性。本实验流变学数据显示,G’值与G’’值随时间的增加具有相同的变化趋势,但G’’相对G’变化较小,tanδ<1,这都表明,样品蛋白形成了具有固体性质的弹性凝胶。因此,本实验只需研究分析G’值的变化。G’值也称为储能模量或弹性模量,是描述样品抵抗形变能力的物理量,G’越高,样品的弹性越好,越具有凝胶的性质。G’所达到的最大值称为G’max。不同酶浓度下所制备的凝胶的储能模量G’如图2~图5所示。

图2 30℃不同蛋白酶浓度下体系的动态流变曲线Fig.2 Dynamic rheological curve of system under different concentration of protease at 30℃
图2显示,在30℃,酶浓度为1.613U/mL时凝胶较快,1800s左右前迅速成胶,之后曲线趋于平稳。而酶浓度分别为1.072U/mL和0.597U/mL时,则需较长时间才达到其储能模量G’的最大值。空白样(未添加酶)的G’始终在0处且无明显变化,并未凝胶。这说明,纳豆芽孢杆菌蛋白酶对大豆分离蛋白有凝胶作用,在此温度下酶浓度越高越有助于凝胶的形成。因为在低温时,酶活力较低,水解程度小,更大的酶浓度促使一些肽键被破坏,蛋白质分子更大程度地展开,疏水性氨基酸残基暴露出来而形成凝胶[17]。
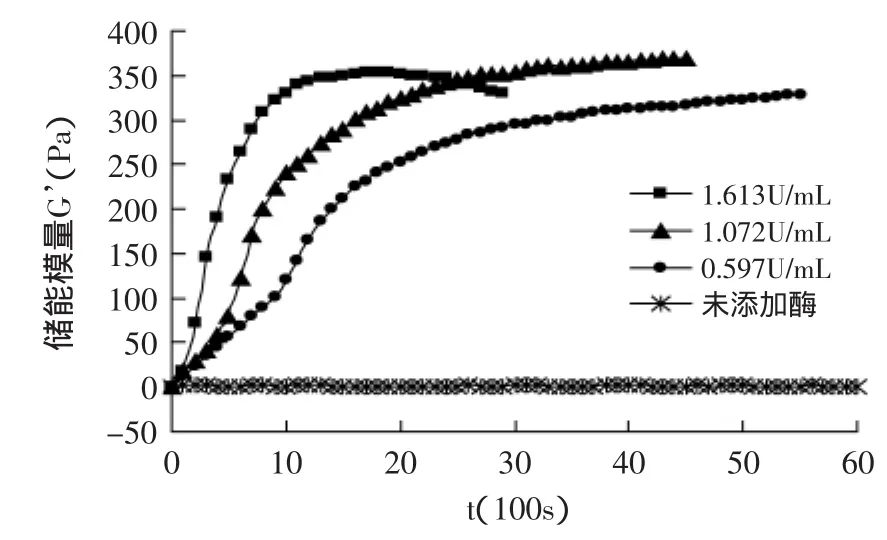
图3 40℃不同蛋白酶浓度下体系的动态流变曲线Fig.3 Dynamic rheological curve of system under differentconcentration of protease at 40℃
图3中,40℃时三条不同酶浓度的混合液流变学参数达到最大值的时间都比30℃时要短。这是由于随着温度的升高,反应速率加快。浓度为1.613U/mL的曲线在1700s左右达到最大值并且开始有下降趋势。温度加快反应速率,使得酶浓度高的体系酶解程度增加,部分蛋白被水解成肽链,失去凝胶性。

图4 50℃不同蛋白酶浓度下体系的动态流变曲线Fig.4 Dynamic rheological curve of system under different concentration of protease at 50℃
当温度由30℃升高到50℃时,各体系酶水解速率增加,酶浓度高的体系在蛋白质未形成凝胶网状结构前就已经被水解成肽,导致不能形成凝胶。因此较低的酶添加量才有利于体系凝胶的形成。如图4所示,酶浓度1.613U/mL曲线迅速达到G’max后便急剧下降。三个浓度的体系G’max均比30℃和40℃时小,说明较高温度时凝胶程度减弱。
2.3 微生物蛋白酶-SPI体系水解进程曲线
采用茚三酮显色法测定各时期体系的水解程度,通过与动态流变曲线的对照可知底物水解程度与储能模量G’的关系。因为酶浓度为1.072U/mL,在30℃和40℃时体系凝胶强度都比较理想,所以选择酶浓度1.072U/mL进行实验。

图5 30℃水解进程曲线和动态流变曲线Fig.5 Hydrolysis process curve and dynamic rheological curve at 30℃

图6 40℃水解进程曲线和动态流变曲线Fig.6 Hydrolysis process curve and dynamic rheological curve at 40℃
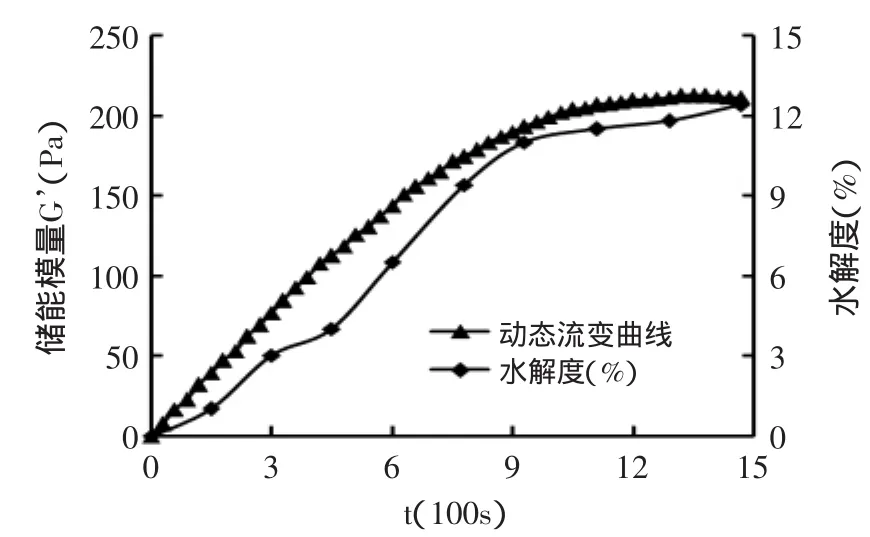
图7 50℃水解进程曲线和动态流变曲线Fig.7 Hydrolysis process curve anddynamic rheological curve at 50℃
图5~图7分别是酶浓度为1.072U/mL的体系在30、40、50℃时,随着时间的增长水解度发生的变化,并且与同等条件下储能模量进行对照。发现在同一温度下,水解度随时间的延长而逐渐增大。30℃时,达到G’max时,水解度为4.6%;40℃时为7.2%;50℃时为12.8%。这说明,在同一酶浓度时,温度低,水解度小,储能模量则较大;而温度升高,水解度变大,储能模量则较小。如图7所示,水解度12%左右时G’值开始下降,凝胶网络结构被破坏,凝胶性变得非常弱。
2.4 SDS聚丙烯酰胺凝胶电泳对蛋白酶解模式的分析
通过SDS聚丙烯酰胺电泳分析法可以进一步了解SPI体系的酶降解模式,蛋白质亚基分子量的分布和变化情况如图8所示。样品条件为40℃,酶浓度1.072U/mL,SPI浓度7%,分别水解5、10、20min。

图8 大豆分离蛋白经不同酶解时间的SDS-PAGE图谱Fig.8 SDS-PAGE of SPI after enzymatic hydrolysis at different time
大豆分离蛋白主要由7s和11s两部分组成。7S球蛋白组分中最主要的成分β-伴球蛋白(β-conglycinin),由α、α’、β和γ四种亚基组成,文献报道α和α’亚基分子量在57000~83000之间,β和γ亚基分子量为47000~53000和46000左右。11S由6个亚基构成,每个亚基由一条酸性多肽链(A)和一条碱性多肽链(B)通过一个二硫键相连形成AB亚基。酸性亚基分子量在37000~42000之间,碱性亚基分子量在16000~21000之间。
图8中,第一泳道是未经酶解的SPI电泳图,实验测得7s和11s亚基的分子量与文献报道基本吻合[18]。在水解过程中,7s和11s球蛋白分子量均有下降趋势。7s的α、α’、β亚基逐渐变浅甚至消失,但在B亚基上下出现一些新的谱带,这说明在凝胶过程中7s首先被水解成分子量较小的肽链,随着7s水解程度的增大,凝胶性逐渐增强。而11s只发生了简单的水解,分子量变化较小,酸性和碱性亚基(A、A3和B)都还存在,条带颜色略微变浅,只有少部分11s被水解为小肽。
这种现象说明,微生物蛋白酶对大豆分离蛋白具有水解作用;7s的水解可能更有利于大豆蛋白凝胶的形成;11s水解程度小,可能是因为碱性亚基在大豆球蛋白的内部深深地包埋,难以与微生物蛋白酶结合发生作用。
3 结论
3.1 低温时,能形成较高的凝胶强度,且增大酶的添加量有利于体系凝胶的形成,但凝胶速度较慢;高温时,凝胶强度较小,较少的酶添加量反而有利于体系形成凝胶,胶凝速度提高。由实验得,在40℃,酶浓度为1.072U/mL条件下进行反应比较适宜。
3.2 水解度与体系的凝胶性有很大的相关性,水解度过大会导致凝胶性的消失,50℃时水解度超过12%则不能形成稳定的凝胶。
3.3 微生物蛋白酶对大豆分离蛋白的7S和11S球蛋白均有不同程度的水解作用。7s逐渐被水解为短肽且水解程度较大,而11s基本能保持原有状态,残存的肽链变化程度不大。随着7s的水解度增大,蛋白的凝胶性增强,因此猜测7s的水解有利于凝胶的形成。
[1]Catsuimpoolas N,Meyer E W.Gelation phenomena of soybean globulins (I):protein—protein interactions[J].Cereal Chem,1970,47:559-570.
[2]Katsum I.Studies on the coagulation of soymilk-protein by commercial proteinase[J].Agric Biol Chem,1987,51:385.
[3]Yasuda M,Aoyama M,Sakaguchi M.Purification and characterization of a soybean-milk-coagulation enzyme from Bacillus pumilus TYO-67[J].Appl Microbiol Biotechnol,1999,51:474.
[4]姜燕,温其标,唐传核.微生物谷氨酰胺转移酶对大豆分离蛋白凝胶性能的影响[J].食品工业科技,2006,27(5):59-62.
[5]Tang C H.Effect of thermal pretreatment of raw soymilk on the gel strength and microstructure of tofu induced bymicrobial transglutminase[J].LWT-Food Science and Technology,2007,40:1403-1409.
[6]王君立,唐传核,周志红,等.微生物转谷氨酰胺酶促豆腐质构性质研究[J].粮食加工,2006(3):77-80.
[7]王莉,金学年,金成哲,等.纳豆发酵过程中纳豆激酶及活性物质的变化[J].大连工业大学学报,2006,27(1):5-9.
[8]潘进权,邓社兴,梁亚眉,等.纳豆芽孢杆菌蛋白酶的制备及性质研究[J].食品与发酵工业,2011,37(10):83-87.
[9]Canan Tari,Hande Genckal,Figen Tokatl.Optimization of a growth medium using a statistical approach for the production of an alkaline protease from a newly isolated Bacillus sp L21[J].Process Biochemistry,2006(41):659-665.
[10]忻纪厚,汪静英.用重氮四哇酪蛋白作底物测定蛋白水解酶活力[J].科学通报,1980(15):709-711.
[11]U Purwandari, N P Shah, T Vasiljevic.Effects of exopolysaccharide-producing strains of Streptococcus thermophilus on technological and rheological properties of settype yoghurt[J].International Dairy Journal,2007(17):1344-1352.
[12]赵新淮,冯志彪.大豆蛋白水解物水解度测定的研究[J].东北农业大学学报,1995,26(2):178-181.
[13]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[14]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2001:77-110.
[15]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,2001:86.
[16]李川,李娅娜,刘虎成,等.大豆蛋白改性[J].食品工业科技,2000,21(3):75-76
[17]Jacoba M S,Renkema.Relations between rheological properties and network structure of soy protein gels[J].Food Hydrocolloids,2004(18):39-47.
[18]Chuan-He Tang,Hui Wu,Zhong Chen,et al.Chen Formation and properties of glycinin-rich and β-conglycinin-rich soy protein isolate gels induced by microbial transglutaminase[J].Food Research International,2006,39:87-97.
