囊胚注射大鼠多能干细胞在小鼠体内产生大鼠胰腺
2013-12-06Kobayashi论著路君编译
Kobayashi T 论著 路君 编译
利用患者自身的多能干细胞、突破器官形成障碍、体外构建完整的器官是再生医学研究领域的最终目标。随着诱导多潜能干细胞(induced pluripotent stem cell,iPSC)技术的发展,人们已经可以获得患者的iPSC。虽然体细胞重编程还存在潜在分险,但真正的挑战是建立一种器官形成的方法。体外实现器官再造相当复杂,囊胚互补技术是实现这一目标的方法之一。囊胚互补最早由Chen等报道,他们的研究证明Rag2-/-小鼠在囊胚期将野生型小鼠胚胎干细胞(mouse embryonic stem cell,mESC)注射到内细胞团,发育出表型正常的小鼠。Rag2基因敲除引起小鼠胚胎发育过程中T、B淋巴细胞系缺失,小鼠体内T、B淋巴细胞完全由野生型mESC发育而来。Nakauchi研究小组认为,可以在基因敲除而造成器官发育缺失的模型动物中复制这一现象,因此他们关注到胰腺及胰腺发育相关转录因子Pdx1。胰腺和十二脂肠同型盒基因(pancreatic and duodenal homeobox1,Pdx1)在胰腺发育和β细胞分化中发挥重要作用。Pdx1基因敲除小鼠出生后因胰腺缺失死亡。Nakauchi研究小组假设Pdx1-/-小鼠发育过程中因没有胰腺器官而营造了一个“发育微环境”,注射多潜能干细胞(pluripotent stem cell,PSC)可形成完全由 PSC来源的、功能正常的胰腺。他们共设计了3组实验证明这种囊胚互补性。
研究的第一个目标是在Pdx1基因敲除小鼠中获得小鼠PSC(mPSC)来源的胰腺。用于注射囊胚的细胞有mESC和GT3.2小鼠iPSC。通过显微注射将GT3.2miPSCs注入Pdx1-lacZ Knockin 小鼠(Pdx+/-)配对产生的子代囊胚中。结果显示囊胚注射后出生的各基因型小鼠都有胰腺器官,其中也包括Pdx1-/-新生小鼠。Pdx+/-和Pdx+/+小鼠胰腺由自身细胞及外源EGFP-miPSC或mESC共同分化而来,与嵌合体动物身体其他各器官一致。嵌合的Pdx-/-小鼠胰腺形状和组织学检测均正常,胰腺细胞(外分泌、内分泌和导管上皮细胞)皆来源于EGFP-miPSC或mESC,但胰腺中的血管、神经和成纤维细胞则由自体及外源细胞共同发育而来。Pdx1-/-嵌合小鼠可存活至成年,GTT实验结果表明Pdx1-/-嵌合小鼠胰岛素分泌在高血糖时增加,血糖和正常小鼠类似。STZ诱导C57BL/6小鼠发生糖尿病,从表达EGFP的miPSC来源胰腺中分离的胰岛移植在糖尿病小鼠肾包膜下。2个月后依然可以在移植处检测到表达EGFP的miPSC来源的胰岛细胞。移植后的糖尿病小鼠血糖能够恢复正常,葡萄糖耐量(glucose tolerance testing,GTT)实验结果与正常小鼠相似。这部分研究结果表明,发育过程中某个器官缺失能营造出一个微环境(Pdx1-/-小鼠和胰腺缺失微环境)。PSC来源细胞可以代偿的占据这个微环境,形成一个几乎由供方PSC发育而来的器官。
研究的第二个目标是得到小鼠和大鼠的种间嵌合体。将EGFP标记的GT3.2 miPSC注射到大鼠囊胚,或将EGFP标记的大鼠iPSC(riPSC)注射到小鼠囊胚,注射的小鼠或大鼠iPSC能够参与异基因动物的胚胎发育并产生种间嵌合体动物。嵌合的PSC分布在全身各器官,且具有正常功能。种间嵌合动物中异基因来源细胞比例明显低于种内嵌合,大鼠或小鼠嵌合体的检测结果均一致。大鼠母亲生育的嵌合体动物形态与新生大鼠相似,而由小鼠母亲生育的则形态类似于正常的新生小鼠。异源细胞的贡献率会影响嵌合动物体型。组织免疫染色的结果可见EGFP阳性细胞存在于多种组织和器官中,但异种细胞未参与种间嵌合体动物的生殖细胞分化。大鼠没有胆囊,而小鼠有胆囊。当mPSC注入大鼠囊胚产生的种间嵌合体(与大鼠体型相似)没有胆囊,相对的rPSC注入小鼠囊胚产生的嵌合体(体型与小鼠相似)有胆囊。
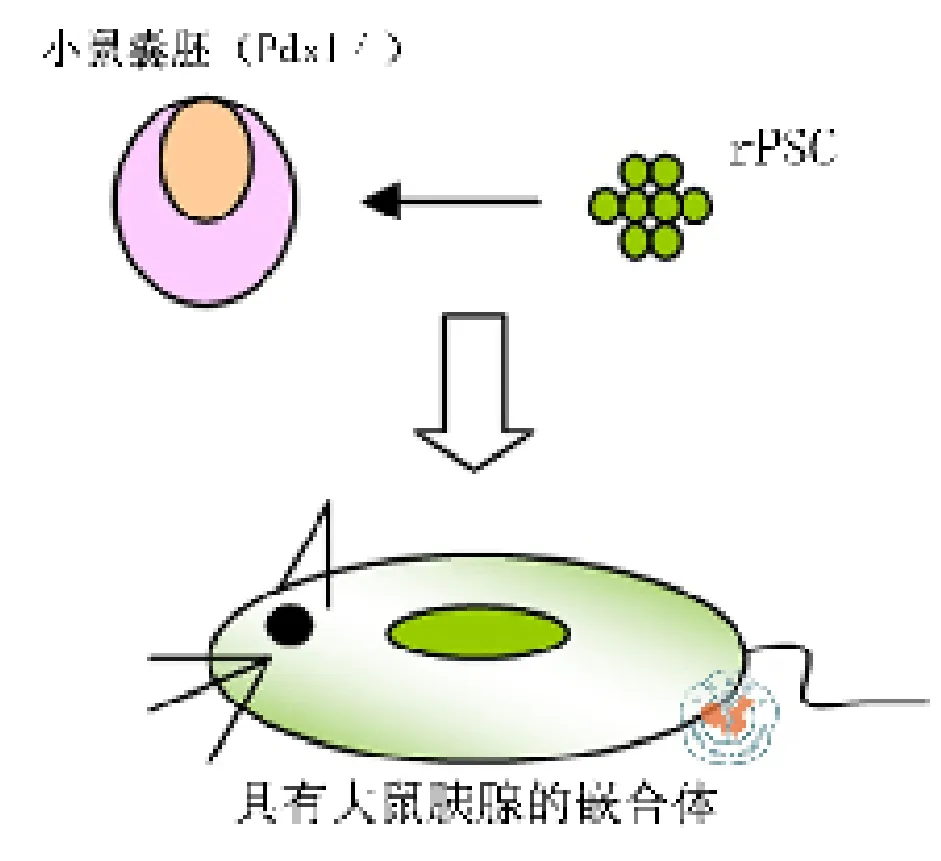
研究的第三个目标是,通过囊胚注射在Pdx1-/-小鼠体内产生异基因的大鼠胰腺。riPSC作为供方细胞,囊胚注射后139个胚胎种植在假孕小鼠子宫,34个小鼠出生。Pdx1-/-种间嵌合体胰腺几乎都是EGFP阳性细胞。经免疫组织荧光检测发现表达EGFP的riPSC来源的胰腺细胞可共表达α-淀粉酶(外分泌标志基因)、胰岛素、胰高血糖素和生长素(内分泌标志基因)。嵌合riPSC的Pdx1-/-小鼠能生长至成年(8周),胰腺中绝大部分细胞为EGFP阳性细胞。成年小鼠的GTT实验中,可见葡萄糖升高引起胰岛素分泌增加。这部分结果表明注射riPSC到Pdx1-/-小鼠胚胎成功的创造出拥有大鼠胰腺的嵌合小鼠,该技术被称为“种间囊胚互补”。
有研究报道过类似的技术,如胸腺上皮发育、心脏缺损修复、卵巢造血细胞及生殖细胞的克隆研究,但是没有研究曾证明外源细胞可形成完整的器官,弥补发育中的致死性缺陷,使嵌合体动物存活至成年。目前,体外将PSC分化为胰岛素分泌细胞的方法主要是采用多步诱导的方式。然而体外诱导的方法还有待于改进,胰岛素分泌量及葡萄糖响应方面仍需提高,且未分化的iPSC还有引起畸胎瘤的风险。本研究通过囊胚互补的方法在体内形成胰腺,模拟了近于正常的发育过程和表观遗传改变,逆转录病毒感染诱导的iPSC成瘤风险还需长期观察。
本研究成功的在Pdx1-/-小鼠中获得功能正常的大鼠胰腺。所有注射riPSC的Pdx1-/-小鼠囊胚出生后都有胰腺组织,尽管只有部分嵌合体动物能活到成年,成年动物riPSC来源的胰腺形态和组织学正常,未出现糖尿病症状,GTT结果表明胰腺功能良好。已往研究表现在异基因环境中可以形成有功能的细胞(精子、肝细胞),不过此前没有在异基因环境中PSC形成器官并能够拯救致死性突变至成年的报道。这种器官再造模式有望用于在猪或其他大型动物体内产生人的器官,但是要将此技术用于临床还有许多的难题需要克服。本研究获得了小鼠和大鼠的嵌合体动物,但这一过程中的胚胎致死率高、成年动物存活率低。猪或绵羊与人的胚胎发育存有很大差异,可能难以实现囊胚互补。另外一个问题就是PSC来源的细胞不仅存在于胰腺,还存在于包括脑和生殖腺的所有器官,尚没有适合控制PSC分化的方法,因此这种在牲畜体内获得人类器官的方式面临严峻的伦理质疑。
综上所述,该研究向人们描绘了一种实现再生医学终极目标的可能途径。