间充质干细胞与肿瘤细胞相互作用:促进还是抑制
2013-12-06庞一琳张斌陈虎
庞一琳 张斌 陈虎
随着间充质干细胞(mesenchymal stem cell,MSC)生物学特性研究的逐渐深入,其在临床上的应用也日益广泛。MSC免疫原性低,易于外源基因表达,且具有极好的靶向迁移能力和肿瘤趋向性,这些优势使得MSC作为载体被逐步应用于多种恶性实体肿瘤生物治疗的动物模型中。同时,MSC的免疫调节及造血支持作用,在治疗血液系统肿瘤尤其是造血干细胞移植中亦有着重要地位。无论是MSC与造血干细胞共输注预防急性移植物抗宿主病(acute graft-versus-host disease,aGVHD)[1-5],还是将MSC用于治疗已发生的aGVHD中[6-8],或是将MSC用于造血干细胞植入失败的挽救治疗[9-10],都已在临床试验中取得了可喜的成就。近年来,甚至有文献报道MSC对慢性移植物抗宿主病也具有一定的疗效[11]。
然而,不论是MSC应用于实体肿瘤还是血液系统肿瘤,其本身在体内是否会发生恶性转化以及与肿瘤发生发展的关系尚不明确,人体内输注MSC后是否会导致肿瘤的进展或复发是在大规模临床应用前必须首先考虑的问题。目前,有关外源性MSC究竟是促进还是抑制肿瘤生长的问题尚存争议,各种体内、外实验出现了完全不一致的结论。本文就MSC对肿瘤细胞生长的影响因素及其相关机制做一简要综述。
一、实验设计中影响MSC对肿瘤产生不同作用的因素
在MSC与肿瘤关系的研究结果中,并没有确切的认定MSC对肿瘤具有促进或抑制作用,许多观点仅限于理论猜测,不同实验中的参数差异可能是引起不同研究结果的因素,对文献中有关MSC对肿瘤促进或抑制的动物实验分别进行了汇总和比较(表 1,2)。
1.不同部位的肿瘤:相同的实验条件下,MSC与不同类型的肿瘤细胞共培养或共移植,可能会对肿瘤细胞产生完全不同的影响。Kucerova等[17]将人脂肪来源的MSC与黑色素瘤A375细胞共同移植给裸鼠后,肿瘤的发生率较单独移植黑色素瘤的裸鼠增加,肿瘤体积增大。体外实验亦证实MSC能够促进肿瘤增殖,抑制肿瘤细胞凋亡。而对于负荷有脑胶质瘤8MGBA细胞的裸鼠,MSC却不能促进肿瘤细胞的生长。多重因子分析显示在脑胶质瘤与MSC共培养体系中,肿瘤抑制因子如IL-1b、IL-1ra、IL-2、IL-4、IL-6、IL-8、IFN-γ的表达明显增高;而在黑色素瘤与MSC共培养体系中,血管内皮生长因子等肿瘤促进因子的表达明显增高。此外,SDF-1α/CXCR4生物轴亦起到招募MSC,并促进黑色素瘤生长的作用。
2.同一部位肿瘤但病理类型不同:即使是同一部位的肿瘤,不同病理类型的肿瘤细胞,MSC对其影响可能也不同。Karnoub等[14]的实验选用了4种不同病理类型的乳腺癌细胞系(腺癌MCF/Ras、鳞癌HMLER、导管癌MDA-MB-231及MDAMB-435),分别与人骨髓来源的MSC混合注射至免疫缺陷小鼠皮下,结果是MSC明显促进了MCF/Ras细胞的生长,而对其他3种细胞系肿瘤的原位生长无明显影响,但4种乳腺癌细胞的肺转移能力均得到了增强。
3.同一细胞株体内外实验结果不同:Tian等[27]将人骨髓MSC分别与肺癌A549细胞及食管癌Eca-109细胞体外共培养,发现在共培养体系中,两种肿瘤细胞的增殖均受到了抑制,肿瘤细胞周期停止在G1期,肿瘤细胞凋亡增加,但MSC与肿瘤细胞混合注射至BALB/c裸鼠皮下却发挥完全相反的作用,MSC促进了肿瘤的血管生成,肿瘤的体积明显增大。Ramasamy等[28]在研究MSC与血液系统肿瘤的关系中也得出了类似的矛盾结果,该研究发现在体外实验中MSC能够抑制慢性粒细胞白血病BV173细胞的增殖,但将MSC与BVl73细胞同部位注射于NOD/SCID小鼠皮下时,局部肿瘤的生长却得到了促进,其原因可能是MSC在肿瘤局部能够形成肿瘤干细胞龛,从而使肿瘤细胞维持其自身的增殖能力。
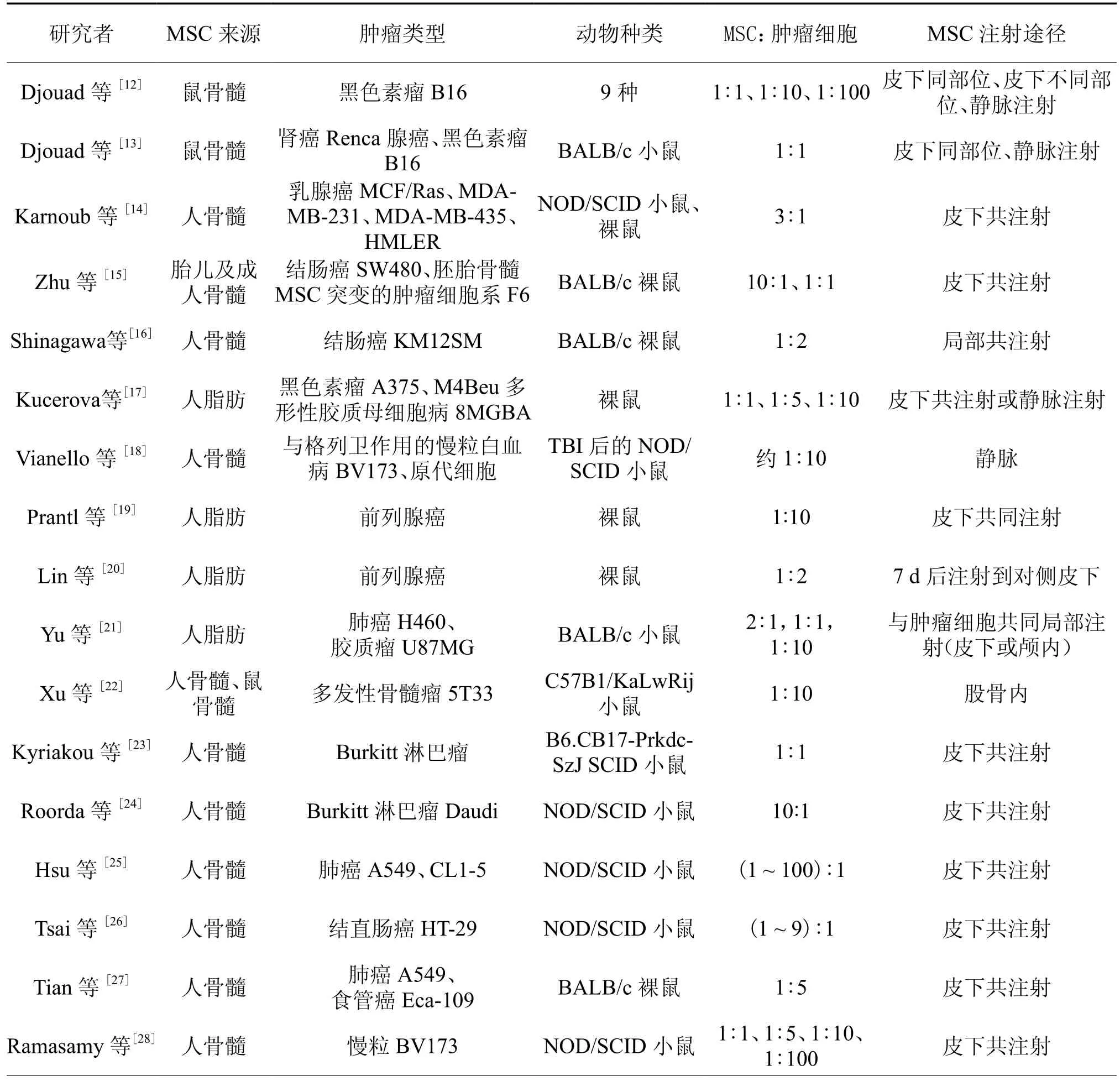
表1 MSC促进肿瘤生长的体内实验
4.MSC在体内注射途径:MSC目前在临床应用中多采用静脉注射的方式输注到人体内。而各研究者的实验模型中,有与肿瘤细胞同部位局部注射、远离肿瘤细胞局部注射及静脉注射等3种注射途径。不同的注射方式可能影响到MSC的细胞因子分泌及体内的迁移功能。有研究者将淋巴瘤或白血病细胞分别接种到正常免疫力或免疫缺陷的小鼠体内,骨髓来源的MSC以皮下同部位或静脉的方式输注到小鼠体内,发现当MSC在皮下与淋巴瘤或白血病细胞共同注射时,能够促进局部肿瘤的增殖,而静脉输注MSC则对皮下肿瘤的生长无影响[39]。Karnoub等[14]亦认为MSC对乳腺癌转移的促进作用仅限于与肿瘤细胞同部位注射时,当远离肿瘤部位注射,促进作用即消失,可能与细胞间直接接触或MSC的旁分泌作用相关。
5.MSC的输注剂量及次数:MSC输注的剂量的高低可能影响其在体内所发挥的作用。Djouad等[13]将不同浓度的小鼠骨髓MSC移植到负荷有肾腺癌Renca细胞的BALB/c小鼠体内,当MSC剂量的输注较高时(1×105个/只),促进了肿瘤的发生率,而当MSC的输注剂量较低时(1×102个/只),则消除了肾癌在小鼠体内的局部形成。
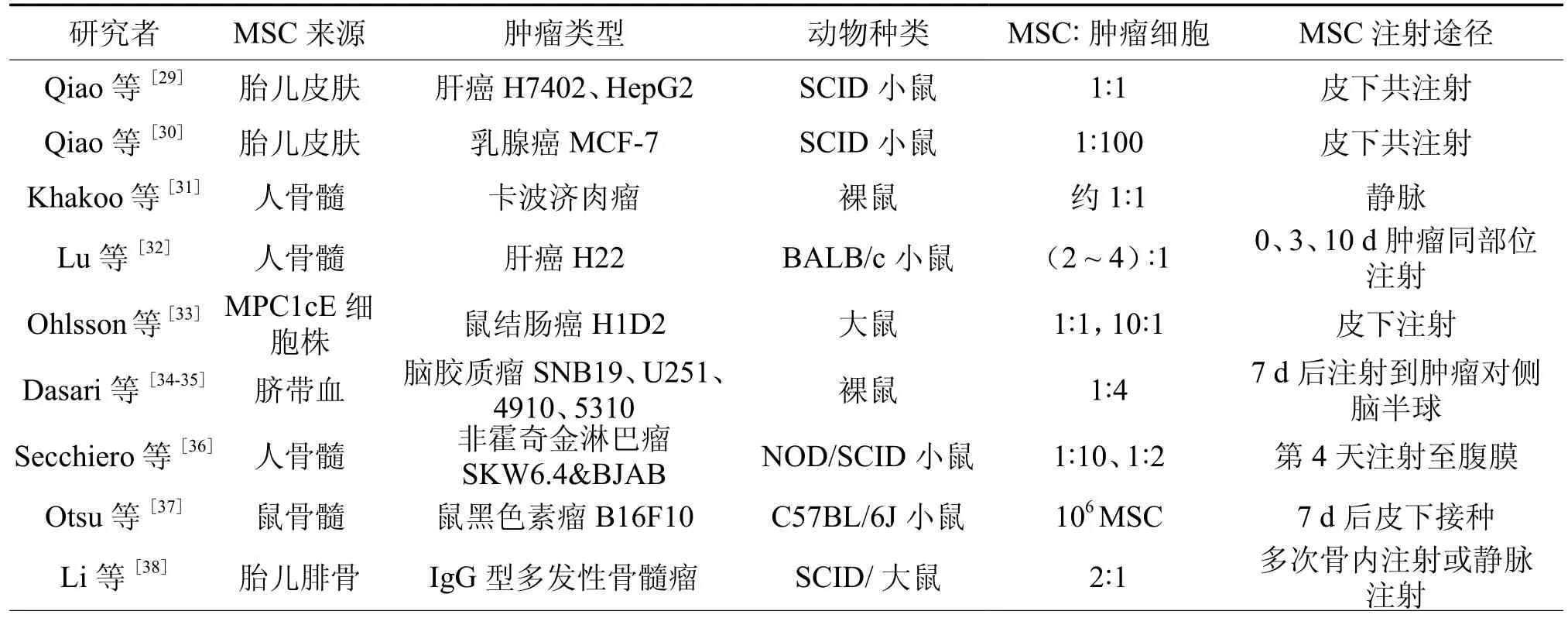
表2 MSC抑制肿瘤生长的体内实验
单次注射或多次注射造成MSC在体内累积的数量不同,发挥作用的时间长短也不同。Li等[38]在 MSC 与多发性骨髓瘤(multiple myeloma,MM)的大鼠模型中证实,静脉注射MSC的效果与注射的次数有关,仅单独注射一次对MM骨病无影响,连续每周静脉注射则能够防止MM骨病。
6.MSC的输注时机:MSC在动物体内输注大体有2个时间点:(1)将MSC与肿瘤细胞同时输注;(2)预先建立好肿瘤动物模型,待肿瘤细胞生长一段时间后再输注MSC。Roorda等[24]将人骨髓MSC与Burkitt淋巴瘤以1:10的比例混合后接种到NOD/SCID小鼠皮下,发现MSC能够促进Burkitt淋巴瘤的发生和发展。而Secchiero等[36]则预先在NOD/SCID小鼠腹膜内接种了Burkitt淋巴瘤,第4天时同样以1:10的比例在种植肿瘤细胞的部位输注MSC,得到的结论却截然相反,发现MSC明显减慢了肿瘤的发展,延长了小鼠的生存期。
7.MSC供者的年龄:Zhu等[15]比较了胎儿及成人骨髓的MSC对SW80细胞系(结肠癌)及F6细胞系(异常MSC突变的肿瘤)的影响,将MSC分别以10:1或1:1的比例共同皮下注射到BALB/c裸鼠体内,结果是胎儿骨髓MSC及成人骨髓MSC对肿瘤的生长均起促进作用,但成人骨髓组的肿瘤生长速度(20d肿瘤的发生率为100﹪)比胎儿骨髓组的肿瘤生长速度(20d肿瘤的发生率为20﹪~80﹪)更快。
二、MSC影响肿瘤细胞生长可能的机制
(一)影响血管生成
MSC具有分化为血管细胞和分泌血管活性因子的潜能,在多数研究中显示,MSC能够促进实体肿瘤周围血管的生长,从而促进肿瘤的进展。Prantl等[19]将脂肪来源的MSC与前列腺癌细胞以1:10的比例混合后,注射到无胸腺的裸鼠皮下,注射3周后测量肿瘤的体积,共移植组与单独注射肿瘤细胞组比较,肿瘤细胞的体积明显增大,血管密度增加。同年,Lin等[20]进行了一项相似的研究,他将前列腺癌细胞预先移植到裸鼠的一侧皮下,1周后,把同样是脂肪来源的MSC以1:2的比例皮下接种到肿瘤细胞的对侧,与在肿瘤细胞对侧输注PBS的对照组相比,MSC组肿瘤体积增大,毛细血管密度是对照组的2倍。但MSC组与对照组相比,血管内皮生长因子的表达并无明显区别,但成纤维细胞生长因子2(FGF2)的表达明显增高。Tian等[27]在肺癌及食管癌的体内实验中,也证实了MSC通过促进血管生成而促进了肿瘤的进展。
Otsu等[37]却则认为MSC与肿瘤细胞相互作用能够抑制血管的生成,他在C57BL/6J小鼠皮下接种黑色素瘤B16F10细胞,7 d后将鼠骨髓MSC皮下注射至与肿瘤相同的部位,发现MSC明显抑制了肿瘤细胞的生长,肿瘤细胞血管密度减低。体外实验中,MSC能在人工基底膜上朝向毛细血管来源的内皮细胞迁移,并分解活性氧,引起内皮细胞的凋亡及毛细血管退化。
(二)影响肿瘤转移
Shinagawa等[16]将人骨髓MSC与结肠癌KM12SM细胞以2:1的比例共同输注,发现MSC能够加强肿瘤的迁移及侵犯能力,促进结肠癌细胞的生长及转移。Karnoub等[14]将低转移性乳腺癌细胞与人骨髓来源的MSC混合注射至免疫缺陷小鼠皮下,发现MSC可通过分泌CCL5,介导肿瘤细胞从微血管向转移灶渗出和迁移,从而增强乳腺癌的肺转移能力。此外Corcoran等[40]发现MSC还可以通过影响SDF-1α/CXCR4生物轴促进低转移性乳腺癌向骨转移。
(三)对机体免疫功能的抑制
MSC最重要的生物学特性之一就是其强大的免疫调节性,研究者们逐步证实了MSC在体内对T细胞、B细胞、DC细胞、NK细胞、粒细胞和巨噬细胞等均有不同程度的免疫调节能力,当MSC输注到人体后,可能因为抑制机体的免疫功能而促进肿瘤的生长。Djouad等[12]将鼠骨髓来源的MSC及黑色素瘤B16细胞共同移植给多种免疫功能不同的小鼠,发现MSC对肿瘤细胞的生长和转移起了明显的促进作用,认为MSC促进肿瘤生长的原因是MSC阻碍了小鼠T淋巴细胞的增殖活化,抑制树突状细胞分化及成熟。
(四)影响肿瘤的细胞周期及细胞凋亡
多项体外实验证实MSC能够将肿瘤细胞阻滞在G0或G1期,并诱导肿瘤细胞的凋亡。Lu等[32]发现鼠骨髓MSC与肝癌H22细胞及胰岛瘤INS-1细胞在体外共培养后,细胞周期负调节蛋白p21的表达上升,凋亡相关蛋白酶caspase3的表达下降,MSC通过诱导肿瘤细胞G0或G1期停滞及细胞凋亡的方式,阻滞肿瘤细胞的周期进展。
许多研究者认为MSC能够抑制肿瘤细胞的凋亡。Yu等[21]将人脂肪来源的MSC与肺癌H460细胞及胶质瘤U87MG细胞分别以2:1、1:1、1:10的比例共同局部移植于BALB/c裸鼠体内,发现MSC对两种肿瘤细胞的生长均起促进作用。体外实验中,不论是将MSC与肿瘤细胞共培养,还是MSC条件培养基与肿瘤细胞共培养,均能抑制肿瘤细胞的凋亡。
(五)MSC与肿瘤细胞之间的细胞因子网络及信号通路
1.Wnt/β-catenin信号通路:Qiao等[29]将人类胎儿皮肤来源的MSC与肝癌细胞系H7402以1:1的比例注射到SCID小鼠,发现MSC能延迟肿瘤的形成,缩小肿瘤的体积;他们又将MSC与乳腺癌细胞MCF-7以1:100的比例共同注射到SCID小鼠皮下,得到了同样的结果[30]。体外实验证实MSC与肿瘤细胞接触后,能够分泌DKK-1,下调Wnt信号通路中β-catenin的表达,加入DKK-1抗体后可明显削弱MSC对肿瘤细胞的抑制作用。次年在Zhu等[41]的一项体外实验研究中,将人脂肪来源的MSC以1:10的比例与乳腺癌MCF-7细胞体外共培养,亦得到了相似的结论。
2.PI3K/Akt信号通路:Khakoo 等[31]给无胸腺的裸鼠皮下种植了Kaposi肉瘤细胞,静脉输注人骨髓来源的MSC,发现MSC对Kaposi肉瘤有明显的抑制效应。进一步体外实验证实,MSC通过细胞间直接接触,下调PI3K/Akt信号通路中Akt蛋白激酶的活性,抑制Kaposi肉瘤的生长。Dasari等[34-35]在人脐血MSC对胶质瘤细胞抑制作用的分析中,亦认为是通过上调PTEN的表达,阻断PI3K/AKT信号通路实现的。
而另一项研究却认为MSC能够启动PI3K/AKT信号通路,乳腺癌细胞通过直接接触,诱导微环境中MSC过表达趋化因子CCL5(又名RANTES),CCL5与乳腺癌细胞表面相应受体CCR5相互作用,启动PI3K/Akt信号通路,从而促进了乳腺癌细胞生长和转移能力[14]。
3.JAK2/STAT3信号通路:Hsu等[25]将MSC与肺癌A549、CL1-5细胞株体外共培养,发现MSC可促进肺癌细胞的集落形成,在注射有肺癌细胞的NOD/SCID小鼠体内,MSC也能促进其在体内的生长。其原因与MSC分泌IL-6,通过活化JAK2/STAT3信号通路有关。当拮抗IL-6或STAT3被沉默后,肺癌细胞的集落形成能力便随之减弱。Tsai等[26]在结肠癌小鼠模型中,同样发现了MSC对IL-6/JAK2/STAT3信号通路的激活作用,从而促进结肠癌的形成。
三、MSC在体内外对血液系统肿瘤的影响
1.对白血病的影响:多数的体外实验认为MSC对白血病的生长起抑制作用。Ramasamy等[28]将人骨髓MSC分别与慢性粒细胞白血病BV173及K562细胞株、急性髓性白血病KG1a细胞株、急性T淋巴细胞白血病Jurkat细胞株共培养,MSC与白血病细胞的比例为1:1,1:5,1:10,1:100,发现MSC能够抑制白血病细胞的增殖,阻滞白血病细胞周期于G0或G1期,周期蛋白D2、p27kip1及CDK4的表达下降,但白血病细胞的凋亡也随之减少。2012年,他们又将人脐血来源的MSC与慢性粒细胞白血病K562细胞株共培养,发现人脐血MSC亦能抑制K562细胞的增殖,使K562细胞停滞在G0或G1期,且抑制作用在细胞直接接触时最有效[42]。同时该研究分析了共培养液中的33种细胞因子,其中TGF-β1(LAP),IL-6 及 IL-8 的表达升高。Zhu等[41]将人脂肪来源的MSC分别与慢性粒细胞白血病K562细胞株及急性早幼粒细胞白血病HL60细胞株以1:10的比例体外共培养,同样证实了MSC对白血病细胞的增殖起抑制作用,这种抑制作用是通过MSC分泌DKK-1,抑制WNT信号通路实现的。
另有研究证实MSC可以抑制化疗药物对白血病细胞的凋亡作用。Tabe等[43]在一项对人脂肪来源的MSC与急性早幼粒细胞白血病的体外实验中发现,MSC产生的瘦素能够阻止全反式维甲酸(ATRA)及多柔比星诱导的急性早幼粒细胞白血病细胞凋亡,该作用需要细胞间直接接触,并与STAT3及MAPK的磷酸化有关。Vianello等[18]也认为MSC在体内外能够抑制格列卫诱导的慢性粒细胞白血病凋亡,其原因可能是MSC分泌的CXCL12与表达于慢性粒细胞白血病细胞表面的CXCR4结合,形成CXCL12/CXCR4生物轴,而当加入CXCR4拮抗剂后,依然能够恢复格列卫对慢性粒细胞白血病细胞的诱导凋亡作用。
2.对淋巴瘤的影响:部分研究者认为MSC体内外能够抑制淋巴瘤的生长。Lu等[32]将小鼠骨髓MSC与淋巴瘤YAC-1细胞株及EL-4细胞株以不同的比例共培养(MSC与肿瘤细胞分别为1:10、1:20、1:40、1:80),发现 MSC 对鼠淋巴瘤细胞株的生长有抑制作用,且这种抑制作用呈剂量依赖性。在共培养体系中,细胞周期负调节蛋白p21的表达上升,而凋亡相关蛋白酶caspase3的表达下降。Secchiero等[36]选用了EBV阴性Burkitt淋巴瘤细胞株BJAB及EBV阳性B细胞淋巴瘤细胞株SKW6.4,分别注射到NOD/SCID小鼠腹膜内,输注淋巴瘤细胞后的第4天,以1:2或1:10的比例同部位输注人骨髓MSC,发现在MSC与淋巴瘤细胞为1:10时,能够明显减慢淋巴瘤的发展,延长小鼠的生存期。
也有研究者认为MSC对淋巴瘤的影响可类似于部分实体肿瘤,通过促进血管生成而促进淋巴瘤的生长。Roorda等[24]将人骨髓MSC与Burkitt淋巴瘤Daudi细胞混合后接种到NOD/SCID小鼠皮下,混合注射组较单独肿瘤细胞注射组的血管密度明显增加,淋巴瘤的发生和发展得到了促进。而每隔一天注射血管抑制剂PTK787/ZK 222584,则能明显减弱MSC对肿瘤的促进作用。此外,Kyriakou等[23]在Burkitt淋巴瘤小鼠模型中,也证实了MSC对淋巴瘤的促进作用。
3.对多发性骨髓瘤的影响:最新的一项关于MSC与多发性骨髓瘤关系的研究中[22],认为在体内外,MSC均能向MM细胞方向趋化,并且通过细胞间直接接触及分泌可溶性细胞因子IL-6、IL-10、IGF-1、血管内皮生长因子、DDK-1等,促进MM细胞的增殖及生长,同时抑制MM细胞的自发性凋亡及硼替佐米诱导的MM细胞凋亡,在MSC与MM细胞共培养体系中周期蛋白D2、CDK4、BCL-XL的表达增加,Caspase3和PARP的表达下降,其机制可能与MSC影响了PI3K/AKT及MAPK信号通路有关。
而另一项相似的研究中,则得到相反的结论[38]。该研究采用SCID大鼠为模型,认为骨内注射MSC能预防MM骨病,促进骨形成,抑制MM的生长。马法兰诱导缓解后,骨内注射MSC能促进骨形成,延迟MM骨病的发生。
四、MSC在防治移植物抗宿主病(graft-versushost disease,GVHD)中有效性及安全性的临床研究
1.MSC联合造血干细胞移植预防GVHD:2005年,Lazarus等[1]报道了一项MSC与造血干细胞(hemopoietic stem cell,HSC)共移植的多中心Ⅱ期临床实验,共有46例恶性血液病患者进行了同胞供者HLA配型全相和的骨髓或外周血造血干细胞移植,移植前4 h静脉输注供者骨髓来源的MSC,输注剂量为(1~5)×106个 /kg,共有 11例(24﹪)患者复发(中位时间 231.5 d,范围 14~688 d),2 年无病生存率为53﹪,与HSC单移植组相比,MSC与HSC共移植并没有促进恶性血液肿瘤的复发。
MSC在非清髓造血干细胞移植中亦有良好的预防作用。Baron等[2]将第三方的骨髓MSsC在非清髓外周血造血干细胞移植前30~120min静脉输注给20例恶性血液病患者,与历史对照组比较,MSC输注组的一年内非复发相关性死亡率(10﹪和37﹪)及GVHD发生率(10﹪和31﹪)明显降低,疾病无进展生存率(60﹪和38﹪)及总生存率(80﹪和44﹪)增高,疾病复发率无统计学差异(30﹪和25﹪,P=NS)。
Ball等[3]报道了儿童HLA半相合的造血干细胞移植联合输注MSC预防GVHD的临床研究,研究组共14例儿童,其中11例为恶性血液病,MSC来源于供者骨髓,输注剂量为(1~3.3)×106个 / kg,观察到MSC与HSC联合输注能够加速造血恢复,与历史对照,复发率及感染率未见增高。
另外亦有研究者对MSC在脐血造血干细胞移植中的应用进行了报道[5],报道中共有13例儿童恶性血液病患者在脐血移植当天输注MSC,MSC来源于父母的骨髓,输注剂量为(1~3.9)×106个 / kg,与历史对照组相比,输注MSC组的患儿无一例发生Ⅲ~Ⅳ度aGVHD,而历史对照组中Ⅲ~Ⅳ度aGVHD的发生率为26﹪,3年内疾病复发率并无明显差别(25﹪和23﹪)。
与上述结果相悖,本中心观察到MSC与HSC联合移植可能会增加疾病的复发率[4]。该项研究中共包含25例恶性血液病患者,其中HSC联合MSC共移植组10例,单独HSC移植组15例,MSC来源于供者骨髓,输注的剂量范围为(0.03~1.53)×106个/ kg,与HSC单移植组比较,共移植组的急性和慢性GVHD均明显下降,但是共移植组原发病的复发时间缩短(中位时间 63 d,范围 39~1062 d 和中位时间 177 d,范围 66~450d),复发率增高(60﹪和20﹪),3年无病生存率低(30﹪和66.7﹪)。
2.MSC在造血干细胞移植后治疗aGVHD:2008年,Le-Blanc等[6]报道了欧洲骨髓移植发展协会的一项多中心Ⅱ期临床研究,该研究共纳入了55例移植后发生Ⅱ~Ⅳ度激素耐药的aGVHD患者,接受MSC输注92例次,输注的MSC剂量为(0.4~9.0)×106个 / kg,有 23例次来源于造血干细胞供者,69例次来源于第三方无关供者,治疗结果是30例患者完全有效,9例患者症状得到改善,MSC完全有效的患者2年无病生存率明显提高。这55例患者中,有43例患有恶性血液病,移植后仅3例患者出现肿瘤复发。
2011年,Prasad等[7]发表了一个多中心的关于MSC治疗严重激素耐药的aGVHD的报道,共纳入自2005年到2007年的12例儿童造血干细胞移植后发生Ⅲ~Ⅳ度严重的激素耐药的aGVHD患者,MSC来源为第三方的骨髓MSC,其中2例患者每次输注MSC的剂量为8×106个/kg,其余10例每次2×106个/kg,全部患者均经静脉输注,每周输注2次,共计4周。MSC对这些严重激素耐药的aGVHD产生了良好的疗效,且在观察期间无明显不良事件发生,认为MSC对治疗严重激素耐药的aGVHD是安全有效的。
五、问题与展望
根据表1,2可看出,研究者们在建立MSC与肿瘤移植模型时,既有免疫功能正常的实验动物,也有免疫功能低下或缺陷的实验动物,而MSC在体内可能不只对肿瘤细胞产生作用,对机体的免疫细胞可能亦产生作用,从而间接影响肿瘤的生长。何种动物模型能够更加真实地模拟患者当时的免疫状态,亦是一个重要的影响因素。此外,MSC的来源广泛,研究者的体内外实验中采用了骨髓、脂肪、脐血、脐带、胎盘等不同组织来源的MSC,而不同来源的MSC之间免疫调节能力、迁移能力及分泌的细胞因子均有差异,这些差异可能也是造成MSC与肿瘤之间不同作用的原因。
综上所述,MSC对肿瘤的生长扮演着双重角色,MSC与肿瘤细胞相互交错形成复杂的细胞因子网络,从而影响体内外实验的不同结局。在共培养体系或种植性动物肿瘤模型中,由于人为干扰因素过多,与肿瘤在人体内的发生发展有很大的背景差异,究竟MSC在人体内如何影响肿瘤的发生发展,也许最终只有通过大规模的随机临床实验才能明确。但MSC可能促进肿瘤的作用是不容忽视的潜在危险因素,且有报道称多次传代培养后MSC本身也有恶变的可能,这需要认真研究MSC在肿瘤治疗上作用与机制,权衡应用MSC的利与弊。
1 Lazarus HM,Koc ON,Devine SM,et al.Cotransplantation of HLA-identical sibling culture-expanded mesenchymal stem cells and hematopoietic stem cells in hematologic malignancy patients[J].Biol Blood Marrow Transplant,2005,11(5):389-398.
2 Baron F,Lechanteur C,Willems E,et al.Cotransplantation of mesenchymal stem cells might prevent death from graftversus-host disease (GVHD) without abrogating graftversus-tumor effects after HLA-mismatched allogeneic transplantation following nonmyeloablative conditioning[J].Biol Blood Marrow Transplant,2010,16(6): 838-847.
3 Ball LM,Bernardo ME,Roelofs H,et al.Cotransplantation of ex vivo expanded mesenchymal stem cells accelerates lymphocyte recovery and may reduce the risk of graft failure in haploidentical hematopoietic stem-cell transplantation[J].Blood,2007,110(7):2764-2767.
4 Ning H,Yang F,Jiang M,et al.The correlation between cotransplantation of mesenchymal stem cells and higher recurrence rate in hematologic malignancy patients:outcome of a pilot clinical study[J].Leukemia,2008,22(3):593-599.
5 Bernardo ME,Ball LM,Cometa AM,et al.Co-infusion of ex vivo-expanded,parental MSC prevents life-threatening acute GVHD,but does not reduce the risk of graft failure in pediatric patients undergoing allogeneic umbilical cord blood transplantation[J].Bone Marrow Transplant,2011,46(2): 200-207.
6 Le-Blanc K,Frassoni F,Ball L,et al.Mesenchymal stem cells for treatment of steroid-resistant,severe,acute graftversus-host disease:a phaseⅡstudy[J].Lancet,2008,371(9624):1579-1586.
7 Prasad VK,Lucas KG,Kleiner GI,et al.Efficacy and safety of ex vivo cultured adult human mesenchymal stem cells (Prochymal™) in pediatric patients with severe refractory acute graft-versus-host disease in a compassionate use study[J].Biol Blood Marrow Transplant,2011,17(4):534-541.
8 Ringdén NO,Uzunel M,Rasmusson I,et al.Mesenchymal stem cells for treatment of therapy-resistant graft-versushost disease[J].Transplantation,2006,81(10):1390-1397.
9 Meuleman N,Tondreau T,Ahmad I,et al.Infusion of mesenchymal stromal cells can aid hematopoietic recovery following allogeneic hematopoietic stem cell myeloablative transplant:a pilot study[J].Stem Cells Dev,2009,18(9):1247-1252.
10 Ringdén NO.Mesenchymal stromal cells as first-line treatment of graft failure after hematopoietic stem cell transplantation[J].Stem Cells Dev,2009,18(9):1243-1246.
11 Weng J,Du X,Geng S,et al.Mesenchymal stem cell as salvage treatment for refractory chronic GVHD[J].Bone Marrow Transplant,2010,45(12):1732-1740.
12 Djouad F,Plence P,Bony C,et al.Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals[J].Blood,2003,102(10):3837-3844.
13 Djouad F,Bony C,Apparailly F,et al.Earlier onset of syngeneic tumors in the presence of mesenchymal stem cells[J].Transplantation,2006,82(8):1060-1066.
14 Karnoub AE,Dash AB,Vo AP,et al.Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J].Nature,2007,449(7162):557-563.
15 Zhu W,Xu W,Jiang R,et al.Mesenchymal stem cells derived from bone marrow favor tumor cell growth in vivo[J].Experimental and molecular pathology,2006,80(3):267-274.
16 Shinagawa K,Kitadai Y,Tanaka M,et al.Mesenchymal stem cells enhance growth and metastasis of colon cancer[J].International Journal of Cancer,2010,127(10): 2323-2333.
17 Kucerova L,Matuskova M,Hlubinova K,et al.Tumor cell behaviour modulation by mesenchymal stromal cells[J].Mol Cancer,2010,9:129.
18 Vianello F,Villanova F,Tisato V,et al.Bone marrow mesenchymal stromal cells non-selectively protect chronic myeloid leukemia cells from imatinib-induced apoptosis via the CXCR4/CXCL12 axis [J].Haematologica,2010,95(7):1081-1089.
19 Prantl L,Muehlberg F,Navone NM,et al.Adipose tissuederived stem cells promote prostate tumor growth[J].Prostate,2010,70(15):1709-1715.
20 Lin G,Yang R,Banie L,et al.Effects of transplantation of adipose tissue-derived stem cells on prostate tumor[J].Prostate,2010,70(10):1066-1073.
21 Yu JM,Jun ES,Bae YC,et al.Mesenchymal stem cells derived from human adipose tissues favor tumor cell growth in vivo [J].Stem cells and development,2008,17(3):463-474.
22 Xu S,Menu E,Becker AD,et al.Bone marrow-derived mesenchymal stromal cells are attracted by multiple myeloma cell-produced chemokine CCL25 and favor myeloma cell growth in vitro and in vivo [J].Stem cells,2012,30(2):266-279.
23 Kyriakou CA,Yong KL,Benjamin R,et al.Human mesenchymal stem cells (hMSC) expressing truncated soluble vascular endothelial growth factor receptor (tsFlk-1)following lentiviral-mediated gene transfer inhibit growth of Burkitt's lymphoma in a murine model[J].J Gene Med,2006,8(3):253-264.
24 Roorda BD,Elst A,Boer TG,et al.Mesenchymal stem cells contribute to tumor cell proliferation by direct cell-cell contact interactions[J].Cancer Invest,2010,28(5):526-534.
25 Hsu HS,Lin JH,Hsu TW,et al.Mesenchymal stem cells enhance lung cancer initiation through activation of IL-6/JAK2/STAT3 pathway[J].Lung Cancer,2011,75(2):167-77.
26 Tsai KS,Yang SH,Lei YP,et al.Mesenchymal stem cells promote formation of colorectal tumors in mice[J].Gastroenterology,2011,141(3):1046-1056.
27 Tian LL,Yue W,Zhu F,et al.Human mesenchymal stem cells play a dual role on tumor cell growth in vitro and in vivo [J].J Cellular Physiol,2011,226(7):1860-1867.
28 Ramasamy R,Lame WF,Soeiro I,et al.Mesenchymal stem cells inhibit proliferation and apoptosis of tumor cells: impact on in vivo tumor growth[J].Leukemia,2006,21(2):304-310.
29 Qiao L,Xu Z,Zhao T,et al.Suppression of tumorigenesis by human mesenchymal stem cells in a hepatoma model[J].Cell Res,2008,18(4):500-507.
30 Qiao L,Xu ZL,Zhao TJ,et al.Dkk-1 secreted by mesenchymal stem cells inhibits growth of breast cancer cells via depression of Wnt signalling[J].Cancer lett,2008,269(1):67-77.
31 Khakoo AY,Pati S,Anderson SA,et al.Human mesenchymal stem cells exert potent antitumorigenic effects in a model of Kaposi's sarcoma [J].J Exp Med,2006,203(5):1235-1247.
32 Lu Y,Yuan Y,Wang X,et al.The growth inhibitory effect of mesenchymal stem cells on tumor cells in vitro and in vivo [J].Cancer Biol Ther,2008,7(2): 245-251.
33 Ohlsson LB,Varas L,Kjellman C,et al.Mesenchymal progenitor cell-mediated inhibition of tumor growth in vivo and in vitro in gelatin matrix[J].Exp Mol Pathol,2003,75(3):248-255.
34 Dasari VR,Kaur K,Velpula KK,et al.Upregulation of PTEN in glioma cells by cord blood mesenchymal stem cells inhibits migration via downregulation of the PI3K/Akt pathway[J].PloS one,2010,5(4):e10350.
35 Dasari VR,Velpula KK,Kaur K,et al.Cord blood stem cell-mediated induction of apoptosis in glioma downregulates X-linked inhibitor of apoptosis protein(XIAP)[J].PloS one,2010,5(7):e11813.
36 Secchiero P,Zorzet S,Tripodo C,et al.Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts[J].PloS one,2010,5(6):e11140.
37 Otsu K,Das S,Houser S D,et al.Concentration-dependent inhibition of angiogenesis by mesenchymal stem cells[J].Blood,2009,113(18):4197-4205.
38 Li X,Ling W,Khan S,et al.Therapeutic effects of intrabone and systemic mesenchymal stem cell cytotherapy on myeloma bone disease and tumor growth[J].J BoneMiner Res,2012,27(8):1635-1648.
39 宋宁霞.小鼠骨髓间充质干细胞对白血病细胞增殖的影响及机制探讨[D].上海:第二军医大学,2010.
40 Corcoran KE,Trzaska KA,Fernandes H,et al.Mesenchymal stem cells in early entry of breast cancer into bone marrow[J].PloS one,2008,3(6):e2563.
41 Zhu Y,Sun Z,Han Q,et al.Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1[J].Leukemia,2009,23(5):925-933.
42 Fonseka M,Ramasamy R,Yip WK,et al.Human umbilical cord blood-derived mesenchymal stem cells(hUCB-MSC) inhibits the proliferation of K562 (human erythromyeloblastoid leukemic cell line)[J].Cell Biol Int,2012,36(9):793-801.
43 Tabe Y,Konopleva M,Munsell MF,et al.PML-RARα is associated with leptin-receptor induction: the role of mesenchymal stem cell-derived adipocytes in APL cell survival [J].Blood,2004,103(5):1815-1822.
