超顺磁性氧化铁标记对大鼠骨髓间充质干细胞增殖和分化能力的影响
2013-05-08卓文利蔡锦全付云烽朱榕城徐廷昭吴卫真杨顺良谭建明
卓文利 蔡锦全 付云烽 朱榕城 徐廷昭 吴卫真 杨顺良 谭建明
超顺磁性氧化铁标记对大鼠骨髓间充质干细胞增殖和分化能力的影响
卓文利 蔡锦全 付云烽 朱榕城 徐廷昭 吴卫真 杨顺良 谭建明
目的 利用超顺磁性氧化铁(SPIO)标记大鼠骨髓间充质干细胞(BMSC),探讨其对BMSC增殖和分化能力的影响。方法分离、纯化及培养大鼠BMSC。取第3代BMSC,用终浓度为25.0 μg/ml的SPIO-多聚赖氨酸(PLL)复合物进行标记。未标记的BMSC作为对照组。标记后动态观察MSC的形态改变,用台盼蓝染色检测细胞的活力,采用细胞计数(CCK-8)试剂盒检测BMSC增殖能力,普鲁士蓝铁染色证实细胞内铁,台盼蓝染测细胞活力,成脂和成骨诱导检测细胞的分化能力,评价SPIO标记对BMSC增殖和分化能力的影响。SPIO对细胞活力和细胞增殖能力影响的组间比较采用两独立样本的t检验。结果BMSC的SPIO标记阳性率达(97.8 ± 2.1)﹪,标记组和未标记组细胞的活细胞率分别为(94.15 ± 1.56)﹪和(95.63 ± 0.87)﹪,两组差异无统计学意义(t = 2.283,P = 0.205)。SPIO标记细胞的形态、生长增殖能力与未标记细胞相比,1 ~ 7 d标记组细胞增殖率为(96 ~ 98)﹪,未标记组为(92 ~ 96)﹪,两组差异亦无统计学意义(t = 0.172 ~ 0.199,P = 0.679 ~ 0.710)。结论PLL介导SPIO标记BMSC方法简便、效率高,对BMSC的增殖和分化能力无明显影响,可用于BMSC的活体示踪。
骨髓间充质干细胞; 细胞增殖; 细胞分化; 大鼠; 超顺磁性氧化铁
近年来,磁共振成像(magnetic resonance imaging,MRI)等分子影像学技术越来越多地应用于细胞标记后的活体示踪。MRI空间分辨率高,以超顺磁性氧化铁(superparamagnetic iron oxide,SPIO)标记干细胞,是干细胞移植后MRI活体示踪的常用手段。移植前对干细胞进行安全、有效的磁标记,是成功施行干细胞移植和MRI评价的必要前提。本实验旨在探讨转染剂多聚赖氨酸(poly-L-1ysine,PLL)介导SPIO标记骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)的方法和效果,并于体外初步观察其对BMSC的增殖能力、活力以及分化潜能等生物学特性的影响,为干细胞移植的示踪提供实验依据。
材料与方法
一、材料
1.主要试剂:Percol1分离液(瑞典Amershan-Pharmacia公司),α-DMEM培养基(美国Gibco公司),PBS平衡盐溶液、胰蛋白酶-EDTA(美国Sigma公司),胎牛血清(FBS,美国Hyclone公司),SPIO(Resovist,德国Schering公司),PLL(美国Sigma公司)等。
2.主要仪器:超净工作台(苏州净化设备厂),BECKMAN COULTER高速冷冻离心机(美国Beckman公司),CO2培养箱(美国Thermo公司),倒置荧光相差显微镜(日本Nikon公司)等。
3.实验动物:4 ~ 6周龄SD大鼠2只,体质量60 ~ 80 g,雌雄不限,由福建医科大学实验动物中心提供。
二、方法
试验分为SPIO标记BMSC组和非SPIO标记BMSC组,每组设3个复孔。
1. SD大鼠BMSC分离、培养、纯化及形态学观察:参照文献[1]对大鼠BMSC进行分离、培养、纯化。活细胞倒置显微镜观察细胞形态及生长情况,适时拍照,并进行HE染色。
2. SPIO标记BMSC:将第3代含间充质干细胞(mesenchymal stem cell,MSC)的DMEM悬液移入放置有盖玻片的六孔板中,置37℃、5﹪CO2培养箱中孵育3 ~ 4 h待细胞贴壁。将菲立磁与PLL混合,振荡30 min后形成菲立磁复合物。将菲立磁复合物加入到含有MSC的DMEM低糖培养液(含体积分数0.2的胎牛血清+庆大霉素40 U/ml +青霉素40 U/ml)中,培养液中菲立磁-PLL的终浓度25.0 μg/ml。在37℃、5﹪CO2培养箱孵育24 h。
3. SPIO标记BMSC的标记率(普鲁士蓝染色法):MSC以4﹪多聚甲醛室温固定30 min。取出盖玻片,用2﹪亚铁氰化钾-6﹪盐酸染色30 min,Hank液洗涤3次,镜检。加中性红复染2 min,Hank液洗涤3次,再次镜检。标记率计算:普鲁士蓝染色后,低倍镜下,随机观察3个视野,计算蓝染着色的细胞数与镜下细胞总数的比值。标记率=蓝染细胞数/镜下总细胞数×100﹪。
4.台盼蓝染法检测细胞活力:BMSC经0.25﹪胰蛋白酶消化后,制备成单细胞悬液1×106个细胞/ml,取9滴细胞悬液和1滴0.4﹪台盼蓝混匀,在3 min内用细胞计数板分别计数活细胞和死细胞。死细胞被染成淡蓝色,活细胞拒染。活细胞率(﹪)=活细胞总数/(活细胞总数+死细胞总数)。
5. CCK-8试剂盒测定细胞增殖能力:BMSC经0.25﹪胰蛋白酶消化后,制备成单细胞悬液,按1×103个细胞/孔等量接种于96孔培养板,24 h后使用SPIO-PLL复合物标记BMSC,以未标记的BMSC作为对照组,不含细胞的DMEM培养基作为空白对照,1 d后换成普通低糖DMEM培养基,以后每3 d换液。分别于标记后第1、3、5及7 d加入含有10 μl CCK-8液的DMEM培养基110 μl,37℃孵育2 h,用酶标仪检测各孔吸光度,检测波长450 nm,记录不同时间点的吸光度,计算双标记组与对照组的相对吸光度,以反映细胞增殖能力。
6. BMSC多向分化能力鉴定:BMSC以5×103个/cm2密度接种至0.01﹪Ⅰ型胶原包被的24孔板,培养24 h后,使用SPIO-PLL复合物标记BMSC,细胞生长至100﹪时,换为成脂诱导液或成骨诱导液持续培养,每3 d换液,并于诱导2周后进行油红O染色观察成脂诱导,诱导3周后茜素红染色观察成骨诱导情况。
三、统计学分析方法
使用SPSS 13.0统计分析软件,活细胞率和细胞增殖能力的相对光密度值用±s表示,其标记组与非标记组的组间比较采用两独立样本的t检验。以P < 0.05 为差异有统计学意义。
结 果
一、SD大鼠BMSC的分离、培养、纯化及形态学观察
用淋巴细胞分离液对大鼠骨髓作密度梯度离心,可以看到明显的4层,取中间云雾状的白膜层进行培养,主要含单个核细胞,24 h后可见部分细胞贴壁;48 ~ 72 h后贴壁细胞明显增多,逐渐伸长成梭形、多角形,伸出长短不一、粗细不均的胞质突起,核居中,核仁1 ~ 4个,核浆比例大,3 ~ 4 d可见小的集落形成,未贴壁的细胞明显增多在换液中被除去。原代培养中,细胞贴壁生长是以分散的、克隆集落方式增殖。8 ~ 14 d相邻集落融合成片达80﹪以上,呈漩涡状生长,克隆间出现重叠,无接触抑制现象发生,克隆中除了含有小的梭形和大的扁平BMSC外,还有一种有更强折光性的小圆形细胞。传代培养的细胞于2 ~ 4 h开始贴壁,24 h内完全贴壁并伸展生长,形态与原代细胞相似,但增殖速度明显增快,生长5 ~ 7 d细胞达90﹪融合,传代后BMSC呈均匀分布的平均生长,小而圆的细胞随着传代而逐渐减少,第3代以后,细胞形态呈比较均一的成纤维状,大部分呈长梭状,排列规则(图1)。
二、SPIO标记对BMSC生物学特性的影响
1. SPIO标记BMSC的标记率:标记细胞行普鲁士蓝染色观察到MSC细胞质内可见阳性蓝色致密颗粒分布。25.0 μg/ml BMSC的磁化标记有效率为(97.8 ± 2.1)﹪(图2),而未标记的MSC普鲁士监染色未观察到蓝染颗粒,呈阴性。
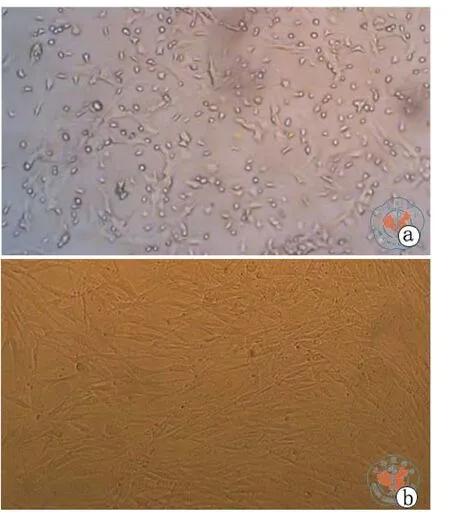
图1 SD大鼠BMSC细胞形态学观察(×100)
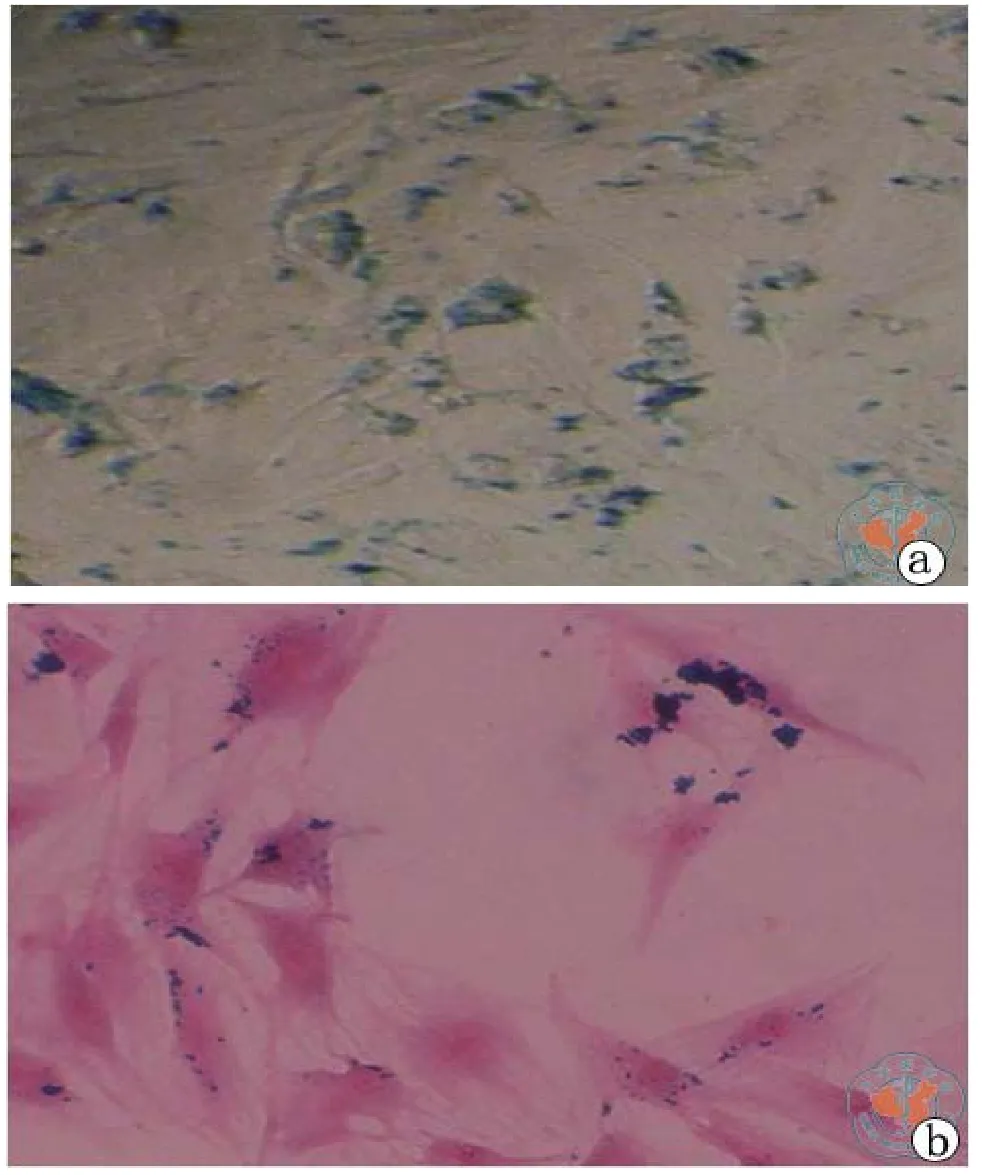
图2 SD大鼠经SPIO标记BMSC细胞质致密颗粒改变
2. SPIO标记后BMSC的细胞活力检测:台盼蓝染法发现标记组和未标记组细胞的活细胞率分别为(94.15 ± 1.56)﹪和(95.63 ± 0.87)﹪,两组差异无统计学意义(t = 2.283,P = 0.205)。
3. BMSC的细胞增殖能力:SPIO标记后第1、3、5、7天结果见表1,标记与未标记组的时间点细胞的相对吸光度比较差异无统计学意义(t = 0.172,P = 0.710,表1)。
表1 各标记时间点SPIO标记BMSC与未标记BMSC的细胞相对吸光度(A,±s)
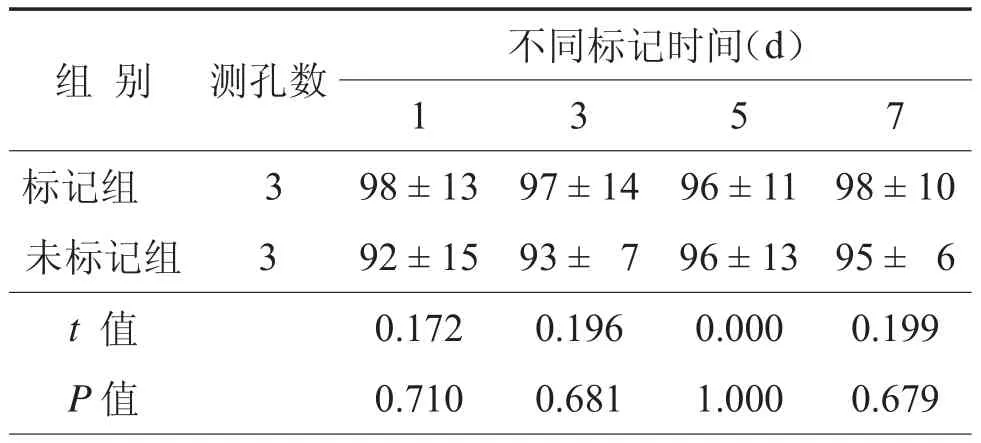
表1 各标记时间点SPIO标记BMSC与未标记BMSC的细胞相对吸光度(A,±s)
注:SPIO为超顺磁性氧化铁;BMSC为骨髓间充质干细胞
组 别 测孔数 不同标记时间(d)1 3 5 7标记组 3 98 ± 13 97 ± 14 96 ± 11 98 ± 10未标记组 3 92 ± 15 93 ± 7 96 ± 13 95 ± 6 t 值 0.172 0.196 0.000 0.199 P 值 0.710 0.681 1.000 0.679
4. BMSC的细胞多向分化能力:SPIO标记后BMSC诱导14 d,细胞内可见大量透明脂滴形成,油红O染色呈大小不等红色小滴,与未标记的BMSC无明显差别。证实SPIO标记不影响BMSC的向脂肪细胞分化潜能(图3)。SPIO标记后BMSC诱导21 d,茜素红染色可见细胞大量橘红色钙盐沉积,部分呈“结节状”,与未标记的BMSC无明显差别。
讨 论
BMSC含量很低,大约每1 ~ 10万个单核细胞中含有1个[2]。因此建立成熟的BMSC体外分离、培养、纯化和扩增的方法,是利用BMSC进行广泛深入的研究和临床应用的基础。本实验联合运用密度梯度离心和贴壁筛选法,用1.073 g/ml的Percol1分离液分离大鼠BMSC,采用α-DMEM培养基进行体外培养,换液时去除不贴壁细胞,有利于获得大量、高纯度的MSC,并最大限度地保持细胞的活性。采用本方法获得的第3代细胞纯度达到97﹪以上,体外仍有很强的增殖能力,为体外大量扩增和临床应用BMSC奠定了基础。
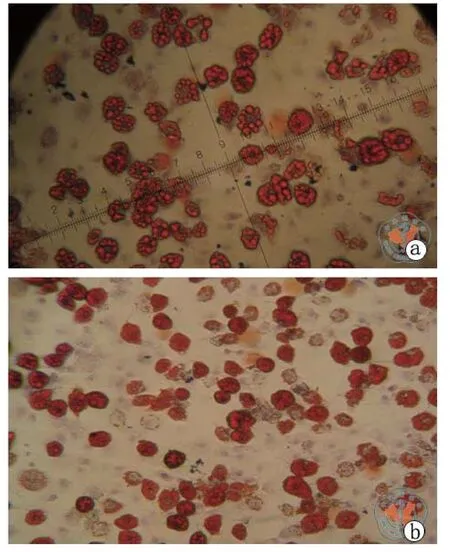
图3 SD大鼠经SPIO标记BMSC油红O染色后细胞内脂滴形成
MRI是利用原子核在磁场内共振产生的信号经重建成像的一种成像技术,具有任意方向直接切层,不受组织深度限制,成像参数多,包含信息量大,而且无创、无射线和空间分辨率高等优点。高分辨率的MRI可以无创性提供精确的解剖信息及生理参数。但是其敏感度还不足以从动物组织中区分出MSC,为了直接可视性观察MSC,采用阳性或阴性造影剂是必须的。目前SPIO标记细胞MRI扫描已经成为一种活体研究细胞迁移轨迹的有用工具[3-6]。
SPIO可以有效地进行BMSC标记,而这种标记方法不会影响细胞的活力、生长、分裂、迁移和分化等生物学功能,对细胞没有毒性,具有良好的安全性[7]。磁性标记干细胞具有无创、可连续进行等优点,已被广泛应用于干细胞移植治疗脑、心肌、肝脏和肾脏损伤的体内示踪研究[8]。SPIO是目前最常用的干细胞标记物,具有以下优势:(1)明显增加MRI检测的敏感性;(2)有多种商用的SPIO试剂如Endorem和Resovist等可供选择[9]。SPIO作为标记物自出现即受到广大研究者的关注,大量有关干细胞的研究均采用了这种标记物。如Hauger等[10]将SPIO标记的MSC静脉输入肾小球损伤的动物体内,取损伤肾组织进行检测,通过普鲁士兰染色、免疫荧光和MRI等方法进行检查都提示阳性。
SPIO转染细胞的方法有直接转染法、脂质体转染法和转染剂介导转染法等。由于正常细胞和SPIO表面均带负电荷,两者亲和力差,细胞难以摄取SPIO,故直接转染法效率极低。脂质体转染法虽然能提高转染的效率,但其操作较繁杂,且对细胞损伤大,故亦较少使用。将SPIO与带正电荷的转染剂结合后能改变细胞表面电荷状况,促进细胞对SPIO的胞吞和胞饮作用可大大地提高细胞的标记效率,因其操作简便而有效,是目前主流的细胞磁标记方法[11]。常用的带正电荷的转染剂中以PLL的使用最为广泛,一般认为20 μg/ml左右的浓度是较适合的转染浓度[12]。本实验将SPIO(终浓度为20 μg/ml)与转染剂PLL(终浓度为0.75 g/ml)混合振摇60 min后再与MSC孵育24 h,即可完成标记工作,转染后普鲁氏蓝染色证实MSC的阳性标记率达(97.8 ± 2.1)﹪,说明该浓度的SPIO和PLL标记MSC具有足够的效率。
本实验发现SPIO在终浓度为25 μg/ml时即可以对BMSC高效进行标记,这一数据也是目前SPIO标记干细胞的常用浓度,在这一浓度下细胞内的SPIO粒子未对BMSC产生明显毒性作用,而且对BMSC的活力、增殖和成脂、成骨分化潜能等一系列生物学特性无明显的负面影响,说明干细胞的SPIO标记是安全而有效的,SPIO终浓度25 μg/ml是安全、合适的标记浓度,可用于干细胞的标记示踪。
综上所述,SPIO对BMSC标记效率高,无明显细胞毒性,对BMSC的增殖和分化能力无明显影响,有望为MRI活体成像示踪移植后BMSC提供技术基础,其活体应用将是本实验进一步研究的方向。
1 卓文利,付云烽,徐廷昭等.大鼠骨髓间充质干细胞的分离培养纯化及生物学特性的鉴定[J]. 医学临床研究, 2009, 26(3):386-389.
2 Delorme B, Chateauvieux S, Charbord P. The concept of mesenchymal stem cells[J]. Regen Med, 2006, 1(4):497-509.
3 Moore A, Josephson L, Bhorade RM, et al. Human transferrin receptor gene as a marker gene for MR imaging[J]. Radiology, 2001, 221(1):244-250.
4 Moore A, Sun PZ, Cory D, et al. MRI of insulitis in autoimmune diabetes [J]. Magn Reson Med, 2002, 47(4):751-758.
5 Moore A, Marecos E, Bogdanov A Jr, et al. Tumoral distribution of long-circulating dextran-coated iron oxide nanoparticles in a rodent model[J]. Radiology, 2000, 214(2):568-574.
6 Lewin M, Carlesso N, Tung CH, et al. Tat peptidederivatized magnetic nanoparticles allow in vivo tracking and recovery of progenitor cells[J]. Nat Biotechnol, 2000, 18(4):410-414.
7 何庚戌,要彤,幺雯,等.超顺磁性氧化铁作为细胞标记试剂的可行性研究[J]. 华北国防医药, 2009, 21(2):9-11.
8 刘宇,邓宇斌,张德胜,等.蛛网膜下腔移植SPIO标记的MSCs在大鼠脊髓损伤模型的MR活体示踪研究[J].中国医学影像技术, 2009, 25(11):1933-1936.
9 Ju S, Teng GJ, Lu H, et al. In vivo MR tracking of mesenchymal stem cells in rat liver after intrasplenic transplantation[J]. Radiology, 2007, 245(1):206-215.
10 Hauger O, Frost EE, van Heeswijk R, et al. MR Evaluation of the glomerular homing of magnetically labeled mesenchymal stem cells in a rat model of nephropathy [J]. Radiology, 2006, 238(1):200-210.
11 陈国东,李丹,许杰华,等.超顺磁性氧化铁标记对大鼠骨髓间充质干细胞生物学特性的影响[J].实用医学杂志, 2009, 25(21):3566-3568.
12 Schafer R, Kehlbach R, Muller M, et a1. Labeling of human mesenchymal stromal cells with superparamagnetic iron oxide leads to a decrease in migration capacity and colony formation ability[J]. Cytotherapy, 2009, 11(1):68-78.
(本文编辑:李少婷)
卓文利,蔡锦全,付云烽,等. 超顺磁性氧化铁标记对大鼠骨髓间充质干细胞增殖和分化能力影响的实验研究[J/CD].中华细胞与干细胞杂志:电子版, 2013, 3(1):2-6.
Proliferation and differentiation potential of rat bone marrow mesenchymal stem cells labeled with superparmagnetic iron oxide
ZHUO Wen-li, CAI Jin-quan, FU Yun-feng, ZHU Rong-cheng, XU Ting-zhao, WU Wei-zheng, YANG Shun-liang, TAN Jian-ming. Urology Department, Organ Transplant Institute, Fuzhou General Hospital, Fuzhou 350025, China
TAN Jian-ming, Email:doctortjm@yahoo.com
ObjectiveTo explore the methods of labeling bone marrow mesenchymal stem cells (BMSC) with superparamagnetic iron oxides (SPIO) and evaluate the influence of SPIO-PLL-labeling on the proliferation and differentiation potential of BMSC.MethodsRat BMSCs were isolated, and cultured-expanded. The third passage BMSCs were labelled with 25.0 μg/ml SPIO-PLL. Cell viability and proliferation were evaluated by the exclusion of CCK-8 and trypan blue dye respectively. The morphologic change of BMSC was observed by inverted phased microscope. Iron uptake via endocytosis was identified by prussian blue staining. The differentiation potential of BMSC toward adipocyte and osteoblast was assessed.ResultsThe percentage of iron-positive cells was (97.8 ± 2.1)﹪ after 24 h incubation with SPIO-PLL. The viability of SPIO-PLL-labelled BMSC and unlabelled BMSC was (94.15 ± 1.56)﹪and (95.63 ± 0.87)﹪ respectively (t = 2.283, P = 0.205). Cell shapes were similar. Cell proliferation rate was similar between the SPIO-PLL-labeled BMSCs and unlabelled MSCs
Bone marrow mesenchymal stem cell; Proliferation; Differentiation;Rats; Labeling superparmagnetic iron oxide
10.3877/cma.j.issn.2095-1221.2013.01.002
福建省科技创新平台建设计划资助项目(2008J1006);福建省科技创新平台建设项目(2010Y2006):福建省青年人才基金(2008F3090);中国博士后科学基金项目(20080441333)
350025 南京军区福州总医院泌尿外科 全军器官移植研究所
谭建明,Email:doctortjm@yahoo.comduring the first week (96 ~ 98)﹪ vs(92 ~ 96) ﹪ ,(t = 0.172 ~ 0.199,P = 0.679 ~ 0.710). Meanwhile, the differentiation capacity was preserved in labeled BMSC. Conclusions Labeling of BMSC with SPIO-PLL is convenient and effective, without any detrimental effects on the proliferation and differentiation of BMSC.
2012-05-12)
