亚微乳处方因素对亲脂性药物细胞处置的影响
2013-12-06孙晓译相志强吕媛媛梁文权
孙晓译,相志强,吴 硕,吕媛媛,梁文权
(1.浙江大学城市学院医学院药学系,浙江杭州 310015;2.浙江大学药学院药物制剂研究所,浙江杭州 310058)
自1961年静脉营养脂肪乳被用于临床以来,由卵磷脂稳定的O/W型亚微乳已作为疏水/脂溶性药物的静脉治疗给药系统[1]。亚微乳具备物理性能稳定、生物相容性好、适于工业化生产等优点,它可以解决疏水性/油状药物的静脉给药问题,还可以通过对乳剂的进一步修饰,达到靶向给药、提高药理活性、减小毒副作用的目的[2]。有关亚微乳表面修饰对药物体内动力学的影响和靶向研究较多[3],细胞层面研究焦点主要集中在如何提高药物的细胞摄取方面[4]。通过上述研究,人们对乳剂成分及表面性质如何影响药物摄取有了基本的认识,但系统地比较制剂因素对亚微乳与细胞间相互作用特别是胞内动力学过程的报道较少。药物在细胞中的累积、传递和排出直接影响药效的发挥和毒副作用的大小,亚微乳可通过携载药物和改变乳滴构成来影响药物在细胞内的上述传递过程。研究亚微乳处方因素对所载药物细胞处置的影响对于处方合理设计和制剂制备至关重要。
本研究选用6-香豆素作为亲脂性药物模型,在以往研究纳米给药系统细胞动力学工作的基础上[5],考察油相成分、表面活性剂种类、表面电荷对亚微乳所载药物细胞摄取和消除动力学的影响,以期了解乳剂组成在乳滴和细胞膜相互作用及胞内处置过程中的作用,为亚微乳给药系统的处方设计和优化提供实验依据。
1 材料与方法
1.1 试剂与材料 6-香豆素、十八酰胺和氯丙嗪均购自美国Sigma-aldrich公司;注射用大豆油、注射用中链油由铁岭北亚药用油有限公司赠送;卵磷脂 Lipoid E-80购自德国 Lipoid公司;叠氮钠和2-去氧葡萄糖购自比利时Acros公司;锥虫蓝购自美国Amresco公司;甘油、橄榄油、吐温、司盘和其它试剂均由华东医药公司提供;细胞裂解液购自美国Promega公司;BCA蛋白定量试剂盒购自江苏碧云天生物技术公司。DMEM高糖培养基、小牛血清、胰酶和青霉素-链霉素双抗(100×)购于美国 Gibco公司。人宫颈癌HeLa细胞系从中国科学院上海生命科学研究院购得。
1.2 6-香豆素亚微乳的制备 将6-香豆素、十八酰胺、司盘类表面活性剂溶于油相(大豆油/橄榄油/中链油),磷脂、甘油及吐温类表面活性剂溶于注射用水后构成水相。油、水两相加热至70℃,高速均质机制成初乳。微射流15000、PSI 5~10个循环制备亚微乳。将乳剂定容后,调节 pH 至7.4,过0.45 μm 滤膜,通氮气灌封。115℃高压灭菌30 min。具体亚微乳处方见表1。
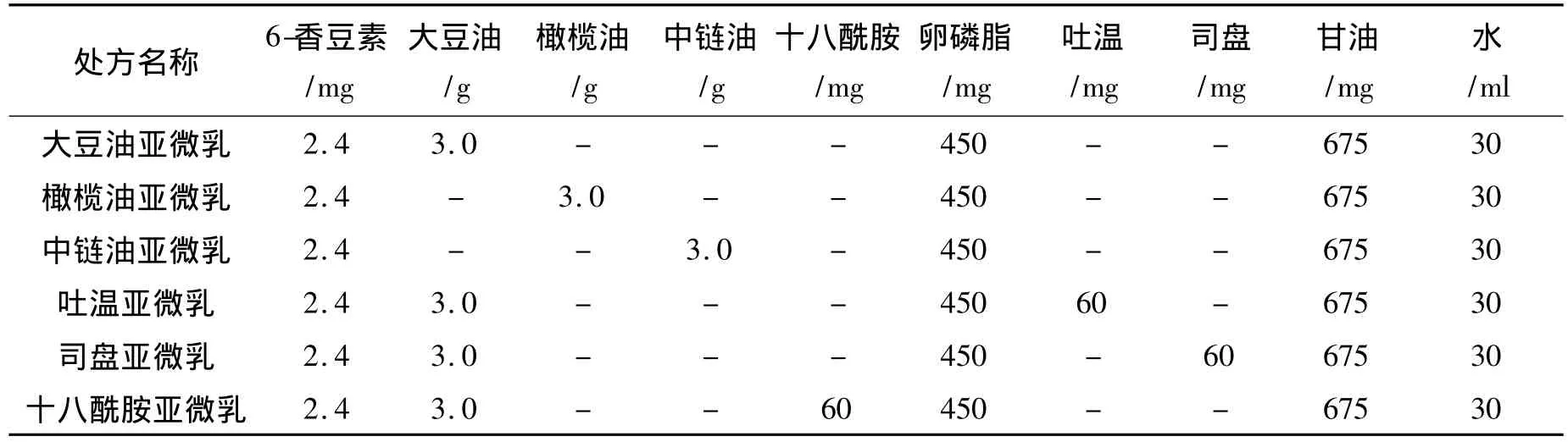
表1 亚微乳处方组成Table 1 Formulations of sub-micro emulsions
1.3 亚微乳表征分析 取亚微乳,用PBS稀释至合适浓度,激光衍射粒度分析仪测定粒径分布和表面电位。透析法(MWCO:14 kDa)测定亚微乳的体外释放。透析液为含0.5%吐温80的PBS。37℃,75次/min振摇条件下,间隔一定时间取样。样品于λex=456 nm和λem=504 nm处测定吸收度,计算6-香豆素浓度。
1.4 细胞摄取以及内吞抑制实验 HeLa细胞(1×105个/孔)接种于24孔培养板,培养过夜后,加入亚微乳使6-香豆素终浓度为1μg/ml。2 h后,吸去培养液,滴入4 mg/ml锥虫蓝后再以PBS洗涤细胞,去除游离荧光。加入200μl细胞裂解液,收集裂解物测定药物浓度(λex=456 nm,λem=504 nm)[6]并根据试剂盒步骤以BCA法测定蛋白含量。胞内药物含量以每微克蛋白含6-香豆素药量表示。摄取动力学实验时加入亚微乳使6-香豆素浓度为100 ng/ml,分别于预定时间点吸去培养液,洗涤细胞、锥虫蓝处理,收集细胞裂解样品用于含量测定。
将1×105细胞接种于24孔板中,过夜贴壁生长后加入内吞抑制剂。各抑制组分别加入50 mmol/L 2-去氧葡萄糖+10 mmol/L叠氮钠、0.45 mol/L 蔗糖和 10μg/ml氯丙嗪预先处理30 min。在抑制剂存在的条件下,加入6-香豆素亚微乳,摄取30 min。按细胞摄取实验相关操作裂解细胞,测定药物含量。
1.5 摄取动力学参数计算 假设在胞外药物浓度为C0的情况下,6-香豆素以一级速率常数k'进入细胞,同时以一级速率常数k消除,C为胞内药物浓度,则其动力学方程可表示为:
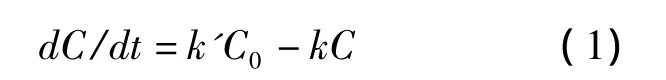
由于在摄取过程中C0几乎恒定,可将k'C0定义为新的复合参数k0,表示在本实验孵育浓度下(100 ng/ml)的细胞摄取速率。根据静脉滴注一室模型,将式(1)进行拉氏变换后得式(2)。使用OriginPro 8软件将摄取数据按(2)式进行非线性回归。细胞内药物稳态浓度C∞根据(3)式计算[7]。
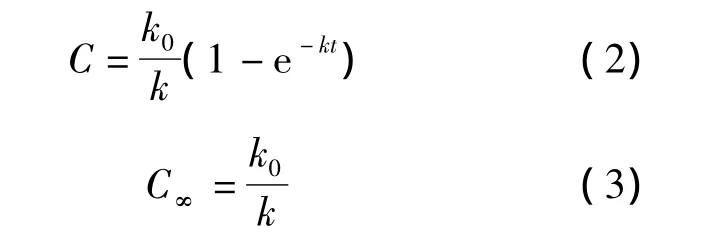
2 结果
2.1 6-香豆素亚微乳的表征 各处方亚微乳粒径控制在180~230 nm。油相种类改变或表面活性剂修饰(吐温或司盘)未对乳滴zeta电位带来显著影响,表面电位-20 mV左右。为观察细胞培养液中血清对乳剂稳定性的影响,我们选用未经修饰的大豆油为油相的亚微乳作为阴离子乳剂代表,与阳离子亚微乳(十八酰胺亚微乳)进行比较,测定了血清孵育前后乳滴粒径和电位变化。结果表明,阴离子乳剂粒径和电位无显著性变化,阳离子乳剂粒径显著增大,电位由正转负(表2)。

表2 6-香豆素阴离子乳剂和阳离子乳剂粒径与电位Table 2 Size and zeta potential of 6-coumarin loaded anionic and cationic sub-micro emulsions
图1是大豆油亚微乳和十八酰胺亚微乳的体外释放曲线。24 h内两种乳剂的释放均未超过20%。阳离子成分的加入不影响乳剂释放行为。
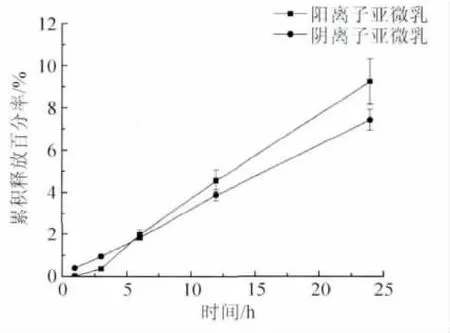
图1 6-香豆素阴离子和阳离子亚微乳体外释放曲线Fig.1 In vitro release of 6-coumarin anionic/cationic sub-micro emulsions
2.2 油相种类对细胞摄取的影响 以常用油相大豆油、中链油和橄榄油分别制备6-香豆素亚微乳,经过2 h的摄取后,各组细胞内6-香豆素含量差异无统计学意义(图2)。
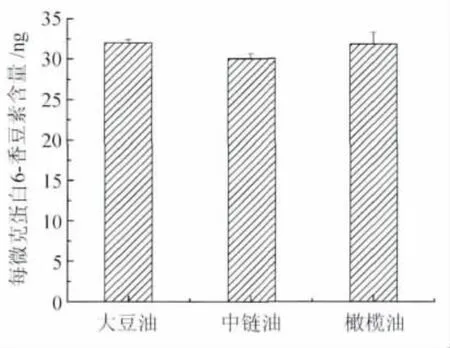
图2 油相种类对胞内6-香豆素含量的影响Fig.2 The effects of oil components on cellular level of 6-coumarin
2.3 表面活性剂修饰对细胞摄取的影响 以不同HLB值(1.8~16.7)的非离子型表面活性剂司盘系列和吐温系列作为辅助乳化剂修饰带负电荷的大豆油亚微乳,观察乳剂表面亲水或疏水特性对细胞摄取的影响。在细胞摄取过程中,未发现由非离子表面活性剂加入造成的细胞毒性。使用吐温20、吐温40、吐温80、吐温85修饰后,胞内6-香豆素水平分别为每微克蛋白含(34.08 ±2.99)、(32.76 ±1.09)、(33.33±2.56)和(36.18 ±2.76)ng 6-香豆素。司盘20、司盘60、司盘80和司盘85修饰的亚微乳细胞数摄取水平分别为:每微克蛋白含(46.09±1.98)、(43.56 ± 0.50)、(40.77 ± 0.14)和(37.84 ±3.71)ng 6-香豆素。与对照组大豆油亚微乳[(38.54 ±0.34)ng/μg蛋白]相比,以相对HLB较低的司盘修饰乳剂可在一定程度上增加细胞的摄取,经司盘20、司盘60和司盘80修饰后,胞内6-香豆素水平显著提高(P <0.05)。其中司盘 20的增效作用最强。但用吐温系列(较高HLB值)修饰的亚微乳细胞摄取与对照相差异无显著性意义,吐温40甚至降低了胞内药物浓度。我们以对照组胞内药物浓度为分母,表面活性剂修饰组胞内6-香豆素浓度为分子,计算各组摄取增效倍数。图3是辅助表面活性剂HLB值与摄取增效倍数之间的关系。
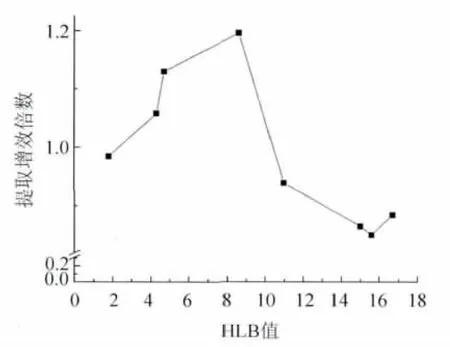
图3 表面活性剂HLB值与细胞摄取增效倍数的关系Fig.3 The relationship between HLB and uptake enhancement rate
2.4 表面电荷对细胞摄取动力学的影响 以十八酰胺修饰后得阳离子亚微乳,其细胞摄取动力学曲线如图4所示。细胞实验条件下,未发现细胞毒性。随时间延长,胞内药物浓度逐渐增加,至1.5 h时摄取达到饱和。阳离子亚微乳组的胞内药物浓度显著高于阴离子乳剂,各个时间点胞内浓度阳离子组约为阴离子组的3倍。
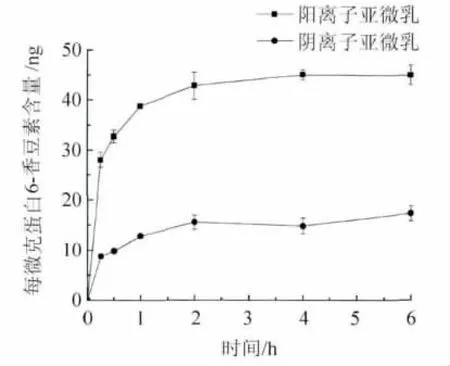
图4 阴离子亚微乳和阳离子亚微乳细胞摄取动力学Fig.4 Cellular uptake kinetics of anionic/cationic sub-micro emulsions
细胞摄取动力学过程经非线性回归后得回归方程,R2均 >0.95,P <0.01。动力学参数(表3)显示阳离子亚微乳组的摄取速率常数(P <0.01)和消除速率常数 k(P <0.05)均显著高于阴离子亚微乳组,胞内药物稳态浓度C∞约为后者的3倍,与实测结果一致。

表3 阴离子亚微乳和阳离子亚微乳6-香豆素摄取及消除动力学参数Table 3 Uptake and elimination kinetic parameters of 6-coumarin delivered by anionic and cationic emulsions
2.5 表面电荷对药物入胞途径的影响 为进一步阐明阳离子亚微乳如何增加细胞摄取的原因,我们使用了能量抑制剂和clathrin依赖的内吞途径抑制剂对阳离子乳剂摄取途径进行了初步考察。结果显示几种抑制剂对阳离子亚微乳的细胞摄取均没有抑制作用,阴离子亚微乳摄取有所降低,见表4。

表4 不同抑制剂对阴离子亚微乳和阳离子亚微乳摄取后胞内6-香豆素水平变化Table 4 The effects of endocytosis inhibitors on anionic/cationic sub-micro emulsions uptake
3 讨论
亚微乳处方因素可影响其与细胞膜的相互作用及后续的胞内处置过程。油相是乳剂重要的构成部分,它为疏水性药物的包载提供了一个亲脂内核。油相种类的差别可直接影响乳剂的物理稳定性[8]。植物油由长链脂肪酸甘油三酯的混合物构成,如大豆油、橄榄油、玉米油、棉籽油等通常单独或混合作为脂肪乳的油相。但有些疏水性药物在长链油中的溶解度不高,于是人们尝试使用中链油来解决载药量的问题。因此,有必要知道油相种类的替换是否会影响乳剂和细胞的相互作用。本研究采用6-香豆素作为亲脂性药物模型(LogP=6.9),代表负载于亚微乳中药物的细胞转运行为。以具不同溶解6-香豆素能力的大豆油(617±6)μg/ml、中链油(990 ±34)μg/ml和橄榄油(873 ±14)μg/ml作为亚微乳油相,考察它们对细胞摄取的影响。结果发现,这三类中性油种类的改变对胞内药物摄取水平无显著影响。
表面活性剂在亚微乳的形成中起重要作用,同时也决定了乳滴表面的物理化学性质。乳剂界面的疏水特性在乳滴与细胞的相互作用中起重要作用。Liu[9]等发现细菌的粘附和吞噬与物体表面疏水性高度相关。Koqa[10]的研究结果也表明,药物的肠道摄取水平与表面活性剂HLB值呈负相关。以亲水性或疏水性的表面活性剂修饰卵磷脂包裹的油滴表面,可能造成界面膜流动性的改变,引起药物在油滴内部和油滴表面的重新分配,影响乳滴与细胞的相互作用。本实验结果显示,药物摄取不完全符合疏水性规律:随HLB值的增高,细胞摄取变少。在司盘系列中,HLB值最高的司盘20细胞摄取最高,而HLB最小的司盘85和对照组的摄取相当。HLB较高的吐温系列不增加胞内药物水平,甚至有所降低。这提示表面适当的疏水特性有利于增加细胞摄取。如果界面疏水性太强可能会阻碍乳滴接近细胞表面。若亲水性太强也对细胞膜吸附和摄取不利,这是司盘增加细胞摄取的主要原因。另外,与吐温相比,司盘可扰乱细胞磷脂双分子层结构,使细胞膜去稳定化,从而促进药物摄取。我们用非离子表面活性剂修饰非病毒类基因载体时,也发现具备合适HLB值的司盘可促进基因的摄取和转染[11]。
亚乳剂组成成分(如表面活性剂HLB值、油相组成)中,电荷对细胞摄取影响最大。十八酰胺是一类常用的阳离子脂质。以其修饰的阳离子乳滴可在生理条件下与带负电荷的细胞膜发生静电作用,从而产生非特异性吸附,增加载体与细胞的接触机会并启动细胞内吞途径[12-13],进而增加药物的细胞摄取。其摄取增效作用是上述讨论的处方因素中最强的。
为进一步明确阳离子亚微乳是通过何途径增加HeLa细胞对6-香豆素的摄取,我们进行了内吞抑制实验。结果显示能量抑制剂和clathrin依赖的内吞途径抑制剂对阳离子亚微乳摄取没有显著抑制作用,阴离子亚微乳摄取有所降低。由于阳离子成分可增加乳滴的细胞膜特异性吸附,且6-香豆素有较强的跨膜能力,因此阳离子乳剂主要通过增加乳滴接触细胞膜机会将6-香豆素分配至细胞中,Xu等[14]在PLGA纳米粒入胞机制研究中也发现了类似现象。阳离子亚微乳的细胞摄取过程中,内吞的百分率可忽略,因此内吞抑制剂对细胞摄取没有显著抑制作用,同时值得注意的是它的消除速率常数大于阴离子组,我们推测这与摄取途径相关。从内吞抑制实验结果可知,阴离子亚微乳近30%胞内药物是通过乳剂的内吞获得的。这个不大的百分率可能会带来后续消除过程中较大的差异。两亲性蛋白对6-香豆素有增溶作用(预实验中测得10%小牛血清可提高6-香豆素溶解度80倍),被内吞入胞的乳滴首先在胞内浓缩的高蛋白环境下释放药物,然后药物再根据浓度梯度扩散回细胞外液,这就比阳离子乳剂组中药物直接从胞内扩散至培养液的速度慢。另外,乳滴的外排也可能是引起阴离子乳剂组消除速率常数小的另一个原因。通过clathrin介导入胞的部分阴离子乳滴会通过胞吐被外排[15],与扩散原理引起的消除过程相比,胞吐是一个能量依赖且速度较慢的过程[16]。而阳离子亚微乳中游离药物以分子形式入胞后直接被外排,导致在细胞消除动力学中阳离子亚微乳的胞内滞留能力稍弱于阴离子组。
综上所述,本研究系统考察了亚微乳处方因素对6-香豆素的细胞摄取和胞内处置过程产生的影响。乳化剂种类可显著影响药物的细胞摄取,以较低HLB值的表面活性剂司盘系列作为表面修饰有助于提高胞内药物水平,其中以司盘20效果最好。阳离子亚微乳通过增加与细胞膜接触的机会,可大幅度增加细胞摄取;但其与阴离子亚微乳相比,药物的细胞滞留时间缩短。以上结果提示我们进行亚微乳处方设计时,可通过选用具备合适HLB值的表面活性剂和调整表面电荷性质,增加细胞摄取及细胞内存留能力。
[1]HIPPALGAONKAR K,MAJUMDAR S,KANSARA V.Injectable lipid emulsions-advancements,opportunities and challenges[J].AAPS Pharm Sci Tech,2010,11(4):1526-1540.
[2]TAMILVANAN S.Formulation of multifunctional oil-in-water nanosized emulsions for active and passive targeting of drugs to otherwise inaccessible internal organs of the human body [J].Int J Pharm,2009,381(1):62-76.
[3]LU Y,QI J,WU W.Absorption,disposition and pharmacokinetics ofnanoemulsions [J].Curr Drug Metab,2012,13(4):396-417.
[4]LEE K C,MATURO C,RODRIGUEZ R,et al.Nanomedicine-nanoemulsion formulation improves safety and efficacy of the anti-cancer drug paclitaxel according to preclinical assessment[J].J Nanosci Nanotechnol,2011,11(8):6642-6656.
[5]SUN X Y,LIANG W Q(孙晓译,梁文权).Comparison on antitumor activity of cisplatin-loaded liposomes and nanoparticles in vitro[J].Journal of Zhejiang University(Medical Sciences)(浙江大学学报:医学版),2011,40(4):408-413.
[6]SUN X Y,LI F,WANG Y,et al.Cellular uptake and elimiantion of lipophilic drug delivered by nanocarriers[J].Pharmazie,2010,65(10):737-742.
[7]CHEN J,SUN X,YU Z,et al.Influence of lipid components on gene delivery by polycation liposomes:Transfection efficiency,intracellular kinetics and in vivo tumor inhibition [J].Int J Pharm,2012,422(1-2):510-515.
[8]HUANG C F,FANG C L,LIAO M H,et al.The effect of oil components on the physicochemical properties and drug delivery of emulsions:tocol emulsion versus lipid emulsion[J].Int J Pharm,2007,335(1-2):193-202.
[9]LIU Y,YANG S F,LI Y,et al.The influence of cell and substratum surface hydrophobicities on microbial attachment[J].J Biotechnol,2004,110(3):251-256.
[10]KOQAK,MURAKAMIM,KAWASHIMAS.Modification of ceftibuten transport by changes in lipid fluidity caused by fatty acid glycerol esters[J].Biol Pharm Bull,1999,22(1):103-106.
[11]HUANG Y Z,GAO J Q,CHEN J L,et al.Cationic liposomes modified with non-ionic surfactants as effective non-viral carrier for gene transfer[J].Colloids Surf B Biointerfaces,2006,49(2):158-164.
[12]GOLDSTEIN D,SADER O,BENITA S.Influence of oil droplet surface charge on the performance of antibody--emulsion conjugates [J].Biomed Pharmacother,2007,61(1):97-103.
[13]KUO Y C,CHEN H H.Effect of electromagnetic field on endocytosis ofcationic solid lipid nanoparticles by human brain-microvascular endothelial cells [J].J Drug Target,2010,18(6):447-456.
[14]XU P,GULLOTTI E,TONG L,et al.Intracellular drug delivery by poly(lactic-co-glycolic acid)nanoparticles,revisited [J].Mol Pharm,2009,6(1):190-201.
[15]PARK J S,HAN T H,LEE K Y,et al.N-acetyl histidine-conjugated glycol chitosan self-assembled nanoparticles for intracytoplasmic delivery of drugs:endocytosis,exocytosis and drug release[J].J Control Release,2006,115(1):37-45.
[16]PANYAM J,LABHASETWAR V.Dynamics of endocytosis and exocytosis of poly(D,L-lactide-coglycolide)nanoparticles in vascular smooth muscle cells[J].Pharm Res,2003,20(2):212-220.
