B7-H4在胰腺癌中的表达及其临床意义
2013-12-06姚航平
洪 波,钱 韵,姚航平
(1.浙江大学医学院附属第二医院病理科,浙江杭州 310009;2.浙江大学医学院附属第二医院临床检验中心,浙江杭州 310009;3.浙江大学医学院附属第一医院传染病诊治国家重点实验室,浙江杭州 310003)
胰腺癌是一种以起病隐匿、生长迅速并早期转移为特征的消化系统恶性肿瘤,是死亡率最高的恶性肿瘤之一,目前尚无有效的治疗措施,其发病率在世界范围内呈逐年上升趋势。由于胰腺组织的解剖位置关系,早期症状不明显且缺乏有效的检测手段,大多数患者就诊时已为中晚期,预后差,5年生存率不足5%[1-2]。早期发现与早期诊断是改善胰腺癌患者预后的有效措施之一。因此,寻找早期诊断、特异性强、灵敏度高的肿瘤分子标记物对于改善胰腺癌患者的预后具有重要的临床意义,同时也能为胰腺癌新型靶向治疗技术提供依据。B7-H4(也称为B7S1或B7x)是新近发现的B7家族成员,能抑制T细胞增殖、细胞因子产生和细胞周期的进行,从而抑制T细胞介导的免疫应答[3-6]。B7-H4在肿瘤免疫应答中起重要作用。B7-H4 mRNA的在脾、肺、胸腺、胎盘、肝、肾等正常组织中均有表达[3],然而,B7-H4蛋白在正常外周组织中几乎没有阳性表达[3],而在一些肿瘤组织中有丰富表达,例如乳腺癌、卵巢癌、肾癌、前列腺癌和非小细胞肺癌[7-12],并与肿瘤进展密切相关。鉴于目前尚无可用于多种方法检测B7-H4表达的抗体出售,本研究以稳定表达B7-H4的3T3-B7-H4细胞为免疫原,制备了能稳定分泌特异性单克隆抗体的杂交瘤细胞株,并对其进行了生物学特性分析。尔后应用免疫组织化学染色检测B7-H4在胰腺癌组织中的表达,探讨B7-H4的表达与胰腺癌临床病理特征之间的关系,分析B7-H4在胰腺癌诊疗及预后判断等方面的潜在价值。
1 材料和方法
1.1 材料 3T3-B7-H4细胞为实验室自行构建[13];SP2/0骨髓瘤细胞株由浙江大学医学院附属第一医院传染病诊治重点实验室保存;Balb/C小鼠由上海西普尔-必凯实验动物有限公司提供;重组人B7-H4蛋白和山羊抗B7-H4多克隆抗体购自美国R&D Systems公司;HRP酶标记山羊抗小鼠IgM抗体购自美国Santa cruz biotechnology公司;HRP酶标记兔抗山羊IgG抗体购自美国KPL公司;细胞培养液DMEM、筛选培养基HAT和HT均购自美国Life Technologies/Gibco®公司;蛋白L抗体纯化柱购自美国Thermo Scientific/Pierce公司;单克隆抗体亚型鉴定试剂盒购自美国Bio-Rad Company/AbD Serotec公司;小鼠IgM同型对照抗体购自美国BD Biosciences公司;其他常规试剂为国产或进口分析纯。免疫组化染色分析胰腺癌及边缘组合芯片(石蜡包埋)购自陕西艾丽娜生物科技有限公司。免疫组化EnVision System试剂盒购自丹麦DAKO公司。
1.2 抗B7-H4单克隆抗体的制备
1.2.1 小鼠免疫 取4~6周龄Balb/C小鼠(5只),用培养的3T3-B7-H4细胞进行腹腔免疫,每只小鼠5×106/次,每2周1次,共5次,最后1次免疫3 d后取免疫小鼠脾细胞。
1.2.2 阳性杂交瘤细胞株的建立 ①细胞融合:按常规方法取免疫小鼠的脾细胞与SP2/0骨髓瘤细胞进行融合[14],用含HAT的完全培养基将融合后的细胞悬浮,并加入适量的饲养细胞(小鼠腹腔巨噬细胞)混匀后分散于96孔板中,于37℃、5% 二氧化碳的培养箱中培养,5 d后用含HAT的完全培养基半量换液。②克隆化培养:选择性培养2周后更换为含HT的完全培养基继续培养。以重组B7-H4蛋白包被ELISA板,采用间接ELISA法检测培养上清液。筛选能分泌目的抗体的杂交瘤细胞,对阳性的杂交瘤细胞进行有限稀释培养,经4次有限稀释后,将细胞扩增到培养瓶中进行扩大培养并冻存。由此,获得了1株分泌抗B7-H4单克隆抗体的杂交瘤细胞株,命名为3E8。细胞株体外连续培养3个月,经间接ELISA检测证实抗体分泌能力稳定。将能稳定分泌3E8单克隆抗体的杂交瘤细胞克隆扩大培养后冻存于液氮中保存。③间接ELISA法:将重组B7-H4蛋白以200 ng/孔包被于酶标板上过夜;PBST洗板5次,将制得的杂交瘤细胞培养上清液做系列稀释,以每个浓度100μl加入各孔中,室温摇床温育2 h;PBST洗板5次,加1∶5000稀释的HRP标记山羊抗鼠二抗,室温摇床温育1 h;PBST洗板5次,加入 TMB显色液100μl/孔,显色5 min;2N 的硫酸终止液50μl/孔,终止反应;置于酶标仪上,测定其在波长450 nm处的吸光度。以未进行细胞培养的培养基和正常小鼠血清为阴性对照。
1.2.3 抗B7-H4单克隆抗体的制备 取6~8周雄性Balb/C小鼠(n=5),每只腹腔注射约2×106个杂交瘤细胞。约7~12 d后当小鼠腹部明显膨胀后收集腹水,10000×g离心10 min取上清液用蛋白L抗体纯化柱纯化分装(质量浓度为1.5 mg/ml)后置于-70℃保存备用。
1.3 抗B7-H4单克隆抗体效价滴定 用重组B7-H4蛋白包被ELISA板,利用间接ELISA法测定单克隆抗体效价,同时以小鼠同型对照抗体为阴性对照。以P/N>2.0的最大稀释度作为抗体效价。
1.4 抗B7-H4单克隆抗体生物学特性鉴定
1.4.1 亚型鉴定 用单克隆抗体亚型鉴定试剂盒分析经无血清培养基培养的单克隆细胞上清液中单克隆抗体的亚型(具体操作祥见说明书)。
1.4.2 特异性鉴定 采用Western blot法和IP法对单克隆抗体特异性进行鉴定。①Western blot法:3T3-B7-H4细胞裂解液和3T3细胞裂解液分别作SDS-PAGE电泳,然后按常规方法转移至PVDF膜上,依次与稀释1000倍的单克隆抗体及HRP标记的山羊抗小鼠IgM反应后ECL曝光,山羊抗B7-H4多克隆抗体为阳性抗体对照。②IP法:350 μg的3T3-B7-H4细胞裂解液和单克隆抗体(2 μg)通过蛋白L共沉淀,3T3细胞裂解液作为阴性对照,小鼠IgM同型对照抗体为抗体对照[14]。Western blot按上述方法进行,依次与山羊抗B7-H4多克隆抗体及HRP标记的兔抗山羊IgG反应后ECL曝光。
1.5 免疫组化染色分析胰腺癌及边缘组合芯片 正常组织来源于癌旁的远端组织(n=25)。胰腺癌组织来源于胰腺癌患者手术切除标本,114例胰腺癌患者年龄31~78岁(平均年龄55.64岁 ±9.56岁),组织学类型均为腺癌;病理学分级为Ⅰ级高分化46例,Ⅱ级中分化48例,Ⅲ级低分化12例,Ⅳ级未分化8例;有淋巴结转移14例,无淋巴结转移100例。组织样本的详细临床病理信息由芯片制造商提供(http://www.alenabio.com)。采用免疫组化EnVision System染色,操作按其说明书进行,用抗B7-H4单克隆抗体为一抗,小鼠IgM同型对照抗体代替一抗作为阴性对照。细胞浆及细胞膜出现棕黄色颗粒状物为B7-H4阳性染色。染色结果判断:阳性细胞数<5%为0分,5% ~10%为1分,>10% ~30%为2分,>30% ~70%为3分,>70%为4分;细胞染色强度:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。根据阳性细胞数与相应染色强度之和判定染色结果:0~1分为阴性,2~7分为阳性,其中6~7 分为过表达[15]。
1.6 统计学处理 研究资料采用u检验分析B7-H4在不同肿瘤组织中的表达以及在肿瘤组织中的表达与各临床病理参数之间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 抗B7-H4单克隆抗体效价滴定结果及亚型鉴定 3E8单克隆抗体的效价高于104(表1),亚型为IgM,轻链为κ型(图1)。
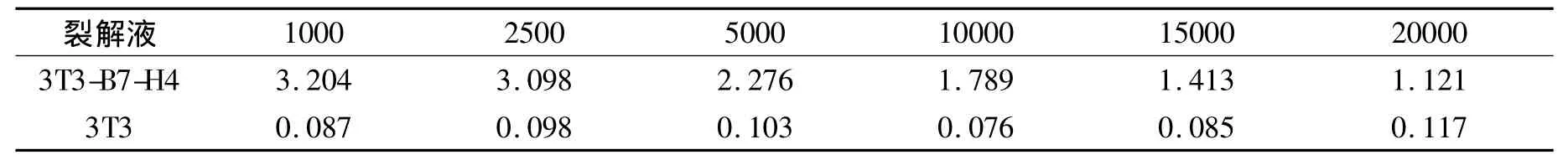
表1 ELISA检测抗B7-H4单克隆抗体效价Table 1 ELISA analysis of anti-B7-H4 mAb

图1 小鼠抗B7-H4单克隆抗体的亚型Fig.1 The isotype of anti-B7-H4 of mouse monoclonal antibody
2.2 抗B7-H4单克隆抗体生物学特性鉴定
2.2.1 稳定性鉴定 杂交瘤细胞株体外连续传代10代冻存于液氮中,复苏后其上清液效价保持稳定,表明杂交瘤细胞能稳定分泌单克隆抗体。
2.2.2 特异性鉴定 3E8单克隆抗体与相对分子质量约28 kD和57 kD大小的蛋白发生免疫反应(图2A),与羊抗B7-H4多克隆抗体显示的条带一致(图2B)。IP法检测单克隆抗体与天然的B7-H4的结合活性。图2C中可以看出,3E8单克隆抗体能特异地与3T3-B7-H4细胞裂解液中的B7-H4结合,与阴性对照3T3细胞裂解液无任何反应。

图2 抗B7-H4单克隆抗体的Western blot和IP鉴定Fig.2 3E8 mAb was detected by Western blot and IP analysis
2.3 B7-H4在胰腺癌组织中的表达 免疫组化检测胰腺癌组织中B7-H4的表达,结果显示,肿瘤组织中B7-H4呈弥漫性表达于胞浆和胞膜(图3)。经检测胰腺癌组织中B7-H4平均染色积分为4.00±1.44,癌旁的正常组织中仅有少量表达或不表达,平均染色积分为1.12±0.78,胰腺癌组织中B7-H4染色积分显著高于正常组织(P <0.01)。
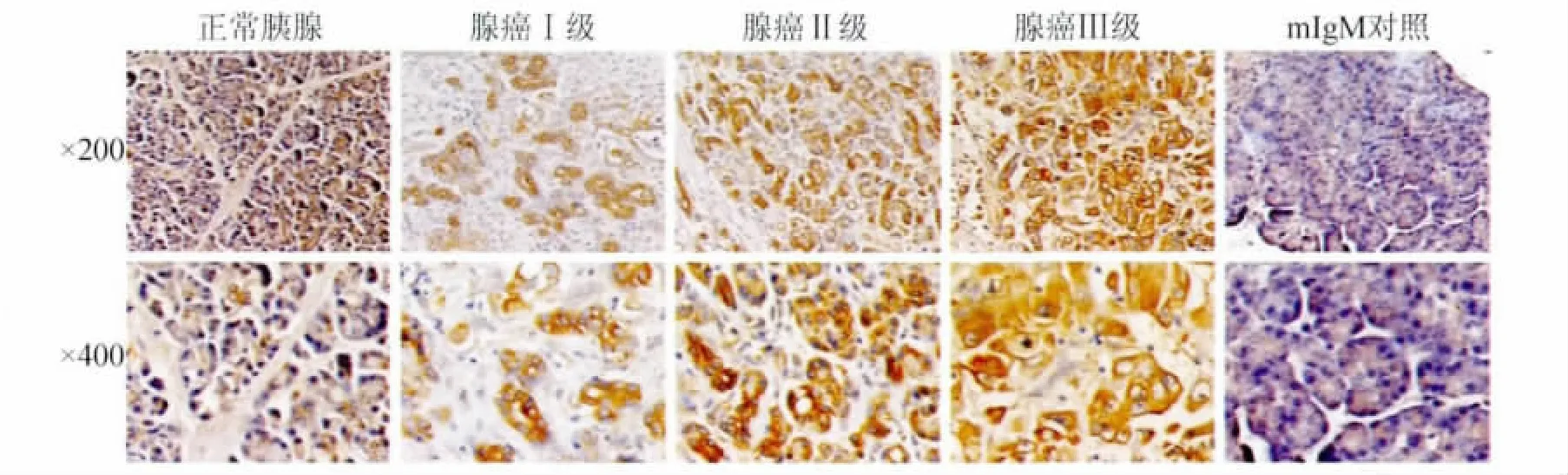
图3 B7-H4在胰腺癌组织中的表达(EnVision二步法)Fig.3 Expression of B7-H4 in pancreatic cancer tissue
2.4 胰腺癌组织中B7-H4的表达与临床病理特征的关系 B7-H4在胰腺癌组织中表达水平与患者肿瘤病理分级有关,Ⅲ-Ⅳ级低分化组织的染色积分(6.10±0.72)显著高于Ⅰ-Ⅱ级中低分化组织(3.55 ±1.12,P <0.01)。有淋巴结转移的胰腺癌组织染色积分为6.14±0.66,显著高于没有淋巴结转移的胰腺癌组织染色积分(3.70 ±1.25,P <0.01)。B7-H4 在胰腺癌组织中表达水平与患者年龄[31~55岁与56~80岁年龄段分别(3.98 ±1.41)与(4.02 ±1.49)]、性别[男性与女性分别(3.90 ±1.42)与(4.16 ±1.48)]无明显关联(均 P >0.05)。
3 讨论
胰腺癌以生长迅速并早期发生转移为特征,其病因及发病机制至今不明。肿瘤免疫学和分子免疫学研究的不断进步使肿瘤的免疫发病机制日益受到重视,成为全球生物医学工作者研究的热点。大量研究发现,B7-H4能抑制CD4+和CD8+的T细胞活化、增殖和 IL-2、IL-4、IL-10及IFN-γ等细胞因子的分泌,阻断细胞周期使细胞停滞于G0/G1期,抑制CD8+CTL的增殖和成熟,从而负向调控T细胞介导的免疫反应[3,5-6],且 B7-H4 在肿瘤组织的表达与肿瘤浸润性T细胞的数量负相关,推测B7-H4负向调控抗肿瘤免疫应答在促进肿瘤进展中起重要作用[7-8,16]。最近研究表明,B7-H4 的异常表达和激活在上皮细胞恶性转变和肿瘤的发生发展过程中起重要作用[7]。因此,我们推测,B7-H4作为负向免疫调控因子,可能在胰腺癌组织中异常表达,并参与胰腺癌的发病及进展。
本课题首先试图建立一种方便的B7-H4检测方法。B7-H4是一种非常保守的抗原,人和小鼠的B7-H4基因序列同源性达到90%以上。它由282个氨基酸组成,蛋白分子结构由1个信号序列、1个功能区及1个含羟基末端的跨膜功能区组成,其最显著的特征是细胞质区仅含有2个氨基酸残基。B7-H4与其他B7家族成员一样,在胞外区存在一个Ig样的结构域,但缺乏明显的跨膜区[3,5-6]。利用 B7-H4的这一特性,我们制备了特异性抗B7-H4的鼠源单克隆抗体3E8。经Western blot和IP证实该单克隆抗体能识别天然或变性的B7-H4,为下一步研究B7-H4在胰腺癌的表达及功能并建立相关诊断学方法奠定基础。
研究发现,B7-H4在乳腺癌[8]、卵巢癌[17-18]、子宫内膜癌[17]、肾细胞癌[10]以及非小细胞肺癌[12]中都有过度表达。Awadallah等[19]研究发现,B7-H4可能成为胰腺癌诊断及预后的新标记。本研究结果显示,应用自行制备的抗B7-H4单克隆抗体检测,B7-H4在胰腺癌组织中呈弥漫性高表达,而在正常组织中不表达或弱表达,肿瘤组织中表达强度显著高于正常组织,且低分化及未分化胰腺癌组织中的B7-H4表达水平显著高于高、中分化胰腺癌组织,并在有淋巴结转移患者的胰腺癌组织中表达显著增强。B7-H4的异常表达提示B7-H4可能是一种潜在的胰腺癌病理标志,参与肿瘤的发生和进展,阻断B7-H4与其受体的相互作用,有望成为肿瘤生物治疗的潜在靶点[20-22]。
虽然B7-H4在胰腺癌的发生、发展中具体作用机制尚不十分明确,但它与胰腺癌的进展密切相关,作为胰腺癌患者治疗的潜在靶位已逐渐受到关注。B7-H4在胰腺癌弥漫性高表达的特征为胰腺癌诊断预后和靶向治疗提供了新策略;本实验制备的能稳定分泌特异性单克隆抗体的杂交瘤细胞株为进一步研究B7-H4的生物学功能及建立相关诊断学方法奠定基础。
[1]HEZEL A F,KIMMELMAN A C,STANGER B Z,et al.Genetics and biology ofpancreatic ductal adenocarcinoma[J].Genes Dev,2006,20(10):1218-1249.
[2]JEMAL A,SIEGEL R,WARD E,et al.Cancer statistics[J].CA Cancer J Clin,2008,58(2):71-96.
[3]SICA G L,CHOI I H,ZHU G,et al.B7-H4,a molecule of the B7 family,negatively regulates T cell immunity[J].Immunity,2003,18(6):849-861.
[4]CHEN L.Co-inhibitory molecules of the B7-CD28 family in the control of T cell immunity[J].Nature Rev Immunol,2004,4(5):336-347.
[5]ZANG X,LOKE P,KIM J,et al.B7x:a widely expressed B7 family member that inhibits T cell activation[J].Proc Natl Acad Sci USA,2003,100(18):10388-10392.
[6]PRASAD D V R,RICHARDS S,MAI X M,et al.B7S1,a novel B7 family member that negatively regulates T cell activation[J].Immunity,2003,18(6):863-873.
[7]SALCEDA S,TANG T,KMET M,et al.The immunomodulatory protein B7-H4 is overexpressed in breastand ovarian cancers and promotes epithelial cell transformation [J].Exp Cell Res,2005,306(1):128-141.
[8]TRINGLER B,ZHUO S,PILKINGTON G,et al.B7-h4 is highly expressed in ductal and lobular breast cancer[J].Clin Cancer Res,2005,11(5):1842-1848.
[9]CHOI I H,ZHU G,SICA G L,et al.Genomic organization and expression analysis of B7-H4,an immune inhibitory molecule of the B7 family[J].J Immunol,2003,171(9):4650-4654.
[10]KRAMBECK A E,THOMPSON R H,DONG H,et al.B7-H4 expression in renal cell carcinoma and tumor vasculature:associations with cancer progression and survival[J].Proc Nati Acad Sci U S A,2006,103(27):10391-10396.
[11]ZANG X,THOMPSON R H,AL-AHMADIE H A,et al.B7-H3 and B7x are highly expressed in human prostate cancer and associated with disease spread and poor outcome[J].Proc Natl Acad Sci U S A,2007,104(49):19458-19463.
[12]SUN Y,WANG Y,ZHAO J,et al.B7-H3 and B7-H4 expression in non-small-cell lung cancer[J].Lung Cancer,2006,53(2):143-151.
[13]QIAN Y,SHEN L,CHENG L F,et al.B7-H4 expression in various tumors determined using a novel developed monoclonal antibody [J].Clin Exp Med,2011,11(3):163-170.
[14]YAO H P,LUO Y L,FENG L,et al.Agonistic monoclonal antibodies potentiate tumorigenic and invasive activities of splicing variant of the RON receptor tyrosine kinase [J].Cancer Biol Ther,2006,5(9):1179-1186.
[15]ALLRED D C,HARVEY J M,BERARDO M,et al.Prognostic and predictive factors in breast cancer by immunohistochemical analysis [J].Mod Pathol,1998,11(2):155-168.
[16]MUGLER K C,SINGH M,TRINGLER B,et al.B7-h4 expression in a range of breast pathology:correlation with tumor T-cell infiltration[J].Appl Immunohistochem Mol Morphol,2007,15(4):363-370.
[17]MIYATAKE T,TRINGLER B,LIU W,et al.B7-H4 is overexpressed in high risk uterine endometrioid adenocareinomas and inversely corelated with tumorT-cellinfiltration [J].Gynecol Oncol,2007,106(1):119-127.
[18]TRINGLER B,LIU W,CORRAL L,et al.B7-H4 overexpression in ovarian tumors[J].Gynecol Oncol,2006,100(1):44-52.
[19]AWADALLAH N S,SHROYER K R,LANGER D A,et al.Detection of B7-H4 and p53 in pancreatic cancer:potential role as a cytological diagnostic adjunct[J].Pancreas,2008,36(2):200-206.
[20]CHENG L,JIANG J,GAO R,et al.B7-H4 expression promotes tumorigenesis in ovarian cancer[J].Int J Gynecol Cancer,2009,19(9):1481-1486.
[21]JIANG J,ZHU Y,WU C,et al.Tumor expression ofB7-H4 predicts poorsurvivalofpatients suffering from gastric cancer [J].Cancer Immunol Immunother,2010,59(11):1707-1714.
[22]PARK G B,SONG H,KIM Y S,et al.Cell cycle arrestinduced byengagementofB7-H4 on Epstein-Barr virus-positive B-cell lymphoma cell lines[J].Immunology,2009,128(3):360-368.
