木犀草素对人肝癌细胞HepG2的促凋亡作用
2013-12-06王远鹏龚兴国
王远鹏,周 亮,龚兴国
(浙江大学生命科学学院生物化学所,浙江杭州 310058)
木犀草素(Luteolin)是一种天然多酚化合物,化学名为 3',4',5,7-四羟基黄酮,广泛分布于竹、落花生、金银花等植物中。已有研究表明,木犀草素具有抗感染、抗病毒、抗氧化等多项功能[1-3]。而木犀草素的抗肿瘤功能更是近年来的研究热点,文献报道木犀草素对多种肿瘤细胞的增殖具有不同程度的抑制作用,其机制包括阻滞细胞周期、诱导细胞凋亡、抑制血管生成以及敏化细胞凋亡等[4-7]。
活性氧(reactive oxygen species)是生物在代谢过程中产生的高活性的含氧自由基或分子,广泛存在于各类细胞中,并在细胞生长相关的信号传导通路中起重要作用。活性氧通过细胞内的多条信号通路,调节细胞内各种转录因子的水平与酶的活力,进而调节细胞的基因表达水平,最终导致细胞的生长、衰老、凋亡[8]。近年来很多研究表明,细胞内高活性的含氧自由基与癌细胞的发生有密切关系,癌细胞中的活性氧水平普遍高于普通细胞,这与肿瘤细胞受到外界的刺激、自身代谢率高以及线粒体失活有关[9]。高水平的活性氧会造成DNA损伤,促使基因突变,导致肿瘤细胞生长加快,对药物耐受性增强。已有研究证实,一些化学药物或抗氧化酶能通过清除细胞内过高的活性氧来抑制肿瘤生长[10-11]。因此从理论上讲,作为一种有效的抗氧化剂,木犀草素能够清除肿瘤细胞内过多的活性氧,改变细胞的氧化状态,调节某些细胞信号通路,进而抑制肿瘤细胞增殖并诱导其凋亡。
本研究利用MTT法检测了木犀草素对肿瘤细胞体外抗增殖作用,以FITC/PI双染实验检测了木犀草素对HepG2细胞的促凋亡作用,同时利用流式细胞术测定了木犀草素作用下HepG2细胞氧化压力的变化,并利用Western blot分析了木犀草素对HepG2细胞内相关信号通路的影响,旨在为木犀草素在癌症治疗领域的应用提供新的实验依据。
1 材料与方法
1.1 材料、试剂与仪器 LO2人正常肝细胞、HepG2人肝癌细胞、HL60白血病细胞、A549肺腺癌细胞等为本实验室保存。
木犀草素由浙江工业大学提供,四甲基唑氮蓝MTT、二甲基亚砜DMSO购于美国Sigma公司,NDA、DHE购自英国 Molecular Probe公司,胎牛血清与RPMI 1640培养液(含双抗,Gibico原装干粉配制,0.1 μm 无菌滤膜过滤,无支原体)购于杭州四季青生物工程公司;胰蛋白酶(含0.5 mmol EDTA,Gibico原装干粉配制)和PBS(Gibico原装干粉配制)均购于杭州吉诺生物技术公司;相关抗体购于美国Cell Signaling Technology公司。其它试剂无特殊标示均为国产分析纯试剂。
Bio-RAD Model 550 MICROPLATE READER酶标仪购于美国BIO-RAD公司,细胞培养箱购于美国Forma Scientific公司,倒置显微镜BDS200/200-PH购于重庆奥特显微镜厂,T18 basic细胞破碎仪购于德国IKA集团,FACSCalibur流式细胞仪购于美国BD公司,24孔平底细胞培养板购于美国sigma公司,96孔细胞培养板购于美国Corning公司。
1.2 细胞培养 细胞培养使用包含10%胎牛血清、100 U/ml青霉素与100 U/ml链霉素的RPMI 1640培养液。将培养液置于饱和湿度下含5% 二氧化碳的细胞培养箱中37℃培养。每日早晚两次观察细胞生长情况,当培养液颜色逐渐变黄时更换新鲜培养基,待细胞长满细胞瓶时,离心收集细胞,并按1∶2~1∶4的传代比例接种与新的细胞培养瓶中培养。
1.3 细胞生长抑制检测 采用MTT法检测木犀草素作用下各种肿瘤细胞与LO2细胞的生长变化。取1640培养液中处于对数生长期的细胞,按照1×105/ml的浓度接种到96孔板中(每孔接入100μl),培养12 h。各孔中分别加入不同质量浓度的木犀草素(2.5μg/ml、10μg/ml、20μg/ml),以 DMSO(未加药)作用的细胞为对照,每个药物浓度设置3个复孔。培养24 h后,吸去孔中的培养液,加入MTT溶液(PBS 配置,0.5 mg/ml,100μl/孔)置于 37℃下避光孵育4 h。吸去溶液,每孔加入 150μl DMSO以溶解甲臜沉淀。使用酶标仪在490 nm波长下,测定各孔的吸光度值,并根据吸光度值计算肿瘤细胞的存活率(细胞存活率=实验吸光度值/对照吸光度值×100%)。同样方法计算48 h和72 h的细胞存活率。
1.4 细胞氧化压力测定 使用流式细胞术(Flow CytoMeter,FCM)检测木犀草素作用后HepG2细胞内活性氧的变化情况。将HepG2细胞稀释重悬后接种到24孔板中(每孔接入100μl),培养 12 h。加入梯度浓度(2.5μg/ml、10μg/ml、20μg/ml)的木犀草素,以 DMSO(未加药)作用的细胞为对照,每个药物浓度设置3个平行孔。药物作用一定时间(6 h或12 h)后吸去培养液并洗去药物,分别加入DHE(检测细胞内活性氧水平)至终浓度为10 μmol/L,置于37℃避光孵育30 min。离心收集细胞并重悬于PBS,用流式细胞仪检测荧光强度。其中激发光波长为488 nm,DHR的发射波长为564~606 nm。
1.5 细胞凋亡检测 通过Annexin V-FITC/PI双染法利用流式细胞术检测木犀草素作用下HepG2细胞的凋亡情况。将肿瘤细胞按照1×105/ml的浓度接种到96孔板中(每孔接入100μl),培养12 h后加入梯度质量浓度的木犀草素(2.5μg/ml、10μg/ml、20μg/ml),以 DMSO(未加药)作用的细胞为对照,每个药物浓度设置3个平行孔。药物作用24 h后用预冷的PBS清洗细胞两次,用结合液重悬细胞并加入Annexin V–FITC避光孵育10 min,离心沉淀细胞后用结合液重悬,并加入PI冰上避光孵育5 min,用流式细胞仪检测细胞凋亡率。
1.6 相关信号通路蛋白分析 利用Western blot分析木犀草素作用下HepG2细胞内相关蛋白表达水平的变化。以对β-actin蛋白的分析为例,将HepG2细胞稀释重悬后接种到6孔板中(每孔接入1 ml),培养12 h。各孔中分别加入不同质量浓度的木犀草素(2.5μg/ml、10μg/ml、20μg/ml),以 DMSO(未加药)作用的细胞为对照,每个药物浓度设置3个复孔。作用6 h后收集处理细胞,通过Western blot分析相关蛋白表达水平的变化,其中actin抗体稀释比例为1∶3000,p53 抗体稀释比例为1∶3000,ASPP2抗体稀释比例为1∶3000,iASPP抗体稀释比例为1∶3000。并以同样方法检测药物作用梯度时间后相关蛋白的变化。
2 结果
2.1 木犀草素对肿瘤细胞的生长抑制作用
在木犀草素作用24 h、48 h、72 h时,HepG2细胞的 50%抑制浓度(IC50)分别为 25.62μg/ml、18.43μg/ml、9.06μg/ml,A549 细胞的 IC50分别为 30.60μg/ml、21.39μg/ml、9.59μg/ml,HL60 细 胞 的 IC50分 别 为 60.12μg/ml、23.32μg/ml、15.75μg/ml,而 LO2 细胞相应的IC50分别为 119.7μg/ml、68.86μg/ml、62.47μg/ml。经单因素方差分析,所有抑制作用均具有浓度依赖性(HepG2、A549、HL60、LO2 趋势检 验 F 值 分 别 为 109.1、327.7、397.7、90.37,均 P < 0.01)与时间依赖性(HepG2、A549、HL60、LO2 趋势检验 F 值分别为 72.35、110.3、213.4、316.9,均 P <0.0001),如图 1 所示。提示木犀草素对多种肿瘤细胞均具有明显的生长抑制作用,同时对LO2细胞也具有轻微毒性。本研究选取HepG2细胞进行后续实验。
2.2 木犀草素对肿瘤细胞氧化压力的影响
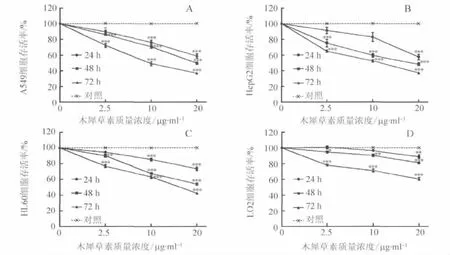
图1 木犀草素对3种肿瘤细胞及LO2细胞的生长抑制作用Fig.1 The inhibition of luteolin to 3 cancer cells and LO2 cells
木犀草素作用6 h、12 h时,HepG2细胞内活性氧水平均随着药物浓度的增加而下降,且两者均具有浓度依赖性(6 h、12 h趋势检验F值分别为35.76、396.3,均 P <0.0001),见图 2。其中,20μg/ml药物作用12 h后,活性氧水平降低了(41.11±0.92)%,与相同作用时间下10μg/ml药物相比无明显变化(Tukey检验,P>0.05)。提示木犀草素浓度达到一定水平后,细胞内氧化压力达到平衡状态。对药物作用6 h后活性氧水平的变化与相应浓度作用下HepG2细胞存活率进行相关性检验,发现两者明显正相关(r=0.985,P=0.015)。
2.3 木犀草素促进肿瘤细胞凋亡的作用 木犀草素作用HepG2细胞24 h后,随着木犀草素浓度的增加,凋亡早期细胞(Annexin V+/PI-)和坏死细胞(Annexin V+/PI+)比例上升,且两者均具有浓度依赖性(F值分别为 58.17、47.96,P <0.0001);20μg/ml药物作用 HepG2细胞24 h后,凋亡和坏死的细胞比例总计达到(14.43 ±1.66)%,见图3。提示木犀草素能够有效诱导HepG2细胞凋亡。
2.4 木犀草素对相关信号通路蛋白的影响
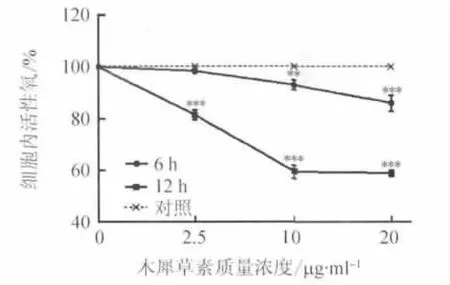
图2 木犀草素作用后HepG2细胞内活性氧变化Fig.2 The change of ROS in HepG2 after treatment with luteolin
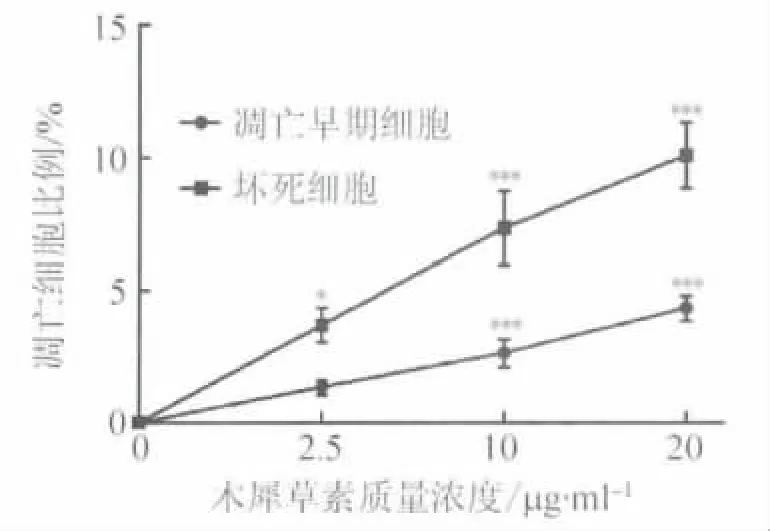
图3 木犀草素作用24 h后HepG2细胞凋亡比例Fig.3 The rate of apoptotic HepG2 after treatment with luteolin for 24 h
在不同浓度木犀草素作用下,ASPP家族蛋白表达量变化如图4、表1所示,木犀草素不同作用时间后ASPP家族蛋白表达变化则如表2、图5所示。木犀草素能够降低HepG2细胞内的iASPP水平,并上调p53与ASPP2水平;所有相关蛋白表达水平的变化均具有明显的剂量依赖性(p53、ASPP2、iASPP表达量趋势性检验F值分别为 52.37、25.92、13.31,P < 0.01)和时间依赖性(p53、ASPP2、iASPP表达量趋势性检验F 值分别为 8.37、11.29、19.87,P <0.01)。对ASPP家族蛋白表达水平分别与相应浓度药物作用下的HepG2细胞存活率以及细胞凋亡坏死率进行相关性分析,发现p53、ASPP2、iASPP表达量与细胞存活率相关系数分别为-0.995、-0.992、0.902,与细胞凋亡坏死率相关系数分别为 0.931、0.928、-0.983,均 P < 0.01,提示木犀草素对肿瘤细胞的抑制作用与其对ASPP家族蛋白表达水平的调控有关。
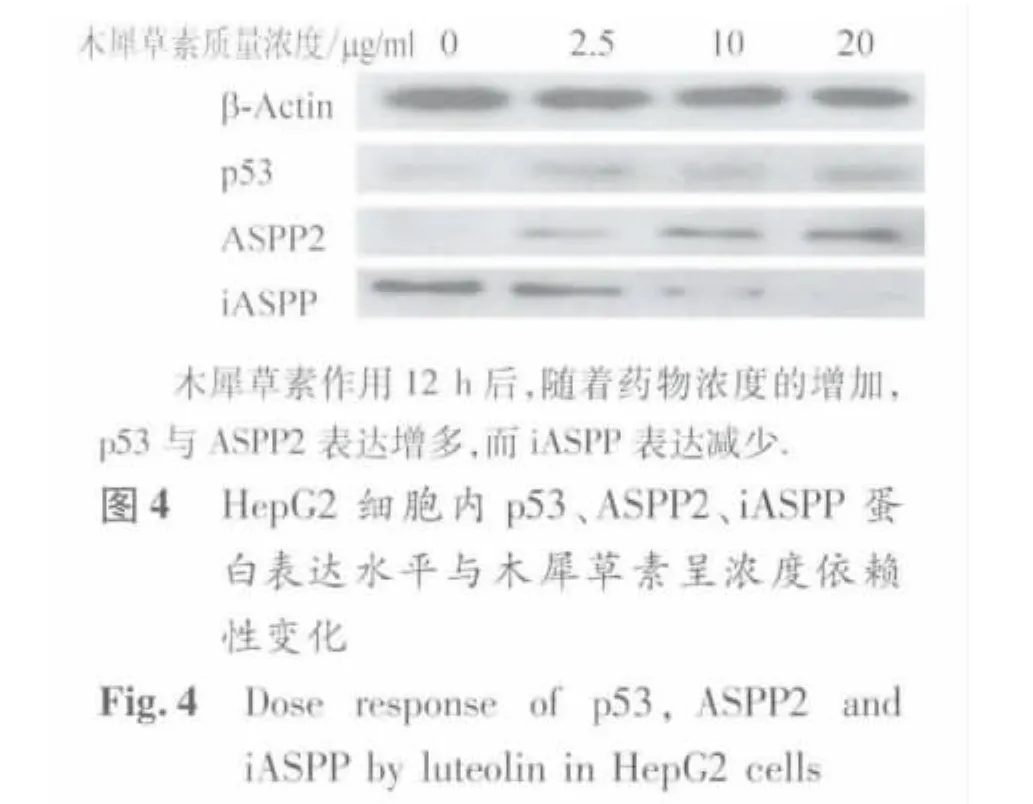
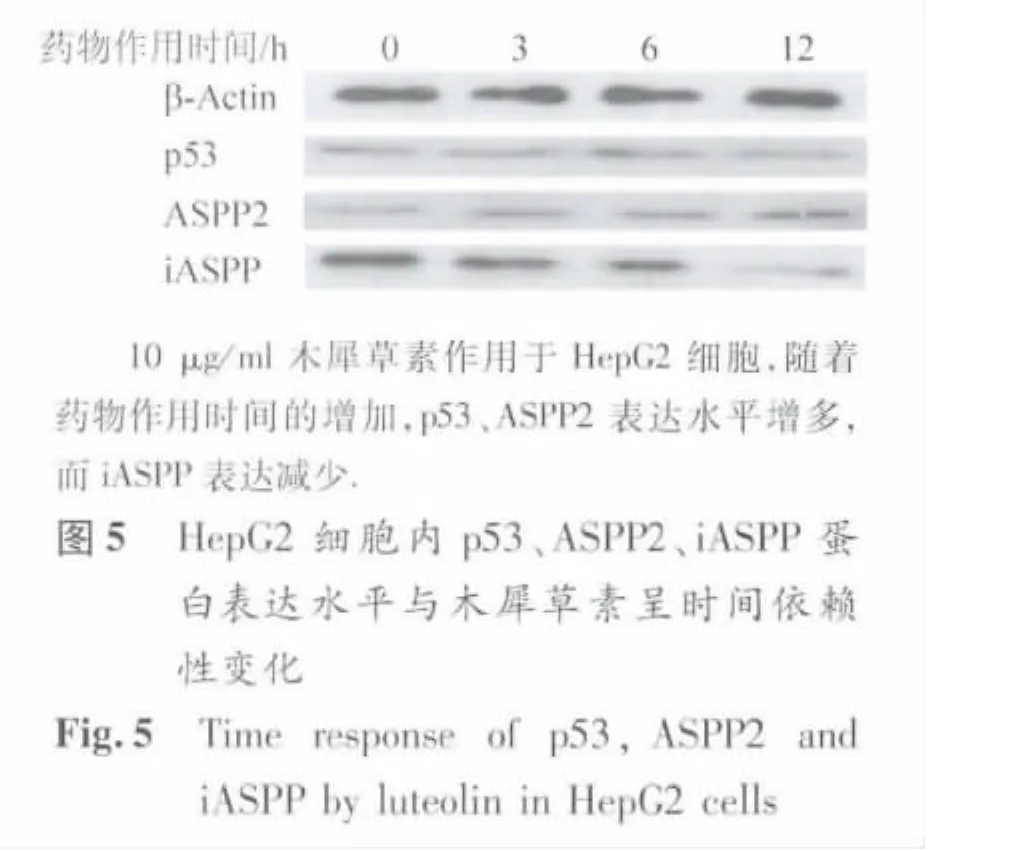

表1 药物不同浓度作用下相关蛋白的相对表达量Table 1 Dose response of the relative expression for related pathway proteins

表2 药物不同作用时间后相关蛋白的相对表达量Table 2 Time response of the relative expression for related pathway proteins
3 讨论
肿瘤细胞由于受到外界的刺激、自身代谢率高以及线粒体失活等原因,其细胞内活性氧水平普遍高于普通细胞。高浓度的活性氧增强了其对药物的耐受性,也是肿瘤细胞具有异常生长能力的原因之一。有研究猜测细胞内可能存在一个确保细胞基本功能的活性氧水平底限,在正常细胞中活性氧只微微高于这一水平;而肿瘤细胞内的活性氧水平远远高于这一水平[12]。同时有报道表明活性氧能够与某些细胞因子相互作用,从而参与一些信号传递过程,如 NF-κB、p53、JNK、Akt等[13]。因此,通过清除细胞内过量的活性氧来抑制肿瘤生长也成为肿瘤治疗领域的一个研究热点。目前已有大量文献报道木犀草素抗肿瘤细胞增殖、促肿瘤细胞凋亡的功能,此前研究指出木犀草素可以抑制蛋白激酶 C的活性[14],激活 JNK信号通路[15],对 MAPK/ERKS 和 PI3K-Akt信号通路也有影响[16]。在本研究中,我们验证了木犀草素对多种肿瘤细胞的生长具有浓度依赖的抑制作用,同时对HepG2细胞内氧化压力的检测结果表明其活性氧水平明显下降,相关性分析表明木犀草素抑制肿瘤细胞生长的作用可能与其能清除胞内过量的活性氧有关[17]。
而药物阻滞肿瘤细胞生长的同时很有可能也能诱导细胞凋亡。我们通过annexin VFITC/PI双染法对木犀草素作用后的HepG2细胞状态进行检测,结果表明处于凋亡早期的细胞比例显著上升(具有浓度依赖性),证明木犀草素能够有效诱导HepG2细胞凋亡。同时细胞内氧化压力的变化与p53通路相关的细胞程序性死亡有密切关系;此前也有报道显示木犀草素能够阻滞HepG2细胞的生长周期[4],并抑制HepG2细胞内的Akt磷酸化[14],而细胞周期阻滞、Akt通路与p53之间关系也非常密切。p53可以抑制Akt的活化;Akt则可以通过稳定Mdm2促进p53的降解,两者通过这样的方式互相抑制。而对ASPP家族蛋白表达水平与细胞凋亡率的相关性分析也说明木犀草素促肿瘤细胞凋亡的功能很有可能与p53通路有关。
p53基因是一种与人类肿瘤高度相关的基因,目前在75%的恶性肿瘤细胞中发现有p53基因的突变。p53蛋白如果发生突变则可能成为一种肿瘤促进因子,引起肿瘤的形成或细胞转化;野生型p53蛋白有抑制肿瘤发生的功能,当细胞的DNA因外界因素受到损伤时,P53蛋白就会通过一系列途径抑制细胞生长,将细胞周期阻滞在G1期以促使细胞进行自我修复,如果修复失败则触发细胞凋亡[4]。而ASPP家族(Ankyrin repeat,SH3 domain and proline-rich domain protein)即p53凋亡刺激蛋白(apoptosis stimulating protein of p53 family),是近几年新发现参与细胞凋亡的蛋白家族,在肿瘤发生发展中起着重要的作用。其包括具有相似结构的三个成员:ASPP1、ASPP2与iASPP。ASPP家族蛋白通过与p53结合来实现其调节细胞凋亡的功能,其中ASPP1和 ASPP2与p53结合后提高p53反应的原凋亡基因活力,促进p53蛋白依赖的细胞凋亡;而iASPP则竞争结合p53而抑制细胞的凋亡[18]。当细胞DNA受损时,ASPP蛋白家族不同成员与P53蛋白的特异性结合将决定细胞是分裂停滞还是走向凋亡[19]。因此,ASPP基因家族在p53凋亡通路中起着重要的作用。
在本实验中,我们通过Western blot分析发现,木犀草素可以降低HepG2细胞内iASPP水平,同时升高p53与ASPP2等促凋亡蛋白水平。因此我们推测在木犀草素的作用下,HepG2细胞内活性氧水平下降,从而抑制肿瘤细胞线粒体活性,同时木犀草素提高了p53与ASPP2蛋白水平,抑制iASPP表达,促进p53蛋白依赖的细胞凋亡。然而木犀草素对相关蛋白表达调控的具体机制尚不明确;此外木犀草素是如何调节细胞内的活性氧水平的并最终影响细胞命运的?药物又是如何进入细胞的?是直接与活性氧反应还是与其他信号分子反应来调节?这些疑问都需要进一步研究才能明确其中的作用途径和机制。希望未来对木犀草素调控细胞凋亡相关通路蛋白的分子机制、其他抗肿瘤作用靶点、以及与其他药物联用的效果研究能为临床用药提供新的数据支持。
[1]ASHOKKUMAR P,SUDHANDIRAN G.Protective role of luteolin on the status of lipid peroxidation and antioxidantdefense againstazoxymethaneinduced experimental colon carcinogenesis [J].Biomed Pharmacother,2008,62(9):590-597.
[2]JANG S,KELLEY K W,JOHNSON R W.Luteolin reduces IL-6 production in microglia by inhibiting JNK phosphorylation and activation of AP-1 [J].Proc Nat Acad Sci U S A,2008,105(21):7534-7539.
[3]MEHLA R,BIVALKAR-MEHLA S,CHAUHAN A.A Flavonoid, Luteolin, Cripples HIV-1 by Abrogation of Tat Function [J].Plos One,2011,6(11).
[4]BAGLI E,STEFANIOTOU M,MORBIDELLI L,et al.Luteolin inhibits vascular endothelial growth factor-induced angiogenesis; inhibition of endothelial cell survival and proliferation by targeting phosphatidylinositol 3'-kinase activity[J].Cancer Res,2004,64(21):7936-7946.
[5]CAI X T,YE T M,LIU C,et al.Luteolin induced G2 phase cell cycle arrest and apoptosis on nonsmall cell lung cancer cells[J].Toxicol in Vitro,2011,25(7):1385-1391.
[6]YAN J Q,WANG Q,ZHENG X L,et al.Luteolin enhances TNF-related apoptosis-inducing ligand's anticancer activity in a lung cancer xenograft mouse model [J].Biochem Biophys Res Communi,2012,417(2):842-846.
[7]YANG S F,YANG W E,CHANG H R,et al.Luteolin induces apoptosis in oral squamous cancer cells[J].J Dent Res,2008,87(4):401-406.
[8]FARIED A,FARIED L S,KATO H,et al.Targeting p53 tumor suppressor to induce apoptosis and cell cycle arrest in esophageal cancer cells by novel sugar-cholestanols compounds[J].Eur J Cancer Suppl,2008,6(9):83.
[9]TRACHOOTHAM D,ALEXANDRE J,HUANG P.Targeting cancer cells by ROS-mediated mechanisms:a radical therapeutic approach?[J].Nat Rev Drug Discov,2009,8(7):579-591.
[10]RAJ L,IDE T,GURKAR A U,et al.Selective killing of cancer cells by a small molecule targeting the stress response to ROS[J].Nature,2011,475(7355):231-234.
[11]ZHOU L,LAI Z T,LU M K,et al.Expression and hydroxylamine cleavage ofthymosin alpha 1 concatemer [J].J Biomed Biotechnol,2008,2008:736060.
[12]QIN Y,CHEN F D,ZHOU L,et al.Proliferative and anti-proliferative effects of thymosin alpha 1 on cells are associated with manipulation of cellular ROS levels[J].Chem Biol Interact,2009,180(3):383-388.
[13]FINKEL T.Oxidant signals and oxidative stress[J].Curr Opin Cell Bio,2003,15(2):247-254.
[14]SHI R X,ONG C N,SHEN H M.Protein kinase C inhibition and X-linked inhibitorofapoptosis protein degradation contribute to the sensitization effect of luteolin on tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis in cancer cells [J].Cancer Res,2005,65(17):7815-7823.
[15]ANDO C,TAKAHASHI N,HIRAI S,et al.Luteolin,a food-derived flavonoid,suppresses adipocyte-dependent activation of macrophages by inhibiting JNK activation [J].FEBS Lett,2009,583(22):3649-3654.
[16]LEE W J,WU L F,CHEN W K,et al.Inhibitory effect of luteolin on hepatocyte growth factor/scatter factor-induced HepG2 cell invasion involving both MAPK/ERKs and PI3K-Akt pathways[J].Chem Biol Interact,2006,160(2):123-133.
[17]MAHIPAL S V K,SUBHASHINI J,REDDY M C,et al.Effect of 15-lipoxygenase metabolites,15-(S)-HPETEand 15-(S)-HETEonchronic myelogenous leukemia cell line K-562:Reactive oxygen species(ROS)mediate caspase-dependent apoptosis [J].BiochemicalPharmacology,2007,74(2):202-214.
[18]KOBAYASHI S,KAJINO S,TAKAHASHI N,et al.53BP2 induces apoptosis through the mitochondrial death pathway [J].Genes Cells,2005,10(3):253-260.
[19]SLEE E A,LU X.The ASPP family:deciding between life and death after DNA damage[J].Toxicol Lett,2003,139(2-3):81-87.
