CCL21-CD40L融合蛋白的肿瘤免疫实验研究
2013-12-06李鸿立巴一
宫 婷,李鸿立,巴一
(1.天津医科大学总医院肿瘤科,天津 300052;2.天津市肿瘤医院消化内科,天津 300060)
近年来,世界多数国家大肠癌发病率呈上升趋势,北美、欧洲各国大肠癌发病率居恶性消化道肿瘤第1位[1]。抗肿瘤免疫以细胞免疫为主,依赖于多种效应细胞的协调作用。树突细胞作为功能最强大的抗原提成细胞,通过行使一系列功能,包括捕获抗原、上调刺激信号、将抗原递呈并激活T细胞,在抗肿瘤免疫反应中发挥重要作用。但在肿瘤组织周围树突细胞多低表达或免疫功能低下,无法有效地处理和提呈肿瘤抗原。CCL21又称次级淋巴组织趋化因子,能够趋化树突细胞、初始和记忆性T细胞;CD40配体(CD40 ligand,CD40L)是肿瘤坏死因子家族成员,能够通过与B细胞及树突细胞表面的CD40相互作用,诱导细胞表型和功能的成熟,上调树突细胞的共刺激分子和一些辅助因子的表达,促进树突细胞成熟。本研究拟构建趋化因子CCL21与CD40L融合基因,利用CCL21对树突细胞的趋化活性,将内源性树突细胞富集于肿瘤部位,CD40L进一步活化树突细胞,上调共刺激分子,使得树突细胞能够将抗原-肽复合物呈递给T、B淋巴细胞,从而启动细胞免疫及体液免疫反应,两者协同发挥抗肿瘤作用。
1 材料与方法
1.1 实验动物和细胞株 小鼠结肠癌细胞C26(中国医学科学院药物研究院),小鼠树突细胞DC2.4(Havard大学 Dana Farber博士惠赠),6~8周龄Balb/c小鼠(中国医学科学院血液研究所)。
1.2 构建 CCL21-exCD40L真核载体[2]CCL21取编码序列全长,CD40L取胞外段编码序列,通过分子生物学方法,去掉CD40L自身胞内段,替换为 CCL21的信号肽,得到exCD40L。将CCL21与exCD40L作为融合基因的对照。设计引物:P1 TTGGATCCaccatggctcagatgatg;P2 TGCTCGAGTCAGAGTTTGAGTAAGC;P3 CCGCTTCCTCCGCCTCCGCTTCCGCCTCCGCC TTATCCTCTTGAGGGC;P4 GAGGCGGAGGAAGCGGCGGTGGCGGCAGC CATAGAAGATTGGATAAGGT;其中划线部分为柔性肽linker,以P1和P3为引物扩增CCL21、以P2和P4扩增exCD40L,分别扩增30个循环,以扩增后的CCL21和exCD40L互为引物再次PCR扩增10个循环,即通过linker(GSSSSGSSSSGSSSS)将CCL21与exCD40L连接起来成为一个融合片段,加入P1和P2继续扩增,得到CCL21-exCD40L,酶切、连接入真核表达载体 pcDNA3.1+,共建立 4种质粒,即:CCL21-exCD40L、CCL21、exCD40L 及空载体。
1.3 CCL21-exCD40L融合蛋白表达检测 应用Lipofectamine 2000(Invitrogen公司)介导转染pcDNA3.1+/CCL21-exCD40L至CHO细胞。取转染后72h细胞总蛋白,进行Western blot检验。一抗分别为兔抗小鼠CCL21抗体及兔抗小鼠CD40L抗体(Santa cruz公司),稀释倍数1∶200,二抗为山羊抗兔抗体,稀释倍数1∶5000,经辣根过氧化酶系统显色,观察细胞膜上CCL21-exCD40L的表达情况。
1.4 CCL21-exCD40L融合蛋白趋化活性检测转染CCL21-exCD40L基因到CHO细胞,以CCL21及空载体为对照组,72 h后收集上清液。用趋化缓冲液(含 0.5%BSA的 RPMI 1640)调整 DC2.4细胞浓度为 2×106/ml,Transwell板上层添加 DC2.4 悬液 50μl,下层添加转染细胞上清液500,覆盖孔径8 μm的多聚碳酸酯膜,置于37℃ 5%二氧化碳孵箱孵育2 h。取出多聚碳酸酯膜,刮去上层表面残留的细胞,甲醇固定,再进行苏木精染色,每孔随机计数5个光学显微镜视野(×100)中迁移至多聚碳酸酯膜背面的细胞总数。
1.5 CCL21-exCD40L融合蛋白抗肿瘤治疗
30只小鼠分别于右侧腋下皮下注射C26细胞2×106,10d后均形成结肠癌肿瘤。分为CCL21-exCD40L融合基因组8只,CCL21组、exCD40L组各6只,空载体组、磷酸盐缓冲液组(PBS组)各5只,各组分别将相关质粒经脂质体包裹后肿瘤局部注射给药,每周注射1次,4周后无痛苦处死小鼠,实验中死亡的小鼠立即解剖。剥离皮下移植瘤组织测量体积。
2 结果
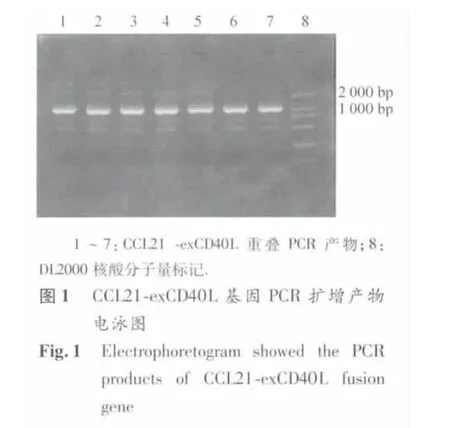
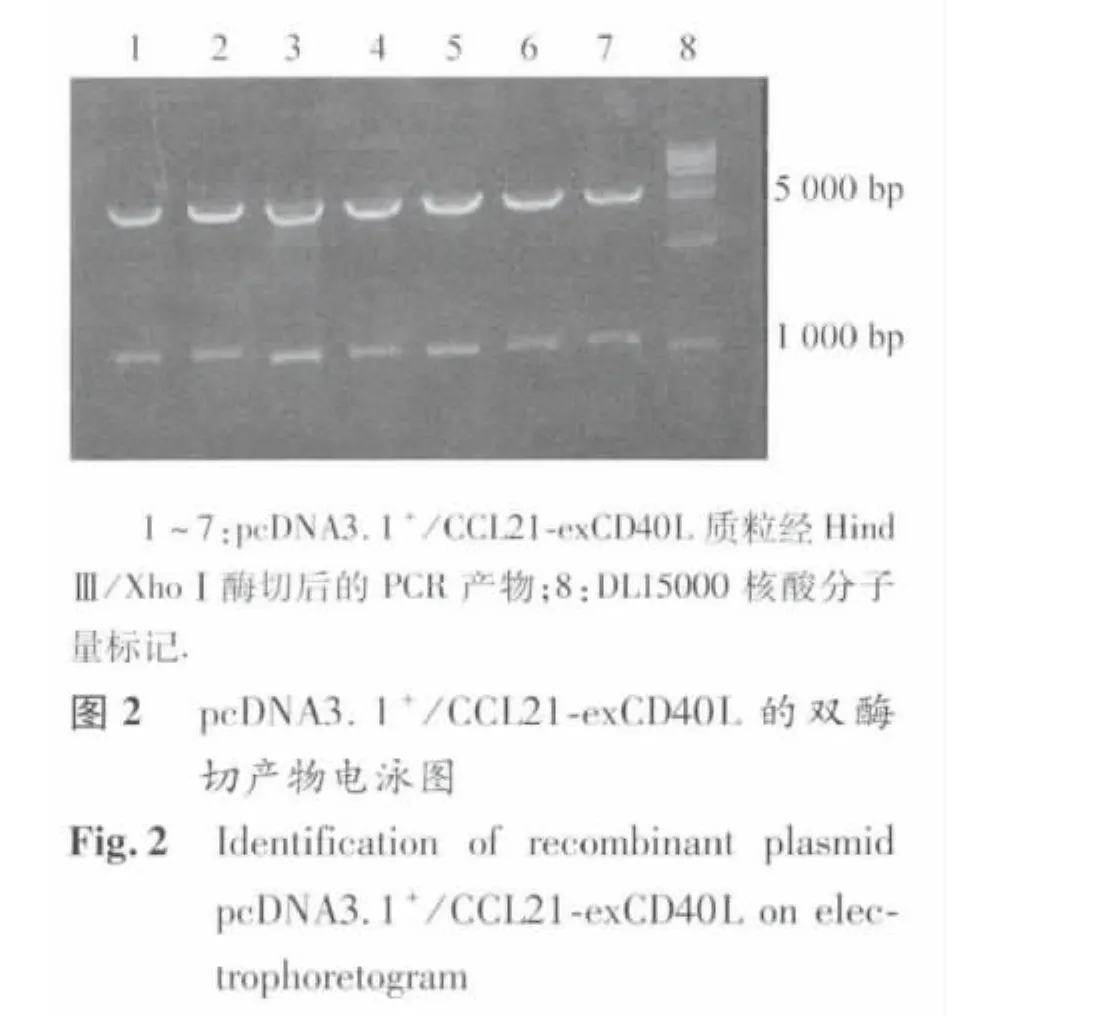
2.1 pcDNA3.1+/CCL21-exCD40L 真核表达载体鉴定 CCL21-exCD40L基因PCR扩增产物电泳图显示,较明亮的条带为所扩增的PCR产物。电泳显示融合基因大小约1150 bp(见图1),与预期大小相符。重叠PCR过程中引物需多次加入且原产物混杂,电泳图中可见多条杂带。将CCL21-exCD40L基因进行测序后,插入 pcDNA3.1+真核表达载体,经 HindⅢ/XhoⅠ酶切,在约1100 bp及5400 bp处可见电泳亮带(图2),符合插入的目的片段长度及切开的 pcDNA3.1+质粒 DNA长度,提示为pcDNA3.1+/CCL21-exCD40L真核表达载体。
2.2 CCL21-exCD40L融合蛋白表达测定 在CCL21一抗标记的样品中检测到CCL21(14 kD)及 CCL21-exCD40L(约 45 kD),CD40L 一抗所标记样品检测到 exCD40L(33 kD)及CCL21-exCD40L(约45 kD),见图3。
2.3 CCL21-exCD40L融合蛋白趋化活性检测光学显微镜下,转染 pcDNA3.1+/CCL21-exCD40L、pcDNA3.1+/CCL21、pcDNA3.1+的CHO细胞培养上清液中每视野树突细胞穿膜细胞数分别为25.87 ±5.49、26.80 ±7.81、1.73±0.96,前两组间均多于 pcDNA3.1+组(均 P< 0.01),分别是 pcDNA3.1+组的 14.95 和15.49倍;而前两组间差异没有统计学意义(P>0.05)。
2.4 CCL21-exCD40L抑瘤作用观察 CCL21-exCD40L融合蛋白抗肿瘤治疗后,融合基因组肿瘤均明显缩小,8只荷瘤小鼠全部存活。各组肿瘤结节变化见表1,各组差异具有统计学意义(P <0.01)。
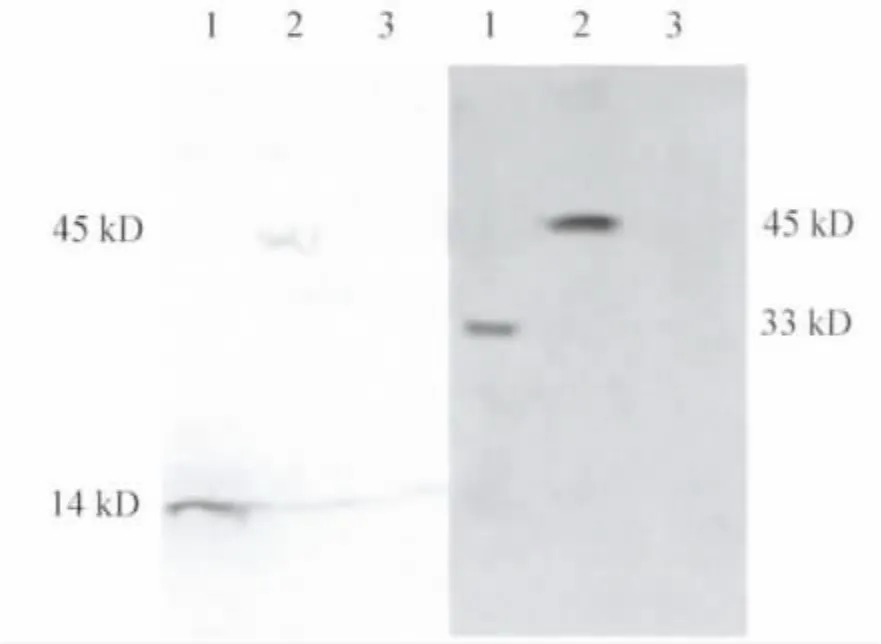
图3 Western blot检测CHO-融合基因转染细胞中融合蛋白的表达Fig.3 The expression ofCCL21-exCD40L protein tested by Western blot
3 讨论
树突细胞是体内功能最强的抗原专职递呈细胞,能够捕获一些通常会发生免疫逃避的抗原物质(如肿瘤抗原)。未成熟树突细胞捕获肿瘤抗原后可自发成熟,表达主要组织相容性抗原复合物(MHC)及共刺激分子(如CD86和CD40等),并将其表面MHCⅠ类和Ⅱ类分子上的肽抗原递呈给T细胞,使CD8+T细胞分化成具杀伤能力的细胞毒性T淋巴细胞,后者将抗原呈递给 CD4+细胞,使其分化成 Th细胞[3],从而引发相应的免疫应答。然而肿瘤免疫的基础研究表明,肿瘤细胞低表达或不表达MHC分子及共刺激分子,某些肿瘤细胞还能分泌产生细胞因子(如白介素-10)抑制肿瘤患者体内树突细胞的成熟及机体的免疫功能,使肿瘤细胞逃脱机体的免疫监视而无限生长[4-5]。
CCL21属于CC类趋化因子,主要表达于次级淋巴器官T细胞区的基质细胞。人和小鼠中的CCL21序列高度同源,具有86%的同源性[6]。小鼠 CCL21 具有多种亚型,即 CCL21a、-b和-c,三种 CCL21 的趋化作用基本相似[7]。本实验中克隆基因为 CCL21b亚型基因。CCL21通过与其受体CCR7结合,趋化树突细胞、初始和记忆性T细胞,对B细胞、自然杀伤细胞及自然杀伤T细胞也具有趋化作用。既往已有实验证明CCL21能够通过募集免疫效应细胞达到抗肿瘤作用。Sharma等[8]在两组小鼠肺癌模型中,一组瘤内注入CCL21,而对照组注入缓释液,发现注入CCL21组小鼠肿瘤体积明显缩小,40%的小鼠肺肿瘤明显消失,而对照组小鼠的肿瘤迅速生长,提示CCR7及其配体在抗肿瘤方面具有显著作用。

表1 各组肿瘤结节变化和荷瘤小鼠存活率比较Table 1 Compare the variation of the tumor mass and survival rates between different groups
CD40L属于共刺激分子的肿瘤坏死因子超家族成员,主要表达于CD4+T细胞[9],其次在嗜碱性细胞、肥大细胞、树突细胞、自然杀伤细胞和血小板的表面也可监测到[10]。CD40LCD40的相互作用在胸腺依赖的体液免疫和细胞免疫调控中居于重要地位。CD40L通过与B细胞及树突细胞表面的CD40相互作用,诱导细胞表型和功能的成熟,上调树突细胞的共刺激分子和一些辅助因子的表达,包括MHCⅡ、CD80、CD86 等,促进树突细胞分泌 IL-12[11],这反过来又进一步与T细胞表面的CD28相互作用,诱导T细胞增殖和活化,诱导T细胞分泌细胞因子如白介素-1、白介素-6、白介素-8、白介素-12、肿瘤坏死因子 α[12],进而诱导 CD4+Th细胞和细胞毒性T淋巴细胞上调其白介素-12受体的表达,增强由抗CD3抗体诱导的增殖效应,启动特异性免疫应答。
因此如果在肿瘤组织原位分泌CCL21的同时表达CD40L,用以活化被趋化来的树突细胞,募集CD4+T细胞、细胞毒性T淋巴细胞等免疫效应细胞,促进趋化而来的免疫效应细胞间相互作用,可以启动免疫应答,发挥特异性抗肿瘤作用。Khaled等[13]将分别负载CCL21基因及CD40L基因的两个腺病毒载转染C26细胞,发现转染载体的肿瘤局部富集 CD4+、CD8+T细胞;将两个基因同时于小鼠C26肿瘤模型瘤体原位注射,二者协同较单基因作用能够发挥更强的CD8+T细胞依赖的抗肿瘤作用,小鼠生存期显著延长,证明上述假设可行。但是实际应用中如果同时在肿瘤原位分别表达两种蛋白,操作步骤繁琐,不容易推广。
本研究将CCL21全长与CD40L胞外区这两个有功能的蛋白的编码序列连接起来,构建融合基因,通过转染靶细胞,使之分泌表达CCL21-exCD40L融合蛋白。DC2.4是C57B/L小鼠骨髓来源的不成熟树突细胞永生细胞系,其形态和生物学活性与小鼠骨髓来源的树突细胞相似[14],并且用脂多糖及肿瘤坏死因子α刺激后能够向成熟方向转化,主要用于肿瘤方面的研究。本实验结果表明,融合蛋白及CCL21蛋白对树突细胞均具有明显趋化作用,也证明了融合基因中的CCL21这部分基因编码的蛋白活性能够正常发挥,与前人研究结果[8]相符。
由此我们进一步假设,如果将融合蛋白在肿瘤局部表达,融合蛋白将发挥趋化作用募集抗原负载的树突细胞、T及B淋巴细胞到肿瘤组织,其中的exCD40L部分发挥其“活化”作用,激活趋化而来的树突细胞及B细胞等,增强免疫细胞间的正反馈作用,这样“趋化”与“活化”相辅相成,协同发挥抗肿瘤的作用。本实验构建了小鼠结肠癌肿瘤模型,当肿瘤增大到直径约0.8 cm左右,用脂质体包裹CCL21-exCD40L融合基因肿瘤原位注射,结果显示肿瘤体积减小,小鼠生存期延长,生存率显著提高,实验结果与Khaled等一致。证明CCL21-exCD40L融合基因既发挥了CCL21的趋化作用,又发挥了CD40L的活化作用,两者协同作用大大提高了CCL21或exCD40L作为免疫佐剂对肿瘤细胞的杀伤作用。本研究制备的CCL21-exCD40L融合基因转染效率较高,其表达的蛋白展示有很好的生物活性,但有一定的非特异性免疫反应,有待进一步改进。
[1]HENDON S E,DIPALMA J A.U.S.practices for colon cancer screening[J].Keio J Med,2005,54(4):179-183.
[2]HU Taishan,CHEN Haixu,YANG Yungui,et al(胡泰山,陈海旭,杨运桂,等).Construction and expression of ScFv against antibacterial peptide Magainin II[J].J Cell Mol Immunol(细胞与分子免疫学杂志),2000,16(4):317-320(in Chinese).
[3]STEINMAN R M,POPE M.Exploiting dendritic cells to improve vaccine efficacy [J].J Clin Invest,2002,109:1519-1526.
[4]HALLIDAY G M,LE S.Transforming growth factorbeta produced by progressor tumors inhibits,while IL-10 produced by regressor tumors enhances,Langerhans cell migration from skin [J].Int Immunol,2001,13(9):1147-1154.
[5]OHM J E,CARBONE D P.VEGF as a mediator of tumor-associated immunodeficiency[J].Immunol Res,2001,23(2-3):263-272.
[6]HEDRICK J A,ZLOTNIK A,et al.Identification and characterization of a novel beta chemokine containing six conserved cysteines [J].J Immunol,1997,159(4):1589-1593.
[7]CHEN S C,VASSILEVA G,KINSLEY D,et al.Ectopic expression ofthe murine chemokines CCL21a and CCL21b induces the formation of lymph node-like structures in pancreas[J].J Immunol,2002,168(3):1001-1008.
[8]SHARMA S,STOLINA M,ZHU L,et al.Secondary lymphoid organ chemokine reduces pulmonary tumor burden in spontaneous murine bronchoalveolar cell carcinoma[J].Cancer Res,2001,61(17):6406-6412.
[9]ARMITAGE R J,FANSLOW W C,STROCKBINE L,et al.Molecular and biological characterization of a murine ligand for CD40 [J].Nature,1992,357(6373):80-82.
[10]CLAYTON A,COURT J,NAVABI H,et al.Analysis of antigen presenting cell derived exosomes,based on immuno-magnetic isolation and flow cytometry [J].J Immunol Methods,2001,247(1-2):163-174.
[11]LIU Y,QURESHI M,XIANG J.Antitumor immune responses derived from transgenic expression of CD40 ligand in myeloma cells[J].Cancer Biother Radiopharm,2002,17(1):11-18.
[12]HAASE C,MICHELSEN B K,JORGENSEN T N.CD40 is necessary for activation of naive T cells by a dendritic cell line in vivo but not in vitro[J].Scand J Immunol,2004,59(3):237-245.
[13]MAZZEI G J,EDGERTON M D.Herpes simplex virus(HSV)amplicon-mediated codelivery of secondary lymphoid tissue chemokine and CD40L results in augmented antitumor activity [J].Cancer Res,2002,62(22):6545-6551.
[14]SHEN Z,REZNIKOFF G,DRANOFF G,et al.Cloned Dendritic Cells Can Present Exogenous Antigens on Both MHC Class I and Class II Molecules[J].J Immunol,1997,158(6):2723-2730.
