右美托咪定预处理减轻离体大鼠心脏缺血/再灌注损伤的线粒体相关机制
2013-12-06姜翠翠夏满莉陈士票
姜翠翠,夏满莉,王 敏,陈士票
(嘉兴学院医学院,浙江 嘉兴 314001)
缺血性心肌梗死是当今人类的主要致死原因之一,及早恢复缺血区心肌的血流供应是减少心肌细胞死亡,挽救患者生命的最佳办法;但是,恢复血流灌注后又给心肌带来了心律失常、心肌梗死等新的损伤,即缺血/再灌注(ischemia/reperfusion,I/R)损伤[1]。心肌 I/R损伤机制复杂,有研究发现电刺激迷走神经可减少心肌I/R引起的心肌损伤,其机制可能与抑制线粒体渗透性转换孔(mitochondrial permeability transition pore,mPTP)开放有关[2];研究认为,增强迷走神经兴奋可能是减少I/R损伤,挽救缺血心肌的有效辅助治疗手段。
右美托咪定(dexmedetomidine,Dex)为高选择性α2-肾上腺素能受体激动剂,可抑制交感神经兴奋性,增强迷走神经兴奋性,常用于血管疾病患者围手术期的辅助麻醉与镇静镇痛,有助于减少围手术期的心脏副反应[3]。研究发现,通过Dex预处理,可激活α2-肾上腺素能受体,减轻大鼠心肌I/R损伤[4-5]。再者,线粒体是缺血药物预处理发挥心肌保护作用的终末效应器之一[2,6],Dex 减少心肌 I/R 损伤亦可能与调控心肌mPTP开放及其上游线粒体ATP敏感性钾通道(mitochondrialATP-sensitive potassium channel,mitoKATP)活性有关[2,4],但有关Dex的心肌线粒体作用国内外尚未见报道。本实验应用Langendorff模型研究Dex对离体大鼠心脏I/R时心功能及心肌梗死的影响,探讨Dex预处理与心肌mitoKATP-mPTP的关系。
1 材料与方法
1.1 药品与试剂 苍术苷(atractyloside,Atr)、5-羟基癸酸(5-hydroxydecanoate,5-HD)及氯化三苯四氮唑(2,3,5-triphenylterazolium chloride,TTC)均购自 Sigma公司。右美托咪定(dexmedetomidine,Dex)购自江苏恒瑞医药股份有限公司,批号为20100412,乳酸脱氢酶(lactate dehydrogenase,LDH)测试盒购自南京建成生物工程研究所,其余试剂为市售分析纯。Krebs-Henseleit(K-H)液(mmol/L):NaCl 118.0、KCl 4.7、KH2PO41.2、MgSO41.2、NaHCO325.0、葡萄糖 10.0、CaCl22.5,pH 7.4,以95%O2+5%CO2饱和。
1.2 离体心脏Langendorff灌流和左心室功能评价 雄性SD大鼠(体重240~270 g,由浙江省医学科学院实验动物中心提供)断头后开胸迅速取出心脏,置于4℃改良K-H液中洗净血液,转移并固定于Langendorff灌流装置,以改良K-H液行常规恒压(76 mmHg)灌流,维持灌流液温度(37℃)。切开左心耳,将充水乳胶囊由此插入至左心室,囊内压力经特氟纶管传递至压力传感器,由Medlab生物信号采集处理系统(南京美易科技有限公司)记录和分析。向插入左心室内的乳胶囊注水使左心室舒张末压(left ventricular end diastolic pressure,LVEDP)维持于5~8 mmHg,连续记录实验过程中左心室发展压(left ventricular developed pressure,LVDP)及心率(heart rate,HR)等各项指标[7]。
1.3 心肌I/R损伤模型制备 采用全心停灌的方法制备I/R损伤模型,即心脏在Langendorff灌流装置平衡20 min,继续灌流20 min后,停止灌流30 min作为缺血,再灌注120 min。
1.4 冠脉流出液LDH活性的测定 在复灌5 min末收集冠脉流出液,按试剂盒说明检测LDH活性。
1.5 心肌组织活性的测定 心脏从灌流装置上取下后切成1~2 mm薄片,在37℃水浴中用TTC(1%)孵育30 min后,取出心肌片,吸干表面的水分并称其湿重,加入二甲基亚砜(20 ml/g)后匀浆,离心(1000×g,10 min),取上清液在490 nm处测量其吸光度,以吸光度值大小反映心肌组织活性。
1.6 实验分组 大鼠随机分为5组(n=9):①正常对照组(Con):离体心脏Langendorff灌流190 min;②I/R损伤组(I/R):离体心脏平衡20 min,继续灌流20 min,全心停灌30 min作为缺血,然后再灌注120 min;③Dex预处理组(Dex):同I/R组,但在停灌前15 min用含Dex(10 nmol/L)的K-H液灌流,停灌30 min后用KH 液再灌注 120 min[4];④Dex+5-HD 组:平衡20 min后用含5-HD(100 μmol/L)的K-H液灌流20 min,再灌注前15 min加入Dex(10 nmol/L),停灌30 min后用K-H液再灌注120 min;⑤Dex+Atr组:同Dex预处理组,但于再灌注前20 min用含Atr(20 μmol/L)的K-H液灌流。
2 结果
2.1 Dex预处理对I/R心脏冠脉流量及左心室收缩功能的影响 表1示,各组别大鼠的基础冠脉流量、LVDP及LVEDP差异无显著性;与正常对照组比较,I/R组再灌注期的冠脉流量和LVDP均明显下降(P<0.01),而LVEDP显著增加(P<0.01);Dex(10 nmol/L)预处理15 min均明显减弱I/R对冠脉流量及LVDP的抑制作用(P<0.01)以及对LVEDP的抬升作用(P<0.01),Dex预处理对再灌注期间心功能的改善作用均被5-HD及Atr所逆转(P<0.01)。在整个实验过程中,各组间心率无明显变化(数据略)。
表1 Dex预处理对I/R心脏冠脉流量及左心室收缩舒张功能的影响Table 1 Effect of dexmedetomidine(Dex)preconditioning on coronary flow and left ventricular systolic and diastolic function in isolated rat hearts subjected to ischemia/reperfusion(n=9,)

表1 Dex预处理对I/R心脏冠脉流量及左心室收缩舒张功能的影响Table 1 Effect of dexmedetomidine(Dex)preconditioning on coronary flow and left ventricular systolic and diastolic function in isolated rat hearts subjected to ischemia/reperfusion(n=9,)
与正常对照组(Con)比,**P <0.01;与缺血/再灌注损伤组(I/R)比,#P <0.05,##P <0.01;与 Dex预处理组(Dex)比,+P <0.05,++P <0.01.
2.2 Dex预处理对I/R心脏心肌活性及冠脉流出液LDH含量的影响 图1示,与正常对照组比较,I/R组再灌注结束后心肌组织活性标记物 formazan含量明显下降(P<0.01),Dex(10 nmol/L)预处理15 min明显减弱了I/R对心肌组织活性的损伤作用(P<0.01),该改善作用被5-HD及Atr所逆转(P<0.01)。由图2所见,Dex预处理明显抑制了I/R导致的冠脉流出液LDH含量增加(P<0.01),而5-HD及Atr处理则取消了Dex减少冠脉流出液LDH含量的作用。
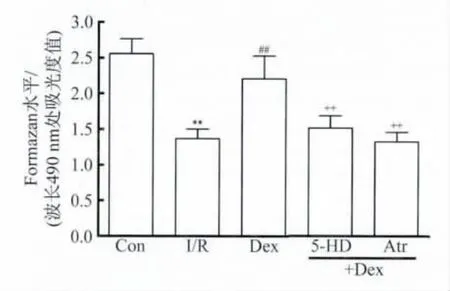
图1 Dex预处理对I/R心脏formazan含量的影响Fig.1 Effect of dexmedetomidine,5-hydroxydecanoate and atractyloside on the formazan content from the isolated rat hearts subjected to I/R
3 讨论
本实验在离体大鼠全心I/R模型上发现,Dex预处理明显增加了I/R大鼠心脏冠脉流量,减少了心肌损伤标志酶LDH的漏出及心肌组织活性的下降,改善了再灌注左心室收缩与舒张功能,这些心功能改善作用均被mitoKATP阻断剂5-HD及mPTP开放剂Atr所逆转,提示Dex预处理具有对抗心肌I/R损伤作用,且该作用与mitoKATP的激活及下游mPTP开放受阻有关。
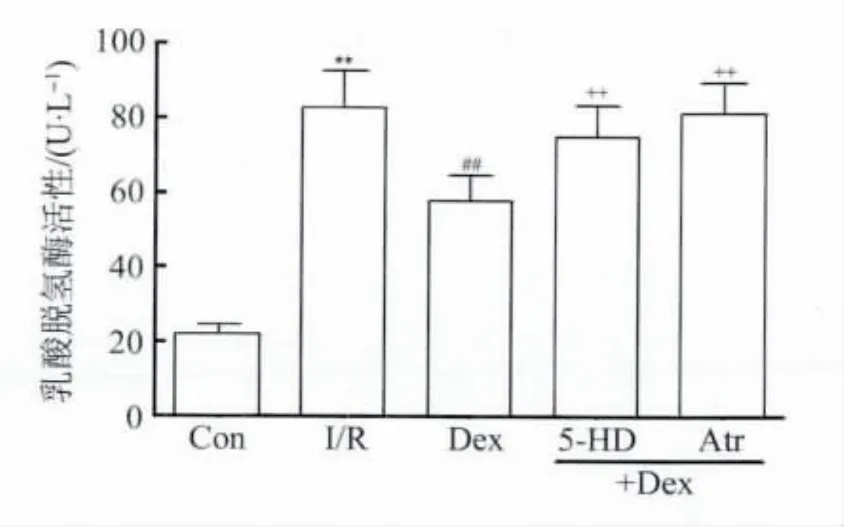
图2 Dex预处理对I/R心脏冠脉流出液LDH的影响Fig.2 Effect of dexmedetomidine on the LDH activity in the coronary effluent from the isolated rat hearts subjected to I/R
在心血管系统中,Dex作为高选择性α2-肾上腺素能受体激动剂具有多种生物学效应,如通过不同亚型的α2-肾上腺素能受体产生舒张或收缩血管效应[8],增强迷走神经兴奋性使心肌耗氧降低,防止缺血心肌因能量耗竭而梗死[3,5]。由于 Dex 具有良好的心血管保护作用,其越来越多地应用于围手术期的辅助麻醉[9],但是有关Dex对I/R心肌损伤作用的研究却不多见,且基本上停留在α2-肾上腺素能受体激动剂的研究水平,其下游所涉及的机制并不清楚。研究发现,Dex的心肌保护作用在临床镇静用药时达到的最小与最大血浆浓度(0.23 ~2.3 ng/ml,对应1 ~10 nmol/L)范围内是浓度依赖性增强的[4],故本实验选择近似于临床Dex用药浓度的上限值,以期产生探讨Dex心肌保护作用的线粒体相关机制。
心肌I/R损伤涉及的机制复杂,其中再灌注期的活性氧自由基大爆发、心肌细胞内Ca2+超载等因素促使mPTP开放,线粒体膜电位崩解,释放细胞色素C等诸多凋亡诱导因子至细胞质诱发细胞凋亡,这是公认的心肌I/R损伤的经典途径[7]。本研究是在离体心脏上进行的,排除了迷走神经兴奋在Dex预处理心肌保护作用中的影响,Dex改善了再灌注离体心脏的冠脉流量及左心室泵血功能,这可能是因为Dex通过激活冠状动脉的α2-肾上腺素能受体,促使血管短暂收缩,产生了类似于缺血预处理的作用[4];且Dex亦有可能通过激活心肌细胞的α-肾上腺素能受体,产生正性肌力作用,提高I/R心脏左心室泵血功能,由此冠脉循环增加,增加心肌氧及营养物质供应,形成心功能改善的良性循环。Dex的心功能改善作用被mPTP开放剂Atr所取消,提示Dex预处理可能抑制了心肌mPTP在再灌注期间的开放,维持了线粒体膜结构的完整性,减少了线粒体依赖性细胞凋亡[2,8]。Dex预处理组心肌组织活性增加及冠脉流出液LDH含量减少,进一步说明Dex预处理明显减少了I/R诱导的心肌细胞膜破裂及线粒体功能紊乱。
缺血前mitoKATP开放是抵抗心肌I/R损伤的一条重要通路,mitoKATP开放后可能通过激活再灌注期蛋白激酶C-ε、磷脂酰肌醇-3-激酶或腺苷A2b受体,共同促进线粒体糖原合成酶激酶-3β磷酸化,并抑制线粒体基质亲环蛋白D与内膜腺嘌呤核苷酸移位酶的结合(这两者是构成mPTP的主要成分),由此减少线粒体依赖的心肌细胞凋亡,发挥心肌保护作用[10]。本实验中Dex预处理所产生的心肌保护作用被mitoKATP阻断剂5-HD所取消,提示Dex预处理可能在心肌缺血前激活了mitoKATP,启动了再灌注期心肌保护的线粒体通路。有研究显示mitoKATP开放后,减少了心肌线粒体Ca2+超载以及由此带来的氧化应激,从而抑制mPTP开放并维持线粒体膜结构的稳定[7]。缺血前5-HD处理及再灌注早期添加Atr均取消了Dex预处理的心肌保护作用,进一步提示缺血前mitoKATP激活以及由此引发的再灌注期mPTP开放受阻,这可能是Dex预处理发挥心肌保护作用的一条重要的线粒体通路。
综上所述,尽管缺血预处理的心肌保护作用是公认的,但是由于其操作上的难度在临床应用上并不可行。本研究发现Dex作为一种围手术期常用的辅助麻醉与镇静镇痛药,具有减少心肌I/R损伤作用,且该心肌保护作用可能与Dex促进心肌缺血前mitoKATP的开放,抑制再灌注早期mPTP的开放有关。这一发现为心血管手术中预处理心肌保护药物的选择提供了新思路,Dex在作为麻醉药的同时,亦可能是一种有效且易于实施的抗心肌I/R损伤的预处理药物。
[1]BRAUNWALDE,KLONER R A.Myocardial reperfusion:a double-edged sword?[J].J Clin Invest,1985,76(5):1713-1719.
[2]KATARE R G,ANDO M,KAKINUMA Y,et al.Vagal nerve stimulation prevents reperfusion injury through inhibition ofopening ofmitochondrial permeability transition pore independent of the bradycardiac effect[J].J Thorac Cardiovasc Surg,2009,137(1):223-231.
[3]WIJEYSUNDERA D N,NAIK J S,BEATTIE W S.Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications:a meta-analysis[J].Am J Med,2003,114(9):742-752.
[4]OKADA H,KURITA T,MOCHIZUKI T,et al.The cardioprotective effect of dexmedetomidine on global ischaemia in isolated rat hearts [J].Resuscitation,2007,74(3):538-545.
[5]GUO H,TAKAHASHI S,CHO S,et al.The effects of dexmedetomidine on left ventricular function during hypoxia and reoxygenation in isolated rat hearts[J].Anesth Analg,2005,100(3):629-635.
[6]HALESTRAP A P.Calcium,mitochondriaand reperfusion injury:a pore way to die[J].Biochem Soc Trans,2006,4(Pt 2):232-237.
[7]GAO Q,PAN H Y,QIU S,et al.Atractyloside and 5-hydroxydecanoate block the protective effect of puerarin in isolated rat heart[J].Life Sci,2006,79(3):217-224.
[8]WONG E S,MAN R Y,VANHOUTTE P M,et al.Dexmedetomidine induces both relaxations and contractions,via different{alpha}2-adrenoceptor subtypes,in the isolated mesenteric artery and aorta of the rat[J].J Pharmacol Exp Ther,2010,335(3):659-664.
[9]ARCANGELI A, D'AL C, GASPARI R.Dexmedetomidine use in general anaesthesia[J].Curr Drug Targets,2009,10(8):687-695.
[10]TERASHIMA Y,SATO T,YANO T,et al.Roles of phospho-GSK-3β in myocardial protection afforded by activation of the mitochondrial K ATP channel[J].J Mol Cell Cardiol,2010,49(5):762-770.
