高危晚期早产儿脑损伤病因学及其磁共振发现
2013-12-04冯子鉴王晓明
冯子鉴 毛 健 陈 丹 张 静 李 娟 王晓明
与足月儿相比,晚期早产儿在生长发育及生理上均不成熟,发生各种并发症及死亡的危险均高于足月儿[1~3],其神经系统也易受产前和产时因素的影响,常出现不同程度和不同类型的脑损伤,并进一步导致脑发育异常或遗留神经系统后遗症。胎龄34~37周时脑少突胶质细胞的构成主体仍是晚期前体少突胶质细胞,而且白质区域血管发育仍不成熟,容易发生脑白质损伤(CWMD)[4~8]。Petrini等[9]研究显示晚期早产儿脑瘫的发生率为足月儿的3倍。约25%的晚期早产儿在学习、语言及其他的神经发育方面落后于足月儿[10]。因此,明确晚期早产儿发育异常可能的原因,特别是早期诊断有无脑损伤,对其进行早期干预至关重要。
本研究团队曾报道277例晚期早产儿CWMD的临床特点及MRI发现[11],由于病例数较少而无法行危险因素分析,本研究在前期研究的基础上,通过更大样本量描述分析晚期早产儿发生不同类型脑损伤的危险因素及临床特点。同时本研究对弥散加权成像(DWI)结合常规MRI诊断晚期早产儿CWMD的不同时间MRI特征进行分析,探讨高危早产儿早期MRI检查的最佳时间,以及不同类型CWMD在不同时点上MRI各序列信号变化规律,并根据MRI表现评价其预后。
1 方法
1.1 病例纳入和排除标准
2005年1月1日至2012年4月30日在中国医科大学附属盛京医院(我院)新生儿科住院治疗的、征得监护人(父母)知情同意的、病情允许搬动行MRI检查的、或家属强烈要求了解预后(由临床医生陪同、气管插管人工通气、血氧监护)的胎龄34~36+6周晚期早产儿。排除其他脑病,如遗传代谢性脑病、低血糖脑病、胆红素脑病和先天性脑发育异常。入我院前在外院已经行MRI检查并能提供MRI片的晚期早产儿亦纳入分析。
1.2 脑损伤的评估
本文对符合纳入标准的晚期早产儿的MRI片均进行了重新阅片,分为2005年1月1日至2008年5月31日阶段和2008年6月1日至2012年4月30日阶段,两个阶段脑损伤评估结果分别由我院2名不知晓临床病史资料的放射科医生和新生儿科医生共同分析给出。
CWMD评估标准:参考文献[12]报道的分类方法,并结合DWI与常规T1T2表现综合后评估分类:①局灶性CWMD:侧脑室前后角、半卵圆中心白质有单个或多个(≤3处)点状损伤,病灶直径≤2 mm;②广泛性CWMD:多处深层脑白质受累而不伴有皮质下白质受累,常伴有胼胝体受累,病灶直径>2 mm或>3处;③弥漫性CWMD:病灶范围不仅累及脑室旁深部白质,且皮质下白质也有受累。早期检查时,当T1WI高信号、T2WI低信号,可能是出血性脑损伤,也可能是非出血性脑损伤,本研究均归类于非出血性脑损伤。
颅内出血评估标准[13]:Ⅰ级,生发基质出血;Ⅱ级,生发基质出血破入脑室内,但不伴有脑室扩张;Ⅲ级,生发基质出血破入脑室内,伴有急性脑室扩张;Ⅳ级,脑室内出血伴有脑室周围实质出血。
1.3 临床信息采集
复习文献[14~19]建立如下晚期早产儿的危险因素和生后临床特征及实验室指标。
1.3.1 一般信息 性别、胎龄、MRI检查时间(从出生至检查日龄)。
1.3.2 危险因素 ①产前因素:分娩方式、双胎、胎儿宫内窘迫、早发型败血症、妊娠期高血压、母糖尿病、母流产史;②产时因素:胎膜早破,胎盘早剥,前置胎盘,脐带异常,羊水异常,复苏抢救史(产时有正压通气、气管插管、胸外按压或应用肾上腺素)。
1.3.3 生后临床特征及实验室指标 代谢性酸中毒(pH≤7.20或 BE≤ -12),高碳酸血症(PaCO2≥60mmHg),低碳酸血症(PaCO2≤35mmHg),高钾血症(K+≥6.5mmol·L-1),低钠血症(Na+≤130mmol·L-1),低钙血症(Ca2+≤0.9mmol·L-1),高血糖(>7.0mmol·L-1),低血糖(<2.2mmol·L-1),机械通气(CPAP/MV),
晚发型败血症(WBC<5 000×109·L-1,PLT<100×109·L-1,CRP升高或血培养阳性),循环障碍(包括以下指标中至少2项:毛细血管充盈时间延长、低血压、少尿、心率增快、肝脏增大),反应低下(指包含一定程度的意识障碍、肌张力减低、肢体活动减少、哭声弱或吸吮无力),呼吸暂停,抽搐,喂养困难(喂养不耐受按照 Ng等[20]提出的诊断标准,具备以下3项中l项或多项:鼻胃管回抽残留量大于前次喂养量的50%或至少一次残留量>前次喂养量的30%或>每日喂养总量的10%;或有腹胀;或是血便)。
1.4 MRI复查的一般原则及转归判断 在征求患儿家属同意的前提下,第一次MRI检查有CWMD者原则上均要求复查MRI。CWMD转归判断:①病灶消失:所有序列上病变完全消失;②病灶范围减少:病灶的部位或直径减小;③软化:T1WI低信号,T2WI高信号。
1.5 分组考虑 为分析晚期早产儿危险因素,故以MRI未见异常的晚期早产儿为对照,MRI异常组中分为颅内出血亚组和非出血(CWMD、脑梗死和脑水肿)亚组。
1.6 MRI检查方法 头部MRI检查采用Philips Intera Achieva 3.0T磁共振仪。全部病例均进行常规MR和DWI扫描。描扫参数如下:T1加权(T1WI),SE序列TR=389 ms,TE=15 ms,常规进行矢状面和轴面扫描;T2加权(T2WI):快速 SECF/SE 序列,TR=3 035 ms,TE=100 ms,常规进行轴面扫描;视野17cm×17cm~22cm×22cm,矩阵182×256,层厚4 mm。DWI采用回波平面成像(EPI)超高速成像方法,即 EPI-SE 法,TR=2 144 ms,TE=56 ms,梯度磁场从 x、y、z轴3个方向上施加,b值均为1 000 s·mm-2。视野19cm×38cm,矩阵128×72,层厚4 mm。扫描前患儿予苯巴比妥5~7.5mg·kg-1静脉注射镇静。
1.7 统计学方法 统计分析采用SPSS 17.0软件,计量资料以±s表示,计数资料中各危险因素与CWMD关系采用χ2检验,多个因素率的比较应用行列无序列联表的χ2检验,多因素分析采用Logistic回归分析,以非出血性脑损伤、出血性脑损伤、弥漫性CWMD作为自变量,因变量定义:性别(1=男,2=女)、分娩方式(1=阴道分娩,2=剖宫产),对于其他的症状和相关因素,“有”以1编码,“无”以0编码。(P<0.05)为差异有统计学意义。
2 结果
2.1 一般情况 研究期间符合纳入标准的晚期早产儿656例,排除7例其他脑病,649例晚期早产儿进入分析。平均胎龄34+3~36(35.2±0.8)周,首次行头颅MRI检查的时间为生后2.8~16.2(9.5±6.7)d。①MRI未见异常组317例,胎龄34+3~36(35.2±0.8)周,第1次MRI检查时间为生后3.6~17.2(10.4±6.8)d。②MRI异常组332例(51.2%),胎龄34+4~36+1(35.3±0.8)周,第1次 MRI检查时间为生后2.3~15.1(8.7±6.4)d。
颅内出血亚组112/649例(17.3%),胎龄34+2~36+1(35.2±0.9)周,第1次MRI检查时间为生后2.5~13.7(8.6±5.1)d;蛛网膜下腔出血62/112例(55.4%),生发基质和脑室内出血共45例(40.2%),Ⅰ~Ⅱ级出血34/45例(75.6%),其中合并CWMD 22例(局灶性15例,广泛性6例,弥漫性1例),Ⅲ、Ⅳ级出血11/45例(24.4%),其中合并CWMD 7例(广泛性4例,弥漫性3例)。单纯颅内出血55例,颅内出血合并CWMD55例,颅内出血合并脑梗死1例,颅内出血合并CWMD和脑梗死1例。
CWMD亚组271/649例(41.8%),胎龄34+4~36+1(35.3±0.8)周,第1次MRI检查时间为生后1.7~14.7(8.3±6.4)d;其中局灶性CWMD 170例(62.7%),广泛性CWMD 77例(28.4%),弥漫性 CWMD 24例(8.9%)。单纯CWMD 214例,CWMD合并脑梗死1例。
脑梗死5例,单纯脑梗死2例。
脑水肿3例,均产时有窒息史,第1次MRI检查的时间为生后(4.3±2.3)d,其中1例生后第8天复查MRI,显示皮质下的白质均有受累。
2.2 晚期早产儿脑损伤危险因素 表1显示,与MRI未见异常组相比,男性、阴道分娩、胎膜早破和早发性败血症是出血性与非出血性脑损伤亚组的共同危险因素,而复苏抢救史是非出血性脑损伤亚组的危险因素,双生子和妊娠期高血压是出血性脑损伤亚组的危险因素。
Logistic回归分析提示非出血性脑损伤亚组的独立危险因素是男性(OR=1.510,95%CI:1.067~2.136,P=0.020)、阴道分娩(OR=2.367,95%CI:0.251~22.294,P=0.000)、早发型败血症(OR=2.194,95%CI:1.159~4.155,P=0.016)及抢救复苏史(OR=3.784,95%CI:1.908~7.506,P=0.000)。出血性脑损伤亚组的独立危险因素是阴道分娩(OR=7.195,95%CI:4.249~12.184,P=0.000)和早发型败血症(OR=2.692,95%CI:1.185~6.117,P=0.018)。
表2显示,男性、阴道分娩、胎膜早破、早发型败血症和晚发型败血症是局灶性CWMD的危险因素,复苏抢救史是弥漫性CWMD的危险因素。Logistic回归分析发现,早发型败血症(OR=2.204,95%CI:1.090~4.457,P=0.028)和晚发型败血症(OR=1.606,95%CI:1.034~2.494,P=0.035)是局灶性CWMD的危险因素。
2.3 晚期早产儿脑损伤临床特点 表3显示,非出血性脑损伤亚组临床特点可表现为晚发型败血症、循环障碍、抽搐和喂养困难等,合并代谢性酸中毒、低钠血症、低钙血症,需行机械通气,与MRI未见异常组差异有统计学意义。行Logistic回归分析发现,低钙血症(OR=2.593,95%CI:1.343,5.005,P=0.005)、晚发型败血症(OR=1.533,95%CI:1.012,2.323,P=0.044)和抽搐(OR=4.006,95%CI:1.790,8.970,P=0.001)是非出血性脑损伤亚组的主要临床特点。
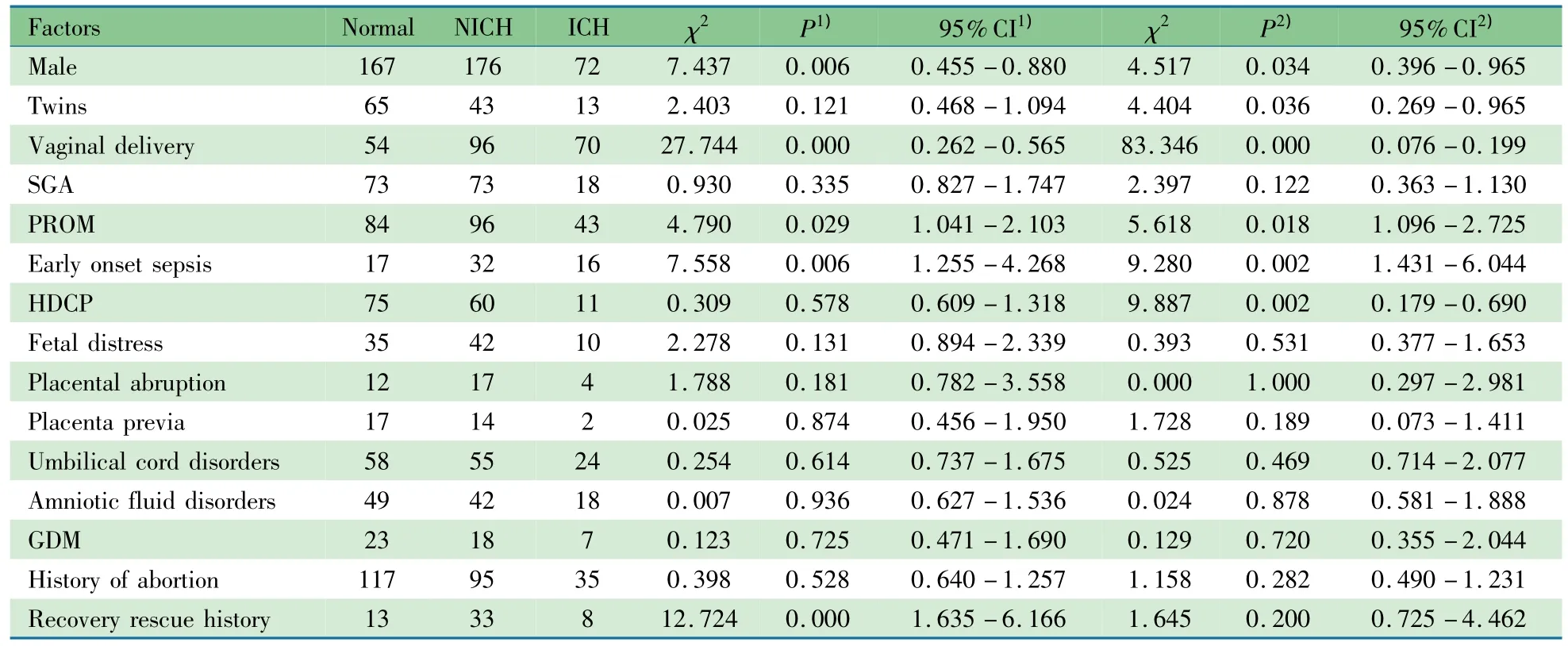
表1 晚期早产儿脑损伤危险因素分析(n)Tab 1 The risk factors of brain injury in late preterm infants(n)
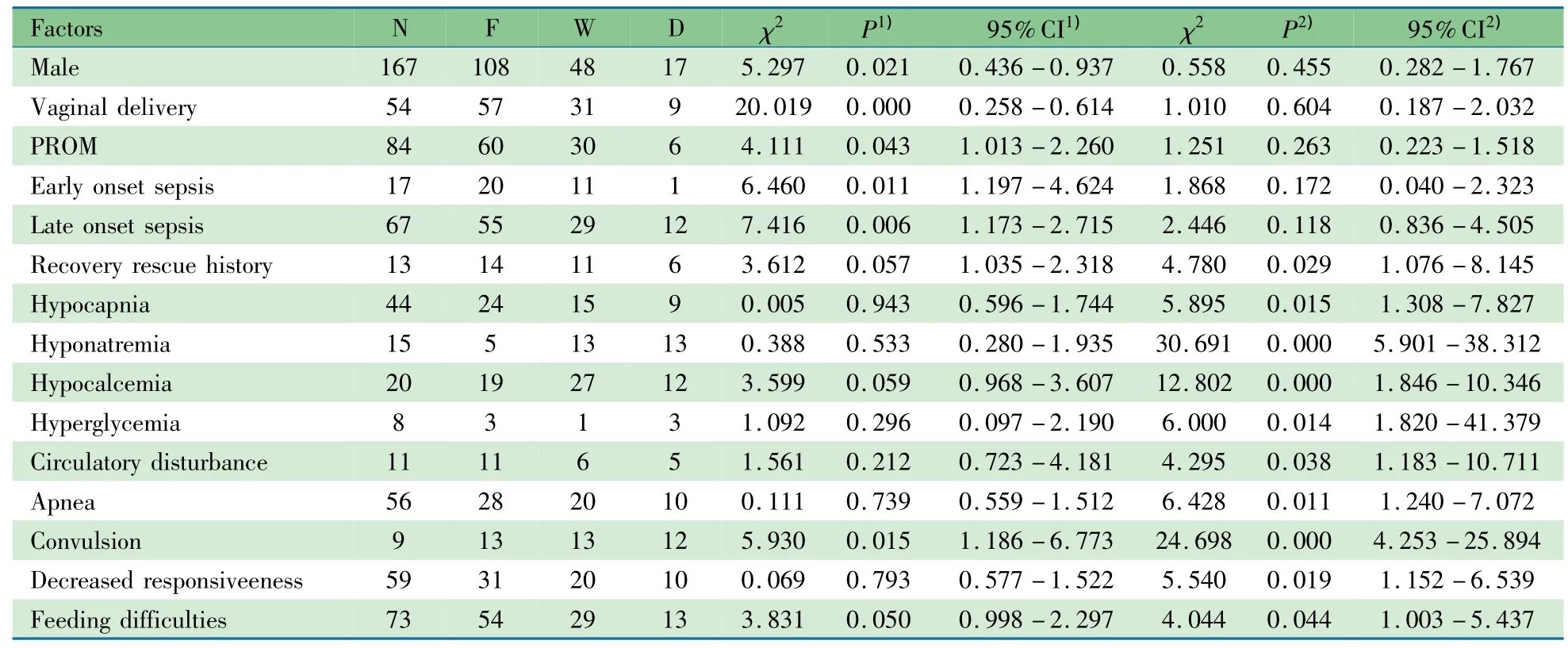
表2 不同类型CWMD的危险因素和临床特点(n)Tab 2 The risk factors and clinical features of different types of CWMD(n)
出血性脑损伤亚组主要表现为高血糖和抽搐。
表2可见,局灶性CWMD常无特异性临床表现,弥漫性CWMD临床特点可表现为低碳酸血症、低钠血症、低钙血症、呼吸暂停、新生儿高血糖、循环障碍、呼吸暂停、抽搐、反应低下、喂养困难等((P<0.05))。Logistic回归分析提示低钠 血 症 (OR=17.276,95%CI:3.875,77.024,P=0.000)、呼吸暂停(OR=4.354,95%CI:1.299,14.597,P=0.017)、抽搐(OR=9.396,95%CI:2.905,30.394,P=0.000)是弥漫性CWMD的临床特点。
2.4 脑损伤部位分布情况 ①非出血性脑损伤亚组:局灶性CWMD 65.3%(111/170)仅累及1处部位,有20例分布在半卵圆中心(3例单侧,17例双侧),仅累及侧脑室后脚91例(48例单侧,43例双侧),既累及半卵圆中心,又累及侧脑室后脚2处44例(25.9%),8.8%(15例)累及侧脑室前后脚及半卵圆中心3处。广泛性CWMD均累及双侧半卵圆中心、侧脑室前后脚,77.9%(60/77)累及胼胝体和内囊,有27例仅累及胼胝体压部,胼胝体和内囊同时受累34例,其中11例合并灰质损伤。弥漫性CWMD 50%(12/24)合并灰质损伤(DWI上背侧丘脑高信号)。②出血性脑损伤亚组:最常见的累及部位是蛛网膜下腔(47例),其次是生发基质-脑室内出血(33例)、硬膜下出血(6例)、小脑出血(2例)、脑实质出血(4例)。余20例为合并出血,其中蛛网膜下腔合并脑室内出血6例,合并小脑出血5例,合并脑实质出血3例。

表3 晚期早产儿脑损伤临床特点分析(n)Tab 3The clinical characteristics of brain injury in late preterm infants(n)
2.5 非出血性损伤亚组异常信号演变与损伤结局 非出血性脑损伤亚组76例复查了MRI,复查时间为生后14.7~25.1(19.9±5.2)d。47.4%病例(36例)病灶范围减少,30.3%病例(23例)病灶消失,22.4%病例(17例)发生了不同程度的软化。
局灶性CWMD 34例复查了MRI:病灶消失达55.9%(19/34),范围减少达41.2%(14/34),表现为DWI信号正常或稍高信号,T1WI高信号,伴有(或)不伴有T2WI高信号,仅有1例发生单侧脑室后脚软化,其第1次MRI显示侧脑室前后脚、半卵圆中心存在3处损伤。
广泛性CWMD 31例复查了MRI:病灶消失达12.9%(4例),范围减少71.0%(22例),5例发生了软化,其中4例累及胼胝体或内囊,1例合并灰质损伤。
弥漫性CWMD 11例复查MRI均发生软化,表现为T2WI高信号,T1WI和DWI均为低信号,均累及胼胝体及内囊,6例合并灰质损伤。不同类型CWMD损伤结局差异有统计学意义。
2.6 MRI序列在不同检查周数对CWMD的诊断价值271例CWMD中有76例复查了MRI,其中23例病灶完全吸收,故统计MRI序列在不同周数CWMD时以324例为基数。表4显示,生后2周内,DWI具有较高的敏感性,98.0%(244/249)表现为高信号,其中生后<7d晚期早产儿100%显示高信号,130/135例(96.3%)在~14d显示高信号,随着检查时间的延长,DWI检查的敏感性降低,到生后第3周仅有50.8%(30/59)表现为高信号,而生后第4周下降至33.3%(4/12),损伤4周以上DWI不再显示高信号。生后晚期(>2周)CWMD诊断依靠T1WI和T2WI,T1WI主要表现为高信号(70.6%,53/75),伴或不伴有T2WI低信号(57.3%,43/75)。

表4 不同时间不同序列信号特点变化[n(%)]Tab 4 Different sequence signal characteristics atdifferent time[n(%)]
2.7 不同类型CWMD在DWI上高信号持续时间比较
170例局灶性CWMD 34例复查MRI,其中19例病灶完全吸收,统计局灶性CWMD在DWI高信号持续时间中以185例为基数;77例广泛性CWMD中31例复查MRI,4例病灶吸收,统计广泛性CWMD在DWI高信号持续时间中以104例为基数;24例弥漫性CWMD 11例复查MRI,全部发生了软化,统计弥散性CWMD在DWI高信号持续时间中以24例为基数。局灶性CWMD生后2周内100%显示DWI高信号,第3周亦有76.9%(20/26)显示高信号,持续到第4周以上仍有33.3%(2/6)呈高信号。广泛性CWMD生后2周91.4%显示DWI高信号(32/35),第3周亦有41.7%呈高信号(10/24),至第4周仍有37.5%为高信号(3/8),弥漫性CWMD在DWI上的高信号仅持续到生后2周(7/10)。
3 讨论
本研究通过大样本病例资料分析,发现晚期早产儿仍是脑损伤发生的高危人群,有51.2%发生不同类型的脑损伤,特别是有阴道分娩、胎膜早破、早发型败血症、复苏抢救史等危险因素者。晚期早产儿CWMD具有一定的特点,虽然绝大部分属于点状(局灶性)损伤,但广泛性和弥漫性CWMD仍有较高比例。尽管蛛网膜下腔出血是颅内出血的主要类型(55.4%),但生发基质-脑室内出血仍不少见,且常合并CWMD。因此对于有高危因素的晚期早产儿,早期行头颅 MRI是必要的。借助 DWI结合常规 MRI对CWMD进行动态评价,发现早期可以应用DWI评价脑损伤,最佳时间在生后2周内;不同类型的脑损伤有不同的损伤结局,局灶性CWMD预后较好,而弥漫性CWMD全部发生软化;目前国内外尚无借助早期 MRI对晚期早产儿CWMD预后判断的研究报道,所以本研究结果对临床有重要的指导意义。
CWMD仍是晚期早产儿脑损伤的主要损伤类型,占41.8%,以局灶性CWMD为主,这与早期早产儿不同,可能是因为早产儿CWMD的易损性有不同的阶段,越不成熟的新生儿有越高的风险[6,21]。孕早期,少突胶质前体细胞是主要的细胞谱系,随着胎龄的增加,不成熟的少突胶质细胞增加,并开始髓鞘化。CWMD被认为是继发于成熟的髓鞘化的白质通路损伤后[6,22]。但严重的广泛性和弥漫性CWMD占15.6%。可能是虽然孕晚期脑发育迅速,但白质区域血管发育仍然落后,而且晚期少突胶质细胞仍是主体,此时如果遭受感染或缺氧缺血等因素,极易导致脑皮质及髓鞘发育落后,从而造成CWMD。
颅内出血中蛛网膜下腔出血为主要类型(55.4%),这与以往报道生发基质和脑室内出血是早产儿颅内出血的常见类型[6]不一致,考虑与研究对象不同有关,既往对于早产儿脑损伤的研究集中在胎龄≤32周早产儿,早产儿脑室室管膜下存在脆弱易破损的胚胎生发层基质(GM),薄壁血管为出血的来源,随着胎龄增加GM进行性减少,36周前基本退化,因此胎龄越小,受各种因素刺激导致出血的发生率越高[23]。本研究主要针对晚期早产儿,其GM逐渐减少,发生脑室内出血的概率降低。
虽然本研究中发现蛛网膜下腔出血是颅内出血的主要类型,但生发基质-脑室内出血仍不少见,且常常合并CWMD,两者具有一定的交叉,本研究中45例室管膜下-脑室内出血病例中,64%合并CWMD。可能与早产儿脑的生理解剖特点有关系,由于早产儿脑发育不成熟,特别是脑循环,脑血管由于自主调节能力有限,处于一种“压力被动型血流”状态,各种原因导致动脉压升高时,不成熟的毛细血管破裂,引起脑室内出血,进而影响神经细胞的发育成熟,造成 CWMD[24]。
本研究发现,早发型败血症是晚期早产儿非出血性脑损伤和出血性脑损伤共同的危险因素;无论是对颅内出血还是CWMD,阴道分娩均是重要的高危因素,与文献报道相一致[25,26]。应加强产前保健,早产儿尽量减少阴道分娩方式。窒息抢救史是非出血性脑损伤的独立危险因素,与文献报道一致[27]。研究还发现,电解质紊乱尤其是低钠血症、低钙血症及抽搐是非出血性脑损伤常见的临床特点,而脑损伤也可以导致电解质紊乱和抽搐,两者相互促进,至于孰先孰后,还有待进一步研究。
由于晚期早产儿脑损伤的发生率仍然很高,临床上借助影像学检查早期发现及诊断显得至关重要。由于头颅超声的局限性,对于弥漫性和更细微的CWMD的阴性预测值较低[28],目前国内外已逐渐开展应用MRI评价早产儿脑损伤[29],Miller等[19]借助T1WI根据病灶累及部位及大小,将CWMD分为轻、中和重度,但无法评价其结局以及动态变化过程。Inder等[30]通过T1WI及T2WI,对脑白质的5项内容分别进行评分,然后根据总分划分为正常、轻度、中度和重度损伤,但该方法属于晚期病理改变,一般在纠正胎龄40周时进行评估。目前国内外很少开展早期的MRI诊断,本研究借助DWI和常规MRI对高危的晚期早产儿进行评价,发现DWI在生后早期有高度敏感性,可以发现常规序列不能发现的损伤,尤其是生后2周内有98.0%患儿的DWI表现为高信号,说明损伤急性期发生细胞毒性水肿或轴突的损伤[31]。具体机制可能是,缺血缺氧后数分钟,ATP生成障碍,钠钾通道发生异常,水进入细胞内引起细胞毒性水肿,水分子弥散运动受限,DWI显示高信号[32]。因此认为,对于存在高危因素的晚期早产儿,在生后2周之内(1周内最佳)进行DWI结合常规MRI检查可以早期发现病变。
不同的CWMD损伤类型以及病灶累及范围多少,其损伤结局可能不同。本研究发现,局灶性CWMD预后良好,有97.1%病灶消失或者范围减少;广泛性CWMD预后较差,软化率16.1%(5例),其中4例累及胼胝体或内囊,有1例合并灰质损伤;而弥漫性CWMD预后极差,100%均发生了不同程度的软化,11例均累及胼胝体及内囊,有6例合并灰质损伤。因此,对于弥漫性和广泛性CWMD,尤其是合并有其他深部白质损伤或灰质损伤时,需要纠正胎龄40周,甚至生后2~3个月继续动态评估其神经系统发育的情况,观察其运动及认知等神经精神发育状况,以便于尽早进行康复训练。
本研究发现局灶性CWMD生后2周内100%显示高信号,且持续时间较长,可持续到3周以上,而弥漫性CWMD高信号仅持续至生后2周以内。有学者研究显示DWI高信号区与细胞毒性水肿和组织病理的神经损伤之间有良好的相关性[33]。1例死亡尸检病例报告指出局灶性CWMD可能与小胶质细胞增生活化有关[34]。文中提出的不论早发型败血症还是晚发型败血症均是局灶性CWMD的独立危险因素,由此说明感染是局灶性CWMD的主要原因,也可以推测局灶性CWMD可能是一种慢性炎症反应。由于感染可发生在宫内,也可发生在生后晚期,均可导致小胶质细胞活化,所以DWI高信号可以持续较长时间。而弥漫性CWMD可能与足月儿的急性缺氧缺血性脑病或脑梗死类似,属于急性缺氧缺血过程,导致细胞毒性水肿,持续时间短。
弥漫性CWMD预后极差,本研究中针对围生期高危因素以及生后血气分析和临床特点进行分析,发现复苏抢救史是弥漫性CWMD的危险因素,但没有发现导致急性缺氧的产前及产时原因,可能与重度脑损伤病例少、病例来源不同有关,本文24例弥漫型CWMD中有11例从外院转入,在获取产前产时等病史资料方面也可能存在一定的偏倚。余13例中有5例羊水胎粪污染,2例宫内窘迫,3例胎盘早剥,1例子 前期重度,2例胎膜早破(时间>24h),均可导致产时窒息,使全身血液重新分布,造成脑血流急剧下降,最终导致分布于脑白质区脑室周围的动脉支配区缺血[27]。生后不久血气分析常常合并代谢性酸中毒、低钠血症和低钙血症等电解质紊乱也可说明是急性缺氧缺血的过程。
本研究存在一定的局限性,如收入院的晚期早产儿大多有高危因素,从而引起导致脑损伤的发生率偏高;同时MRI检查费用较高,未能对所有高危晚期早产儿进行筛查;纳入分析的病例中部分患儿由外院转入,行MRI检查时间较晚,一些可能有脑损伤患儿家属拒绝检查或放弃治疗未能随访。没有进行表观扩散系数(ADC)值的测定。未能进行弥散张量成像(DTI)对早产儿CWMD定量评估。缺少更远期的神经精神发育情况的随访。
综上所述,高危晚期早产儿脑损伤发病率不容忽视,是多种因素相互作用的结果。晚期早产儿仍然容易受到产前、产时因素影响而发生不同类型的脑损伤。DWI具有重要的早期诊断价值,可选择生后2周内(1周内最佳)对高危儿进行DWI和常规MRI检查,以早期发现病变。局灶性CWMD预后较好,通常不会发生软化,而合并有深部白质病变或灰质损伤者或弥漫性CWMD预后极差,需要继续动态随访,并进行早期康复训练。
[1]RajuTN, Higgins RD,Stark AR, et al.Optimizing care and outcome for late-preterm(near-term)infants:a summary of the workshop sponsored by the National Institute of Child Health and Human Development.Pediatrics, 2006,118(3):1207-1214
[2]Morse SB,Zheng H,Tang Y,et al.Early school-age outcomes of late preterm infants.Pediatrics,2009,123(4):622-629
[3]Engle WA,Tomashek KM,Wallman C,et al."Late-preterm"infants:a population at risk.Pediatrics,2007, 120(6):1390-1401
[4]Limperopoulos C, Soul JS, Gauvreau K, et al.Late gestation cerebellar growth is rapid and impeded by premature birth.Pediatrics, 2005 ,115(3):688-695
[5]Guihard-Costa AM, Larroche JC.Differential growth between the fetal brain and its in fratentorial part.Early Hum Dev,1990,23(1):27-40
[6]Kinney HC.The near-term(late preterm)human brain and risk for periventricular leukomalacia:a review.Semin Perinatol, 2006,30(2):81-88
[7]Huppi PS, Warfield S, Kikinis R, et al.Quantitative magnetic resonance imaging of braindevelopment in premature and mature newborns.Ann Neurol, 1998, 43(2):224-235
[8]Ballabh P.Anatomic analysis of blood vessels in germinal matrix, cerebral cortex, and white matter indeveloping infants.Pediatr Res, 2004,56(1):117-124
[9]Petrini JR, DiasT, McCormick MC, et al.Increased risk of adverse neurological development for late preterm infants.J Pediatr,2009 ,154(2):169-176
[10]Carrie K.Infants born late preterm:epidemiology, trends, and morbidity risk.Neo Reviews, 2009,10:287-294
[11]Chen D(陈丹),Mao J,Li J, et al.Clinical and imaging features in late preterm infants with cerebral white matterdamage.Chin J Contemp Pediatr(中国当代儿科杂志),2010,5(12):321-326
[12]Ferriero DM, Miller SP.Imaging selective vulnerability in thedeveloping nervous system.J Anat, 2010,217(4):429-435
[13]Papile LA, Burstein J, Burstein R, et al. Incidence and evolution of subependymal and intraventricular hemorrhage: a study of infantswith birthweights less than 1, 500 gm. J Pediatr, 1978, 92( 4) : 529-534
[14]Saliba E, Marret S. Cerebral white matter damage in the preterm infant: pathophysiology and risk factors. Semin Neonatol, 2001, 6 ( 2) : 121-133
[15]Volpe JJ.Neurology of the newborn, 3rd ed.Philadelphia:W.B.SaundersCompany,1995.
[16]Heljic S, Maksic H, Buljina A, et al.Hemorrhagic andhypoxic-ischemic brain lesions in premature infants on artificial ventilationypertension.Med Arh,2000,54(5-6):265-267
[17]Love S. Acute haemorrhagic and hypoxic-ischaemic brain damage in the neonate. Curr Diagn Pathol, 2004, 10( 2) :106-115
[18]Kidokoro H, Okumura A, Kato T, et al. Mild oliguria in preterm infantswho later developed periventricular leukomalacia. Brain Dev, 2007, 29( 3) : 142-146
[19]Murata Y, Itakura A,Matsuzawa K, et a.l Possible antenatal and perinatal related factors indevelopment of cystic periventricular leukomalacia.Brain Dev, 2005,
[20]Ng E, Shah V. Erythromycin for the prevention and treatment offeeding intolerance in preterm infants. Cochrane Database Syst Rev, 2008, 16( 3) : CD001815
[21]Rezaie P, Dean A. Periventricular leukomalacia, inflammation and white matter lesions within the developing nervous system. Neuropathology, 2002, 22( 3) : 106-132
[22]Haynes RL, Borenstein NS, DesilvaTM, et al.Axonaldevelopment in the cerebral white matter of thehuman fetus and infant.J Comp Neurol, 2005, 484(2):156-167
[23]Colvin M,McGuire W,Fowlie PW.Neurodevelopmental outcomes after preterm birth.BMJ,2004,329(7479):1390-1393
[24]Khwaja O, Volpe J.Pathogenesis of cerebral white matter injure of pretermaturity.Arch Dis Child Fetal Neonatal Ed,2008,93(2):F153-F161
[25]Osborn DA, Evans N, Kluckow M. Hemodynamic and antecedent risk factors of early and late periventricular / intraventricular hemorrhage in premature infants. Pediatrics,2003, 112( 1 Pt 1) : 33-39
[26]Deulofeut R, Sola A, Lee B, et al. The impact of vaginal delivery in premature infants weighing less than 1,251 grams.Obstet Gynecol,2005,105( 3) : 525-531
[27]Distefano G, Praticò AD. Actualities on molecular pathogenesis and repairing processes of cerebral damage in perinatal hypoxic-ischemic encephalopathy. Ital J Pediatr, 2010, 36: 63
[28]DebillonT, N'Guyen S, Muet A, et al.Limitations of ultrasonography fordiagnosing white matterdamage in preterm infants.Arch Dis Child Fetal Neonatal Ed,2003,88(4):F275-279
[29]Miller SP, Ferriero DM, Leonard C, et al.Early brain injury in premature newborns detected with magnetic resonance imaging is associated with adverse early neuro developmental outcome.J Pediatr, 2005,147(5):609-616
[30]InderTE, Wells SJ, Mogridge NB, et al.Defining the nature of the cerebral abnormalities in the premature infant:a qualitative magnetic resonance imaging study.J Pediatr, 2003,143(2):171-179
[31]van Everdingen KJ, vander Grond J, Kappelle LJ, et al.Diffusion-weighted magnetic resonance imaging in acute stroke.Stroke,1998, 29(9):1783-1790
[32]Sie LT, Hart AA, van Hof J,et al.Predictive value of neonatal MRI with respect to late MRI findings and clinical outcome.A study in infants with periventricular densities on neonatal ultrasound.Neuropediatrics,2005,36(2):78-89
[33]Roelants-van Rijn AM, Nikkels PG, Groenendaal F, et al. Neonatal diffusion-weighted MR imaging: relation with histopathology or follow-up MR examination. Neuropediatrics,2001, 32( 6) : 286-294
[34]Rutherford MA, Supramaniam V, Ederies A, et al. Magnetic resonance imaging of white matter diseases of prematurity. Neuroradiology, 2010, 52( 6) : 505-521
