全反式维甲酸抑制IL-23/IL-17通路促进小鼠移植皮肤存活的研究*
2013-12-03徐三荣
徐三荣 周 庆 韩 博 李 伟
近年来研究发现机体的免疫系统中存在着一种新的CD4+T细胞亚群,以高水平分泌白细胞介素(IL)-17,并表达转录因子孤核受体(ROR)γt为主要特征,被命名为Th17细胞[1]。已证实,Th17细胞在自身免疫性疾病和移植排斥反应的发生和发展中发挥重要的作用,其分化和功能受IL-23的调控[2-3]。全反式维甲酸(ATRA)是维生素A的一种活性代谢产物,在抑制Th17细胞的分化和扩增中发挥重要的作用[4]。本研究以小鼠皮肤移植为模型,探讨ATRA对IL-23和IL-17表达的影响及机制。
1 材料与方法
1.1 材料 (1)实验动物。近交系、SPF级雄性Balb/c(H-2d)小鼠60只和DBA/2(H-2d)小鼠15只,6~8周龄,体质量18~22 g,购于中科院上海实验动物中心,饲养于江苏大学实验动物中心,自由摄食和饮水。(2)主要试剂及仪器。iCycler iQ实时荧光定量聚合酶链反应(Real-time PCR)仪、GelDoc1000凝胶成像系统(美国BioRad公司),ATRA(美国Sigma公司),总RNA提取试剂Trizol、逆转录试剂盒和Real-time PCR反应试剂盒(日本Ta⁃KaRa公司),IL-23和IL-17定量酶联免疫吸附测定(ELISA)试剂盒(上海森雄科技实业有限公司)。
1.2 方法
1.2.1 实验分组 以DBA/2小鼠为供者,Balb/c小鼠为受者,进行背-背部皮肤移植。受者小鼠随机分为对照组、小剂量组、大剂量组共3组,每组20只,术后5 d每组处死10只用于皮肤移植物和血液标本收集及检测,另外10只用于术后生存分析。于移植前1 d至术后14 d或判定移植皮肤死亡之日,对照组每天以玉米油(0.25 mL)灌胃;小剂量组、大剂量组每天分别给予ATRA 10、30 mg/kg(溶解于玉米油)灌胃。
1.2.2 皮肤移植 取DBA/2供者小鼠,腹腔注射5 g/L的戊巴比妥钠麻醉,备皮、消毒后取直径约1 cm的圆形背侧全厚皮肤,刮除皮下脂肪及血管等组织,放于无菌生理盐水中备用。Balb/c受者小鼠麻醉、备皮、消毒后,剪去左侧胸腹交界处直径约1 cm圆形皮肤。将供者皮肤覆盖于受者创面上,用4-0丝线间断缝合,医用创可贴稍加压包扎固定,5 d后去除敷料,以后观察皮肤存活情况。50%以上结痂、坏死、变硬或脱落视为皮肤死亡。
1.2.3 样本的收集与制备 移植术后5 d,每组分别取10只小鼠,颈椎脱臼法处死,留取血液和皮肤移植物样本。血液于室温下静置1 h,待其凝固,1 500×g离心10 min,吸取上清,-80℃下保存待用。皮肤组织部分浸泡于4%中性甲醛溶液用于病理切片,部分放入液氮中,并移至-80℃冰箱备用。
1.2.4 检测方法 (1)HE染色检测皮肤移植物。取中性甲醛固定后的皮肤移植物,常规石蜡切片,HE染色,光镜下观察。(2)ELISA测定血清IL-23、IL-17水平。室温下充分解冻血清样本,按试剂盒说明书操作,每个样品均设2个复孔。反应终止后,用Biotek酶标仪检测450 nm光密度(OD)值。用Curve Expert 1.3软件绘制标准曲线,计算样本OD值对应的浓度。(3)Real-time PCR检测皮肤移植物IL-23、RORγt和IL-17 mRNA表达。参照GenBank序列,应用Primer Express 5.0软件设计引物,引物序列见表1,由上海生工生物工程有限公司合成。采用三步法PCR扩增标准程序,反应体系30 μL,预变性94℃5 min,PCR反应94℃ 20 s,53℃ 30 s,72℃30 s,40个循环。根据动力学曲线确定各样品管中荧光强度增加到某一特定阈值时的扩增循环数(Ct值)。以目的基因与内参基因(β-actin)Ct值的差值(△Ct)表示基因的相对表达水平,△Ct值越大,mRNA的相对表达水平越低。
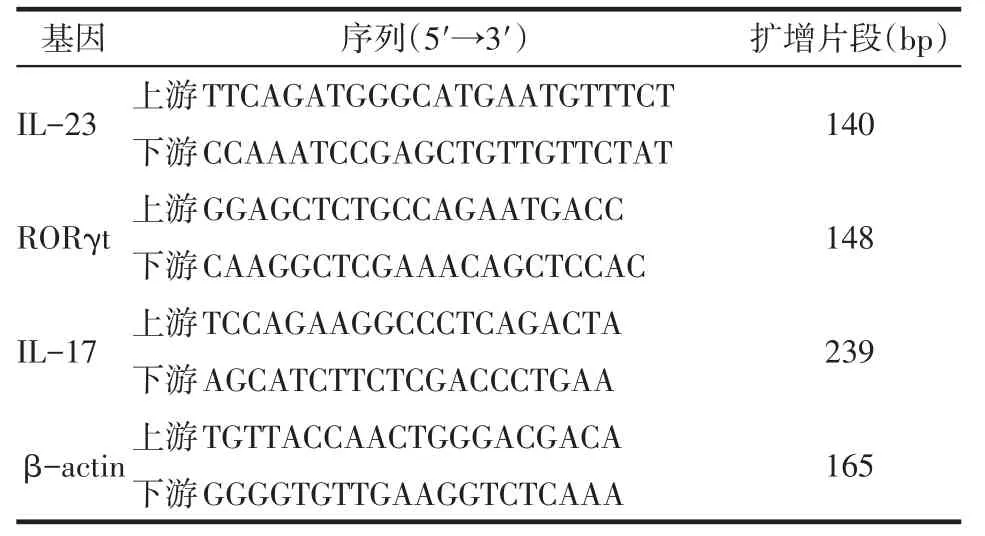
Table 1 Primer sequences表1 引物序列
1.3 统计学方法 应用SPSS 13.0统计软件进行分析,计量数据以均数±标准差(±ss)表示,多组间比较采用单因素方差分析,组间多重比较采用q检验,存活时间比较应用Log-Rank法,相关性分析采用Pearson直线相关,Plt;0.05为差异有统计学意义。
2 结果
2.1 各组皮肤移植物存活时间 对照组、小剂量组和大剂量组皮肤移植物中位存活期分别为13、16、15.5 d,小剂量组、大剂量组高于对照组(χ2分别为16.900、9.915,均Plt;0.01),而小剂量组、大剂量组间比较差异无统计学意义(χ2=0.054,P=0.817),见图1。

Figure 1 Survival curves of skin grafts in three group图1 各组皮肤移植物的生存曲线
2.2 各组皮肤移植物组织学观察 移植术后5 d,HE染色显示对照组皮肤有少量的淋巴细胞浸润,皮肤组织结构分离,分级为Ⅱ级;而小剂量组和大剂量组可见散在的淋巴细胞浸润,皮肤层次结构及附属器形态完整,分级均为Ⅰ级,见图2。
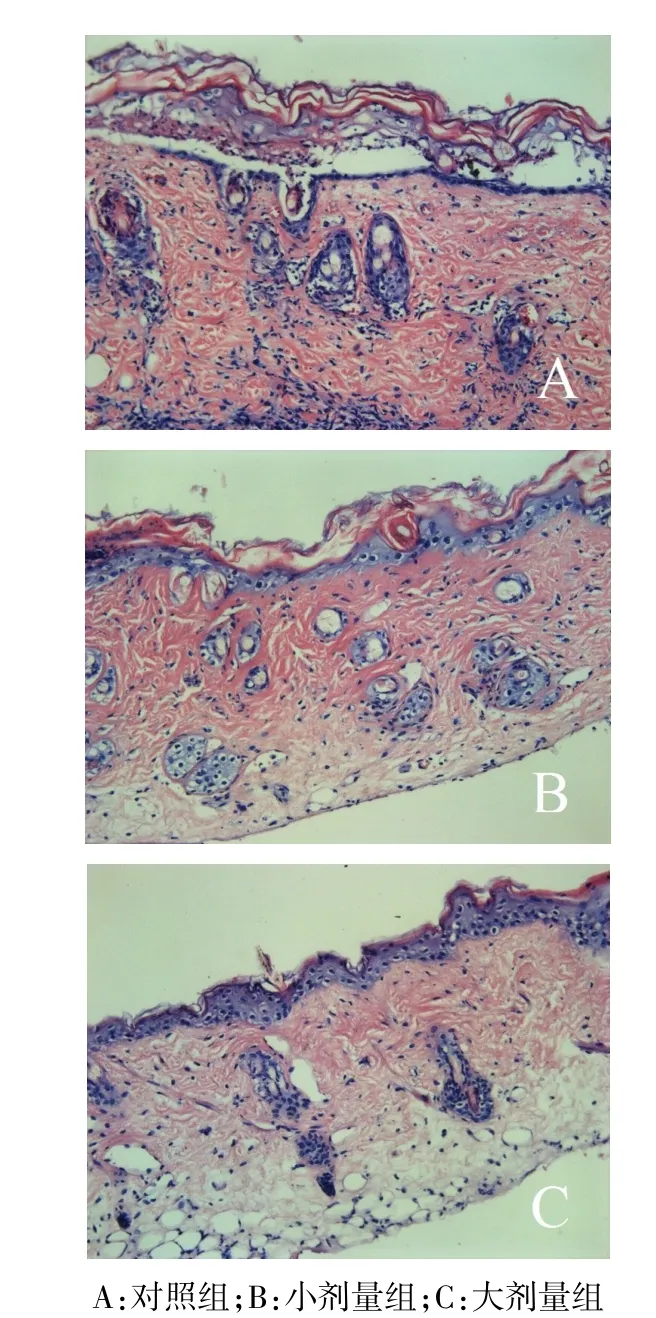
Figure 2 The histological examination of skin grafts on 5 days after transplantation(HE,×200)图2 皮肤移植术后5 d组织病理学检查(HE,×200)
2.3 各组小鼠血清中IL-23、IL-17水平 皮肤移植术后5 d,小剂量组和大剂量组血清IL-23水平较对照组降低(Plt;0.05),而前2组间比较差异无统计学意义;对照组、小剂量组及大剂量组血清IL-17水平依次降低,差异均有统计学意义(Plt;0.05),见表2。3组受者血清IL-23水平与IL-17水平呈正相关(r=0.712,Plt;0.01)。

Table 2 Comparison of serum levels of IL-23 and IL-17 between three groups表2 各组血清中IL-23、IL-17水平比较(n=10,ng/L,x±s)
2.4 各组受者皮肤移植物IL-23、RORγt和IL-17 mRNA表达水平 皮肤移植术后5 d,小剂量组、大剂量组IL-23、RORγt和IL-17 mRNA的表达水平均低于对照组(Plt;0.05),而大、小剂量组间比较差异均无统计学意义,见表3。3组小鼠皮肤移植物IL-23与IL-17基因表达水平呈正相关(r=0.515,Plt;0.05),RORγt与IL-23、IL-17基因表达水平亦呈正相关(r分别为0.430、0.417,均Plt;0.05)。

Table 3 Relative expression levels of IL-23,RORγt and IL-17 mRNA in skin grafts between three groups表3 3组皮肤移植物中IL-23、RORγt和IL-17 mRNA相对表达水平(n=10,△CT,x±s)
3 讨论
传统认为Th1/Th2途径是移植排斥反应发生的主要机制。而近来研究表明,Th17细胞也参与了急性排斥反应的发生、发展[5],其主要效应因子是IL-17,IL-17具有强大的致炎性,主要是通过刺激基质细胞、内皮细胞、上皮细胞和巨噬细胞产生IL-6、IL-8、肿瘤坏死因子(TNF)-α和IL-1β等促炎细胞因子,介导中性粒细胞在急性炎症部位聚集,从而诱导前炎症反应[6]。Gorbacheva等[7]通过将A/J小鼠心脏移植给IL-17基因敲除的Balb/c小鼠,研究表明IL-17在移植早期具有趋化效应性T细胞到移植物中的作用,从而加大了移植炎症反应及组织损伤。而应用IL-17R:IgG-Fc中和IL-17能使T细胞对异型抗原的增生反应受到抑制,明显减轻移植物的排异反应[8]。IL-23是维持Th17细胞增殖和存活的重要细胞因子,属于IL-12细胞因子超家族,是由IL-23p19亚基和IL-12p40亚基组成的异二聚体,主要由活化的抗原递呈细胞分泌产生[9]。早期研究表明IL-23在Th17细胞的增殖分化过程中起重要作用,但随后的研究证实初始T细胞不表达IL-23R,因此,有研究认为IL-23在初始T细胞向Th17分化早期不能发挥作用,但IL-23对Th17细胞后期的增殖存活以及功能的维持具有促进作用[10-11]。熊俊杰等[12]在大鼠胰岛移植中将IL-23R抗体注射到大鼠体内阻断IL-23R,有效降低了IL-17的表达,且其抑制作用为剂量依赖性,表明IL-23对IL-17表达的促进作用可以被IL-23R抗体抑制。ATRA目前被广泛用于角化异常性皮肤病及急性早幼粒细胞白血病的治疗,其生物学效应主要是通过核内维甲酸受体(RAR)和维甲酸X受体(RXR)来介导。近年来有报道ATRA通过与RAR结合下调维甲酸相关RORγt的表达而抑制Th17细胞的分化[13],及通过减少IL-6R、IL-23R的表达而抑制Th17细胞的功能[4]。
本研究以主要组织相容性复合体(MHC)相同而次要淋巴细胞刺激抗原(MLS)不同的DBA(H-2d)与Balb/c(H-2d)小鼠建立皮肤移植模型,结果表明ATRA有效延缓皮肤移植排斥反应的机制可能与降低IL-23、RORγt和IL-17的mRNA表达,从而抑制IL-23与IL-17的分泌有关。相关性分析表明IL-23对IL-17的分泌可能有促进作用,而其作用可以被ATRA阻断。虽然随着ATRA剂量的增大,对IL-17蛋白分泌的抑制作用也显著增强,且皮肤移植物存活时间并没有相应的延长,可能原因是ATRA对抗炎症反应复杂,并不仅仅依赖对Th17细胞的抑制,而是Th1/Th17、Th1/Th2和Tregs/Th17平衡等机制共同作用的结果,在以后的研究中将进一步探讨其机制。
[1]Park H,Li Z,Yang XO,et al.A distinct lineage of CD4 T cells regu⁃lates tissue inflammation by producing interleukin 17[J].Nat Immu⁃nol,2005,6(11):1133-1141.
[2]Lyakh L,Trinchieri G,Provezza L,et al.Regulation of interleukin-12/interleukin-23 production and the T-helper 17 response in humans[J].Immunol Rev,2008,226:112-131.
[3]Liu XC,Zhai A,Li JQ,et al.Interleukin-23 promotes natural killer T-cell production of IL-17 during rat liver transplantation[J].Trans⁃plant Proc,2011,43(5):1962-1966.
[4]Xiao S,Jin H,Korn T,et al.Retinoic acid increases Foxp3+regula⁃tory T cells and inhibits development of Th17 cells by enhancing TGF-beta-driven Smad3 signaling and inhibiting IL-6 and IL-23 receptor expression[J].J Immunol,2008,181(4):2277-2284.
[5]Afzali B,Lombardi G,Lechler RI,et al.The role of T helper 17(Th17)and regulatory T cells(Treg)in human organ transplantation and au⁃toimmune disease[J].Clin Exp Immunol,2007,148(1):32-46.
[6]Jovanovic DV,Di Battista JA,Martel-Pelletier J,et al.IL-17 stimu⁃lates the production and expression of proinflammatory cytokines,IL-beta and TNF-alpha,by human macrophages[J].J Immunol,1998,160(7):3513-3521.
[7]Gorbacheva V,Fan R,Li X,et al.Interleukin-17 promotes early al⁃lograft inflammation[J].Am J Pathol,2010,177(3):1265-1273.
[8]Antonysamy MA,Fanslow WC,Fu F,et al.Evidence for a role of IL-17 in alloimmunity:a novel IL-17 antagonist promotes heart graft survival[J].Transplant Proc,1999,31(1-2):93.
[9]Cooper AM,Khader SA.IL-12p40:an inherently agonistic cytokine[J].Trends Immunol,2007,28(1):33-38.
[10]Iwakura Y,Ishigame H.The IL-23/IL-17 axis in inflammation[J].J Clin Invest,2006,116(5):1218-1222.
[11]Langrish CL,Chen Y,Blumenschein WM,et al.IL-23 drives a pathogenic T cell population that induces autoimmune inflammation[J].J Exp Med,2005,201(2):233-240.
[12]熊俊杰,陆慧敏,杜晓炯,等.Th17细胞在胰岛移植中的作用[J].四川大学学报(医学版),2010,41(4):638-643.
[13]Schambach F,Schupp M,Lazar MA,et al.Activation of retinoic acid receptor-alpha favours regulatory T cell induction at the expense of IL-17-secreting T helper cell differentiation[J].Eur J Immunol,2007,37(9):2396-2399.
