循环牵张应力对人骨关节炎软骨细胞增殖的影响*
2013-12-03孙晓雷马信龙李秀兰马剑雄
孙晓雷 赵 斌, 马信龙,△ 李秀兰 马剑雄 李 爽 杨 强
骨关节炎(osteoarthritis,OA)是关节疾病中最常见的类型之一,其病理过程以软骨细胞的凋亡和软骨基质的破坏为特征[1]。软骨组织是覆盖在关节面上的无血管特殊结缔组织,时刻受到内源性和外源性的力学刺激[2],一定范围的力学刺激对维持关节软骨结构功能的完整性起着重要作用。有研究发现,对体外培养的软骨细胞加载不同类型的力学刺激,会产生不同程度的细胞生物学变化[3-4]。因此,本实验对体外培养的人OA软骨细胞施加不同大小的循环牵张应力,观察其对细胞增殖的影响,旨在研究循环牵张应力与人OA软骨细胞力学应答的关系,并为OA的预防与治疗提供新的理论依据。
1 材料与方法
1.1 主要试剂及仪器 DMEM培养基、胎牛血清(Gibco,美国),EDTA、胰蛋白酶、Ⅱ型胶原酶(Sigma,美国),多克隆兔抗人Ⅱ型胶原一抗、FITC标记的羊抗兔IgG(博士德,武汉),甲苯胺蓝、番红O染液(东胜泰博,北京);ElectroForce 3200力学实验仪、BioDynamic生物反应仓系统(Bose,美国),倒置相差显微镜(Olympus,日本),恒温摇床(Heidolph,德国),流式细胞仪(BD,美国),CO2培养箱(Hera-cell,德国)。
1.2 方法
1.2.1 标本取材 软骨组织取自1例66岁女性左膝骨关节炎患者,在患者知情同意的情况下于手术治疗时取少量软骨组织,取材时严格无菌操作,取材组织部分行病理切片HE染色,参考Collins病理学分级标准对所取组织退变程度进行分级。其余组织均在取材后2 h内进行分离培养。
1.2.2 软骨细胞体外分离和培养 将所取组织用含抗生素的D-Hank’s液浸泡5 min,再用D-Hank’s液冲洗2遍,去除软骨组织上沾染的血液和脂肪组织,剪成1 mm×1 mm×1 mm大小的组织块,加入含0.02%EDTA和0.25%胰蛋白酶的消化液,37℃摇床消化30 min;弃去消化液,加入含0.25%胰蛋白酶、0.2%Ⅱ型胶原酶的消化酶摇匀,4℃冰箱过夜消化后,再置于摇床37℃消化2 h,至组织块基本完全消化。加1 mL FBS终止消化,200目钢网过滤,将滤液移至离心管,1 500 r/min离心7 min,弃上清,用含10%FBS的H-DMEM培养液重悬,细胞计数板计数,以密度为5×104个/mL接种于底面积为25 cm2的细胞培养瓶。24 h后半量换液,之后2 d换液1次,待细胞达80%~90%融合时消化传代。
1.2.3 软骨细胞的鉴定 (1)形态学观察:倒置相差显微镜下观察软骨细胞形态。(2)甲苯胺蓝染色:第一代细胞爬片至70%~80%融合时,将细胞爬片取出,用新配的4%多聚甲醛固定30 min,1%甲苯胺蓝染色10 min,PBS清洗,二甲苯透明,中性树脂封片,光镜下观察细胞分泌糖胺聚糖的能力。(3)番红O染色:第一代细胞爬片至70%~80%融合时,将细胞爬片取出,用新配的4%多聚甲醛固定30 min,1%番红O染色10 min,PBS清洗,二甲苯透明,中性树脂封片,光镜下观察细胞分泌蛋白多糖的能力。(4)Ⅱ型胶原免疫荧光染色:第一代细胞爬片至70%~80%融合时,将细胞爬片取出,用新配的4%多聚甲醛固定30 min,将爬片固定于载玻片上,0.1%Triton X-100打孔30 min,PBS冲洗;3%H2O215 min灭活内源性过氧化氢酶,PBS冲洗;羊血清封闭液15 min,晾干;滴加1∶100稀释兔抗人Ⅱ型胶原多克隆抗体,湿盒内4℃过夜,PBS冲洗;滴加FITC标记的羊抗兔IgG,避光孵育2 h,PBS冲洗,荧光显微镜下观察。
1.2.4 循环牵张应力加载 力学加载采用美国Bose公司BioDynamic细胞力学加载系统,见图1,该系统以硅橡胶膜为细胞力学加载载体,配合ElectroForce3200动力加载,整个系统由Bose PCI和Win Testing系统联合控制持续时间、拉伸长度、拉伸频率等力学参数,使硅橡胶膜产生精确变形,使培养在其上面的细胞同时受到拉伸作用。细胞所受力的大小以硅橡胶膜拉伸应变率(%)表示,应变率越大,表示细胞所受牵张应力越大。取P3代软骨细胞,调整细胞悬液密度为3×105/mL,将700 μL细胞悬液滴加到4 cm×2 cm大小的硅橡胶膜上,培养24 h后,将其置于BioDynamic生物反应仓内进行力学加载。基于预实验及文献[5]报道,实验分为以下4组:空白对照组(0应变组)、5%拉伸应变组、10%拉伸应变组、15%拉伸应变组,每组3个样本。加载频率为0.25 Hz,加载时间为3 h。培养液储存罐置于37℃5%CO2培养箱中,由管道与反应仓相连。蠕动泵以15 mL/min的速度使培养基在整个系统中循环,以此来保证加载过程中反应仓内的温度及CO2浓度。
1.2.5 流式细胞仪测定细胞周期 细胞加载结束后,细胞培养箱中继续培养24 h,给予细胞充分反应时间。酶消化法消化各组细胞,2 000 r/min离心5 min,去上清,用无菌D-Hank’s液轻微漂洗2次,75%冷乙醇固定;细胞2 000 r/min离心5 min,去上清,加入500 μL RNA酶,37 ℃孵育30 min;2 000 r/min离心5 min,去上清,加500 μL碘化丙啶,室温避光孵育30 min,300目筛过滤,上机。流式细胞仪检测细胞DNA含量和细胞周期,采用Flow Plus软件处理数据。根据细胞周期中G0/G1期和G2/M期细胞比例来计算S期细胞比例(%)及细胞增殖指数(proliferative index,PI)。公式为:S期(%)=1-[G0/G1期(%)+G2/M期(%)],PI(%)=S期(%)+G2/M期(%)。
1.3 统计学方法 采用SPSS 18.0软件进行分析,数据以均数±标准差(±s)表示,多组比较采用单因素方差分析,组间多重比较采用LSD-t法。Plt;0.05为差异有统计学意义。
2 结果
2.1 软骨组织大体观及病理表现 大体观:关节软骨失去原有光泽,颜色明显变暗,股骨外侧髁关节软骨表面有缺损,软骨下骨外露,见图2A。镜下可见软骨纵行裂隙形成,呈纤绒样变,细胞排列紊乱,在软骨深层见细胞聚集现象,见图2B。结合患者临床及病理资料,关节软骨为中、重度退变。
2.2 软骨细胞培养及形态学观察 倒置相差显微镜下示:刚接种的原代软骨细胞呈圆形或椭圆形,12~16 h开始贴壁生长,细胞核呈圆形,胞质丰富;24 h后贴壁细胞开始伸展、增殖,呈三角形、长梭形或多角形;7 d后增长至爬满瓶底,胞体丰富,胞浆均匀,核大而圆。传代后软骨细胞形态良好,呈克隆样生长,细胞间互相连接呈“铺路石样”状态。见图3。
2.3 软骨细胞鉴定 甲苯胺蓝染色结果显示细胞质呈蓝色,说明细胞可分泌糖胺多糖;番红O染色结果显示细胞质被染成红色,说明细胞可分泌蛋白多糖;Ⅱ型胶原免疫荧光染色显示胞质呈绿色荧光,说明细胞能够分泌合成Ⅱ型胶原,见图4。以上结果均提示培养细胞为软骨细胞。
2.4 不同循环牵张应力对人骨关节炎软骨细胞增殖的影响 在选定的0、5%、10%及15%4个应变点,随着刺激的增大,S期细胞百分比先逐渐增加而后减弱,在10%应变组软骨细胞增殖最佳,5%、10%、15%应变组均高于0应变组(Plt;0.05),10%应变组高于5%应变组(Plt;0.05),但5%、10%应变组与15%应变组比较差异均无统计学意义(Pgt;0.05)。PI亦随着刺激的增大先逐渐增强而后减弱,各组间比较差异均有统计学意义(Plt;0.05),见表1。

Table 1 Effects of cyclic stretch strain on the proliferation of human degenerative articular chondrocytes表1 不同循环牵张应力对人退变软骨细胞增殖的影响(n=6,%,x±s)
3 讨论
3.1 关节软骨退变及其修复 OA是关节疾病中最常见的类型之一。流行病学调查显示,中老年人群中60%有明显OA的影像学改变[6]。疾病主要累及负重的大关节,其病理过程以关节软骨基质的降解破坏为特征,而生理学认为成熟的软骨组织无血液支配,组织损伤后无凝血及炎症因子的释放,亦无血液中未分化细胞向损伤部位的迁移,并且软骨细胞为终末细胞,其增殖和迁移能力极差,因此软骨损伤与退变后的修复能力很差。另外,软骨组织没有神经支配,理论上软骨细胞通过血液和神经的信息传导系统接受环境变化的信号极其有限。Wu等[7-8]研究证实软骨细胞对应变的感应非常敏感,能使细胞获得环境变化的足够信息。
软骨退变是OA共有的基础病理过程,基于软骨组织本身特点,认为软骨退变是一个不可逆转的过程。但临床发现OA患者骨赘表面软骨可分泌Ⅱ型胶原,即证实其软骨为透明软骨,且作为对关节退变的代偿反应,其透明软骨是由关节软骨增殖迁移到周边骨质的。另有部分OA患者随着病程发展到一定阶段,其临床症状逐渐减轻甚至消失,部分退变软骨面得到修复并稳定下来;并且进行截骨术矫正关节负重力线后,退变软骨出现修复现象。以上现象均提示退变的软骨具有恢复正常生理功能的潜能。
3.2 关节软骨与细胞力学 关节软骨在体内处于复杂的生理力学环境[9]。这些机械刺激是维持关节软骨正常结构和功能的重要因素。岳海涛等[10-11]研究表明周期性机械应力有利于模拟体内的生理环境,能显著促进组织工程软骨的质量。Xu等[12]对大鼠终板软骨细胞加载间歇循环机械张力(0.5 Hz,10%形变,4 h/d,5 d/周),结果发现张力刺激可促进终板软骨细胞增殖。Thomopoulos等[5]对三维体外培养模型中的骨髓间充质干细胞(MSC)加载循环拉伸张力(1 Hz,10%形变,共培养7 d),结果显示循环拉伸张力可促进纺锤状细胞形成,上调Ⅰ型胶原和糖胺多糖(GAG)合成。由此笔者认为,适当的张力可促进软骨细胞增殖及基质合成代谢,维持软骨细胞的正常结构和功能,而超出软骨细胞承载范围的张力则可能抑制细胞增殖,使细胞结构功能和完整性受到破坏,进而损伤关节软骨。损伤的软骨组织承受力学刺激的能力减弱,可能进一步加重力学刺激,形成恶性循环,直至软骨组织结构及功能完全丧失。
本实验所用退变关节软骨为1例66岁老年女性OA患者手术标本,通过病理学方法评价其退变程度。体外分离培养软骨细胞,对细胞施加不同大小循环牵张应力刺激,观察应力刺激性细胞的增殖情况。此方法排除了炎性因子以及其他混杂因素的干扰,从细胞水平研究了单纯循环牵张应力刺激对软骨细胞的影响。结果显示与0应变组相比,各应变组S期细胞百分比与PI均增加,以10%应变组最为明显,由此认为应力对软骨细胞增殖有一定影响,并且10%~15%的应变区间可能是人OA软骨细胞增殖最佳的应力范围。
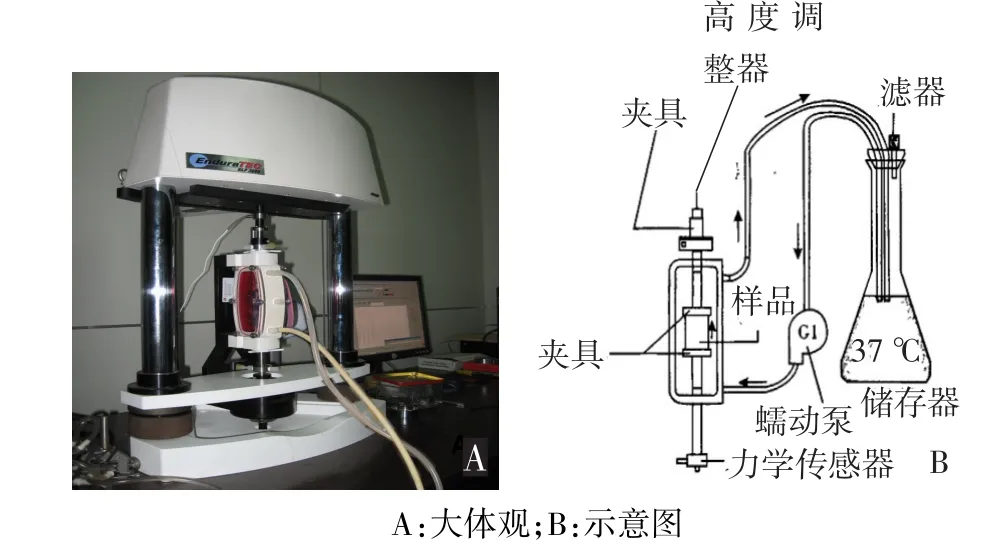
Figure 1 The EF3200 mechanical loading system equipped with BioDynamic bioreactor图1 ElectroForce3200力学加载系统搭载BioDynamic生物反应仓
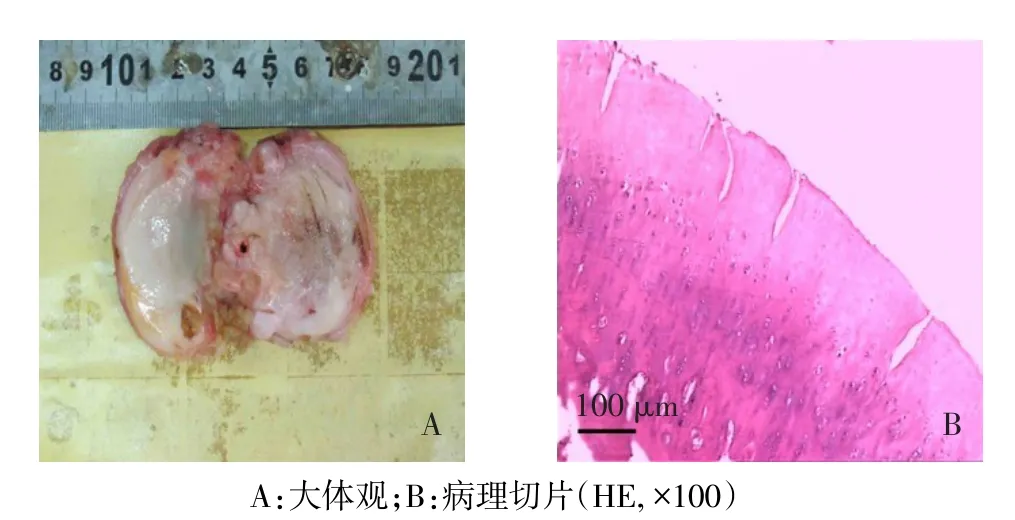
Figure 2 The degenerated human articular cartilage usedin the experiment图2 实验所取退变关节软骨组织

Figure 3 The degenerated articular chondrocytes图3 退变软骨细胞
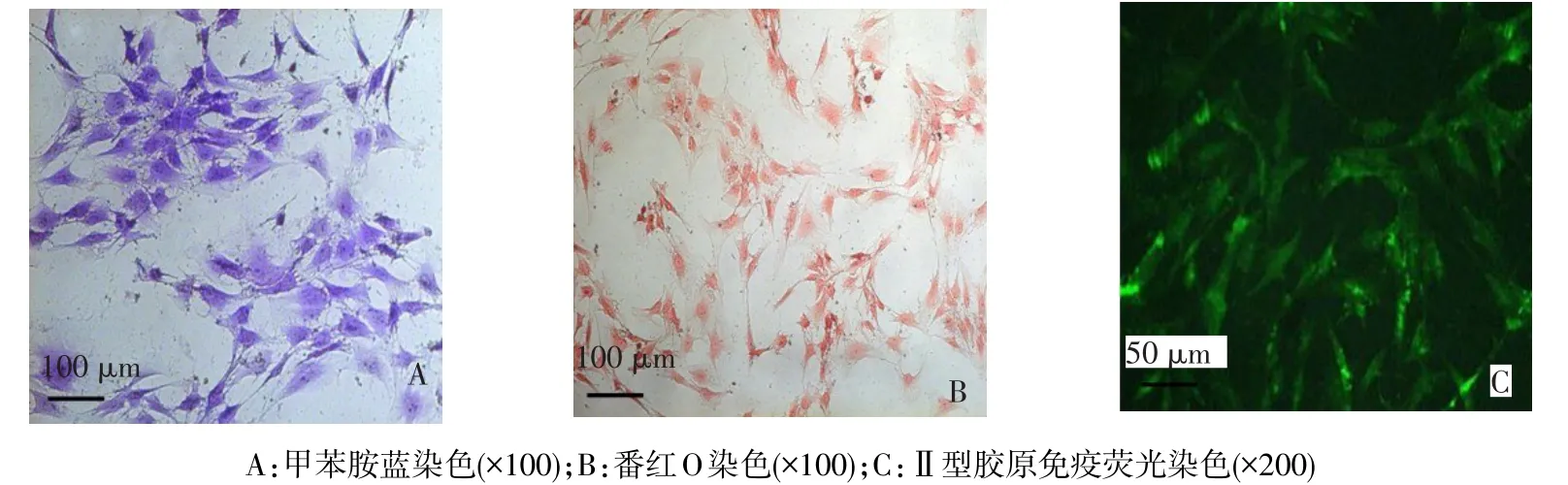
Figure 4 The identification of degenerated articular chondrocytes图4 软骨细胞鉴定
[1]刘兴漠,项禹诚,孙青,等.周期性张应力对骨关节炎软骨细胞p38MAPK表达及其磷酸化的影响[J].中国病理生理杂志,2012,28(2):362-365.
[2]Xu HG,Hu CJ,Wang H,et al.Effects of mechanical strain on ANK,ENPP1 and TGF-β1 expression in rat endplate chondrocytes in vi⁃tro[J].Mol Med Rep,2011,4(5):831-835.
[3]Moukoko D,Pourquier D,Pithioux M,et al.Influence of cyclic bend⁃ing loading on in vivo skeletal tissue regeneration from periosteal or⁃igin[J].Orthop Traumatol Surg Res,2010,96(8):833-839.
[4]Freemont AJ.The cellular pathobiology of the degenerate interverte⁃bral disc and discogenic back pain[J].Rheumatology(Oxford),2009,48(1):5-10.
[5]Thomopoulos S,Das R,Birman V,et al.Fibrocartilage tissue engi⁃neering:the role of the stress environment on cell morphology and matrix expression[J].Tissue Eng Part A,2011,17(7-8):1039-1053.
[6]商鹏,陈维毅,卫小春,等.周期性张应变力对幼年和成年及骨关节炎软骨细胞产生糖胺多糖的影响[J].中国现代药物应用,2010,4(16):1-3.
[7]Wu JZ,Herzog W.Analysis of the mechanical behavior of chondro⁃cytes in unconfined compression tests for cyclic loading[J].J Bio⁃mech,2006,39(4):603-616.
[8]Akisaka T,Yoshida H,Inoue S,et al.Organization of cytoskeletal F-actin,G-actin,and gelsolin in the adhesion structures in cultured osteoclast[J].J Bone Miner Res,2001,16(7):1248-1255.
[9]Hirano Y,Ishiguro N,Sokabe M,et al.Effects of tensile and com⁃pressive strains on response of a chondrocytic cell line embedded in typeⅠcollagen gel[J].J Biotechnol,2008,133(2):245-252.
[10]岳海涛,范卫民,马益民,等.不同强度周期性压力对组织工程软骨的影响[J].中华创伤骨科杂志,2007,9(7):661-664.
[11]张广程,范卫民,马益民,等.不同频率周期性压力对组织工程软骨的影响[J].中华实验外科杂志,2007,24(6):677-678.
[12]Xu HG,Zhang XH,Wang H,et al.Intermittent Cyclic Mechanical Tension Induced Calcification and downregulation of ankh gene ex⁃pression of end plate chondrocyte[J].Spine(Phila Pa 1976),2012,37(14):1192-1197.
