CRISP2基因在不同类型精子发生障碍中的表达及其意义*
2013-12-03李慕军
江 莉 李慕军 覃 莉
精子的发生是由精原细胞增殖分化形成精子的过程。如先天因素或后天疾病使精子生成的激素分泌或调控环节受到影响,即可造成精子发生障碍。目前评价男性生育力最客观和直接的方法是对精液数量和活力进行常规分析,但对于一些复杂不明原因的不育症,常规精液检测或生化分析已经无法满足对其临床诊断的需求[1]。而基因诊断可以为这些复杂病例的诊断提供一定的参考[2]。本研究应用实时荧光定量聚合酶链式反应(qRT-PCR)的方法,从基因表达水平探讨主要表达于睾丸的富含半胱氨酸分泌蛋白基因-2(cysteine-rich secretory protein 2,CRISP2)在不同类型精子发生障碍人群中mRNA的转录表达情况,及其与精子发生障碍的相关性,为阐明不同类型男性不育的分子机制提供初步的研究基础。
1 资料与方法
1.1 一般资料
1.1.1 资料来源 选择2012年1月—6月来我医院生殖中心就诊的男性不育患者150例,精液常规检查按照WHO人类精液及精子—宫颈黏液相互作用实验室检验手册(1999年,第4版)标准进行,精子形态学均未见异常。平素体健、无家族性遗传病及性功能障碍病史、无不良生活习惯(吸烟、嗜酒、吸毒等),外生殖器及术前体检无明显异常,无精索静脉曲张和精道感染患者,无其他系统疾病。研究对象均取得本人同意,签署知情同意书,并通过医院伦理委员会讨论。
1.1.2 分组 正常精液组50例,精液量2~6 mL,呈灰白色或淡黄色,pH值7.2~7.8,60 min内液化,精子密度≥20×106/mL,精子活力A级≥25%或A+B级≥50%。弱精子组50例,精子活力A+B级lt;5%。少精子组50例,精子密度lt;5×106/mL。
1.2 方法
1.2.1 精液收集与分离 收集各组精液,液化后经95%、76%、57%和47.5%的硅胶颗粒混悬液(Percoll分层液)非连续梯度离心,离心条件为300×g,20 min。然后用磷酸盐缓冲液洗涤2次,每次600×g,5 min,吸去上清,留沉淀于管底,储存于-80℃备用,用于提取精子总RNA。
1.2.2 总RNA提取 取(0.2~1.0)×107个精子按照AxyPrep总RNA小量制备试剂盒(Axygen,杭州)的方法提取精子总RNA。紫外吸收法测定RNA在260 nm和280 nm处的吸光度(A)。于-80℃保存备用。
1.2.3 cDNA合成 采用反转录反应试剂盒(Fermentas公司,美国)进行逆转录。
1.2.4 qRT-PCR测定基因表达水平 引物由上海生工生物工程技术服务有限公司合成,序列如下:CRISP2(产物约154 bp),上 游 5′-ATCCCGCTTTTACTGCTTTGTT-3′,下 游 5′-CACCTTTGGGCATTCGTTGT-3′;GAPDH(产物248 bp),上游5′-GGTCGTATTGGGCGCCTGGT-3′,下游 5′-TACTCAGC⁃GCCAGCATCGCC-3′。CRISP2与内参GAPDH基因同时进行PCR扩增,每次PCR扩增均加入同一个正常组的样本作为参照样本。2个基因的反应体系均为20 μL,其中Mix 10 μL,cDNA模板1 μL,上、下游引物终浓度0.3 μmol/L,其余体积用双蒸水补足。CRISP2的反应条件为:95℃预变性10 min,然后95℃15 s,60℃1 min,进行40个循环;GAPDH的反应条件为:95℃预变性10 min,然后95℃ 15 s,62℃ 1 min,进行40个循环;每次循环结束时收集荧光。每个样本进行3次重复测量以保证结果的准确。数据采用2-△△Ct法进行分析,阈值设定在指数扩增期,2个基因均为0.2,3次重复测量的平均实时定量值即为相对表达量(relative quantity,RQ)。
1.3 统计学方法 采用SPSS 13.0软件进行统计学处理。计量资料以±ss表示,3组数据比较采用方差分析,组间多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 3组一般资料比较 不同组间年龄差异无统计学意义(Pgt;0.05),少精子组精子密度低于正常组,弱精子组活力A+B级、活力A级低于正常组(均P<0.05),见表1。
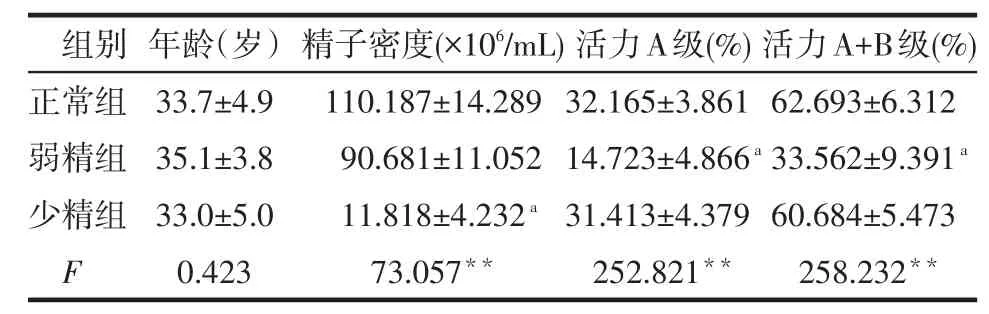
Table 1 Comparison of clinical data between three groups表1 不同组间临床资料比较 (n=50,x±s)
2.2 CRISP2在3组精子中的转录水平比较 由扩增曲线(图1、2)和融解曲线(图3、4)可见,CRISP2及内参基因GAPDH扩增的特异性均较强。CRISP2相对表达量差异有统计学意义(F=225.516,Plt;0.001)。正常组(10.281±2.173)及少精子组(9.420±2.794)高于弱精组(2.092±0.969,均P<0.05),而前2组差异无统计学意义。
3 讨论
3.1 不同类型精子发生障碍的表观遗传学分子机制 个体发育过程中,主要的表观遗传学改变发生在生殖细胞发育和着床前胚胎发育阶段[3]。在目前辅助生殖技术(assisted reproductive technology,ART)中的体外培养条件下,胚胎在超促排卵、体外培养和操作等因素的影响下,可能使正常的印记受抑制[4],从而影响胚胎植入、胎盘形成、器官形成和胎儿生长等[5]。Kobayashi等[6]研究发现在少精子症患者中印记异常和DNA序列突变较为普遍,提示ART所产生个体印记异常概率的增加,在一定程度上可能由于男性精子本身已经存在印记突变的基因,因此有必要进一步研究正常健康男性精子与不育症患者精子在分子水平上的差异。笔者的前期研究应用高密度全基因组甲基化芯片对不同类型精子发生障碍异常甲基化基因进行筛选,发现弱精子、少精子症组的全基因甲基化水平均高于正常组。精子基因DNA甲基化通过其特定的化学修饰方式,可能关闭了某些基因的活性,使DNA与转录因子的结合力下降,从而导致基因转录水平降低,影响相关基因蛋白表达,随之影响精子的发生[7]。
3.2 CRISP2在精子发生中的作用 CRISP2属于CRISP家族成员之一。CRISPs在进化上非常保守,序列上呈现高度同源,在雄性生殖系统特异性高表达,尤其是在睾丸、附睾中[8],提示CRISP2的作用可能与精子发生有关。免疫组织化学研究证实,CRISP2具体定位于成熟睾丸曲精细管内侧的中央区[9],而在精子细胞中,精子的顶体以及精子的尾部是CRISP2蛋白的主要定位点,而且以精子尾部主段、中段外周的致密纤维(outer dense fibers,ODFs)和主段纤维鞘为主[10],这暗示了CRISP2可能与精子活力有一定关系,还可能参与了精子功能的调控。CRISP2蛋白可能通过干预精子细胞膜内外的钙离子浓度,参与精子功能的调节,如精子活力的调节、精子获能、顶体反应等[11-13]。此外,CRISP2还参与了配子之间的相互作用[14],可能影响受精及生殖生物学过程。Cohen等[15]报道,CRISP1、CRISP2对精卵融合有促进作用。Busso等[16]通过构建小鼠模型,应用间接免疫荧光和蛋白质实验方法,结果提示CRISP2可能参与了顶体内部结构形成,从而影响精子获能和顶体反应;CRISP2还通过结合卵子的相关互补位点协助生物的受精过程,但这些作用的机制尚未清楚。
3.3 CRISP2基因表达与男性不育的关系 由于精子染色质处于高度浓缩状态,一直以来被认为是一种转录沉默的细胞,即DNA分子中胞嘧啶的甲基化使基因转录受阻。本研究通过qRT-PCR证实了CRISP2在精子细胞中的表达,这些mRNA的存在一定程度上表明了编码这些蛋白的基因在精子生成的过程中得到了转录。本研究显示,CRISP2基因在弱精子症患者精子中的相对表达量显著低于正常组。由此推断精子活力低下可能与CRISP2基因的低转录水平有关,CRISP2基因表达的减少可能导致精子活力下降,提示CRISP2基因有望成为潜在的分子诊断标志物。这与Wang等[17-18]采用基因芯片技术筛查精子发生相关基因所得出的研究结果是一致的。而在本研究中,少精子症患者来源精子中CRISP2的mRNA水平略低于正常精子组,但差异没有统计学意义,也提示少精子症的发生可能与CRISP2基因尚无直接联系。少精子症可能是由其他原因引起,如近年研究较多的细胞凋亡相关基因、Y染色体上的基因等。
正常的精子发生受多种因素调控,欲进一步了解CRISP2基因在人类精子发生过程中的具体机制,还需要对该基因转录调控区的基因突变或其表观修饰的甲基化状态进行深入的分析,并进一步通过相应的蛋白水平来证实。此外,因样本数较少,尚不能除外取材导致的偏差,但初步可以推断,CRISP2基因mRNA表达水平下调可能与精子活力下降有关,提示CRISP2基因有望成为潜在的分子诊断标志物,可能为今后研究弱精子症发生的相关分子机制提供参考。
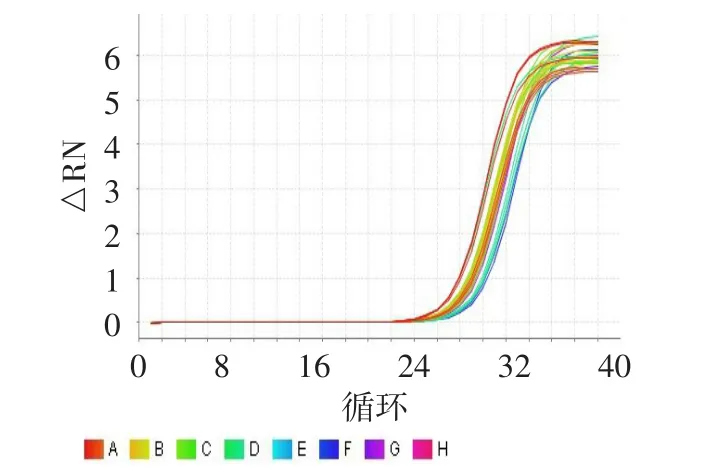
Figure 1 Amplification curves of CRISP2图1 CRISP2基因扩增曲线
Figure 2 Amplification curves of GAPDH图2GAPDH扩增曲线
Figure 3 Melting curve of CRISP2图3 CRISP2基因熔解曲线
Figure 4 Melting curves of GAPDH图4GAPDH熔解曲线
[1]蒋先镇.男性不育症的诊断.[J].医学新知杂志,2008,18(1):3-6.
[2]Matzuk MM and Lamb DJ.The biology of infertility:research advanc⁃es and clinical challenges.[J].Nat Med,2008,14(11):1197-1213.
[3]Georgiou I,Pardalidis N,Giannakis D,et al.In vitro spermatogene⁃sis as a method to bypass pre-meiotic or post-meiotic barriers blocking the spermatogenetic process:genetic and epigenetic impli⁃cations in assisted reproductive technology[J].Andrologia,2007,39(5):159-176.
[4]Steilmann C,Cavalcanti MC,Bergmann M,et al.Aberrant mRNA expression of chromatin remodelling factors in round spermatid mat⁃uration arrest compared with normal human spermatogenesis[J].Mol Hum Reprod,2010,16(10):726-733.
[5]Papageorgiou EA,Fiegler H,Rakyan V,et al.Sites of differential DNA methylation between placenta and peripheral blood:molecular markers for noninvasive prenatal diagnosis of aneuploidies[J].Am J Pathol,2009,174(5):1609-1618.
[6]Kobayashi H,Hiura H,John RM,et al.DNA methylation errors at imprinted loci after assisted conception originate in the parental sperm[J].Eur J Hum Genet,2009,17(12):1582-1591.
[7]Meikar O,Da Ros M,Kotaja N.Epigenetic regulation of male germ cell differentiation[J].Subcell Biochem,2012,61:119-138.
[8]李庆伟,薛壮,刘欣.富含半胱氨酸分泌蛋白的结构及其离子通道方面作用的研究进展.[J].辽宁师范大学学报,2009,32(2):222-226.
[9]黄文强.绒山羊CRISPs的cDNA克隆、CRISP2的表达定位及其与PDIA3相互结合的研究[D].内蒙古大学,2011.
[10]O'Bryan MK,Sebire K,Meinhardt A,et al.Tpx-1 is a component of the outer dense fibers and acrosome of rat spermatozoa.[J].Mol Re⁃prod Dev,2001,58(1):116-125.
[11]Gibbs GM,Bianco DM,Jamsai D,et al.Cysteine-rich secretory pro⁃tein 2 binds to mitogen-activated protein kinase kinase kinase 11 in mouse sperm[J].Biol Reprod,2007,77(1):108-114.
[12]Gibbs G M,Scanlon M J,Swarbrick J,et al.The cysteine-rich secre⁃tory protein domain of Tpx-1 is related to ion channel toxins and regulates ryanodine receptor Ca2+signaling[J].J Biol Chem,2006,281(7):4156-4163.
[13]Jamsai D,Bianco DM,Smith SJ,et al.Characterization of gametoge⁃netin 1(GGN1)and its potential role in male fertility through the in⁃teraction with the ion channel regulator,cysteine-rich secretory pro⁃tein 2(CRISP2)in the sperm tail[J].Reproduction,2008,135(6):751-759.
[14]Busso D,Cohen DJ,Hayashi M,et al.Human testicular protein TPX1/CRISP-2:localization in spermatozoa,fate after capacitation and relevance for gamete interaction[J].Mol Hum Reprod,2005,11(4):299-305.
[15]Cohen DJ,Da Ros VG,Busso D,et al.Participation of epididymal cysteine-rich secretory proteins in sperm-egg fusion and their po⁃tential use for male fertility regulation[J].Asian J Androl,2007,9(4):528-532.
[16]Busso D,Goldweic NM,Hayashi M,et al.Evidence for the involve⁃ment of testicular protein CRISP2 in mouse sperm-egg fusion[J].Bi⁃ol Reprod,2007,76(4):701-708.
[17]Wang H,Zhou Z,Xu M,et al.A spermatogenesis-related gene ex⁃pression profile in human spermatozoa and its potential clinical ap⁃plications[J].J Mol Med(Berl),2004,82(5):317-324.
[18]周其赵.基因芯片筛选成年男性精子活力不足分子标记物[D].南方医科大学,2010.
