EBV、Hp感染与胃癌的关系及相互作用研究*
2013-12-03杨艳丽胡建国
杨艳丽 胡建国 司 岑△
胃癌是一种高死亡率的世界性恶性肿瘤[1],其病因与致病机制研究一直为国内外学者所重视,但至今尚未明了,可能是一个多因素、多基因异常参与的过程。幽门螺旋杆菌(Hp)感染与慢性胃炎、消化性溃疡、癌前病变及胃癌的关系已被公认。Epstein-Barr virus(EBV)是一种DNA疱疹病毒,潜伏体内可引起人B淋巴细胞系发生“永生化”,它与鼻咽癌、传染性单核细胞增多症、Burkitt淋巴瘤等多种疾病有关,近年研究发现EBV亦可侵犯上皮组织,在部分胃癌组织检测到有EBV感染,其与胃癌发生的关系及机制研究已逐渐成为热点[2]。本研究旨在探讨EBV、Hp感染与胃癌的关系及二者在胃癌的发生发展过程中是否存在相互作用。
1 资料与方法
1.1 一般资料 选择2011年9月—2012年9月于宁夏医科大学总医院行手术切除、病理确诊的胃癌患者(胃癌组)100例,其中男66例,女34 例,年龄33~84岁,平均(58.67±10.33)岁,取其手术组织石蜡包埋,连续病理切片取材,厚度4~6 μm。另择同期行胃镜检查、病理确诊的胃炎患者(胃炎组)82例,其中男、女各41例,年龄19~80岁,平均(47.56±12.93)岁,取其内镜活检组织2~3块,-80℃储存备用。所有患者一般资料详实,无其他肿瘤或恶性合并症,无放化疗史,无抗Hp药物服用史。
1.2 主要仪器与试剂 组织基因组DNA提取试剂盒(E.Z.N.A.TMFFPE DNA Kit,美国),ISH-5022 EBER 原位杂交(ISH)试剂盒[包括胃酶、胃酶稀释液、地高辛标记的EBER探针、辣根过氧化物酶(HRP)标记的抗地高辛抗体、DAB稀释液和浓缩液、PBS 缓冲液],Taq MasterMix(包括 Taq DNA Polymerase、PCR Buffer、Mg2+、dNTPs及PCR稳定剂和增强剂),RNA-free H2O,琼脂糖,TBE缓冲液,无水乙醇、二甲苯、溴化乙锭;病理组织切片机,恒温水浴箱,核酸蛋白测定仪,eppendorf PCR仪,恒温生化培养箱,BiO-RAD水平核酸电泳系统、Gel Doc XR凝胶成像仪等。
1.3 组织DNA提取质量检测 严格按照基因组DNA提取试剂盒说明书提取组织DNA,并经核酸蛋白测定仪检测,平均浓度约为152.8 mg/L,OD260/OD280比值均在1.8~2.1之间,DNA质量均合格。
1.4 引物的设计合成 分别参照文献[3-4]设计扩增EBV基因组的特异性引物EBNA1和扩增Hp基因组的特异性引物Hp 16 S rRNA,由上海生工生物公司合成,见表1。
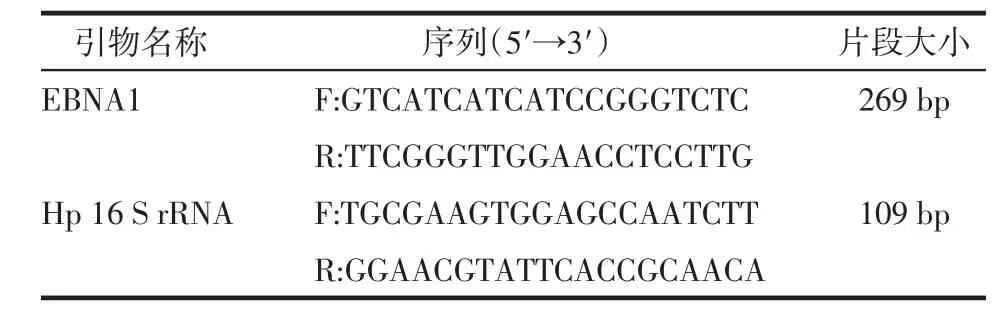
Table 1 The PCR primer sequences and the length of gene products表1 PCR引物序列及预计产物片段长度
1.5 聚合酶链反应(PCR)检测EBV、Hp感染 PCR反应体系(25 μL):2×Taq PCR MasterMix 12.5 μL,上下游引物各1.0 μL,DNA模板2.0 μL,RNA-free H2O8.5 μL。EBV反应条件:94℃预变性3 min、94℃变性30 s,61℃退火30 s,72℃延伸1 min(扩增30个循环);最后72℃总延伸5 min。Hp反应条件:94℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸45 s(扩增30个循环);72℃总延伸5 min。取PCR扩增产物6.0 μL经2.5%琼脂糖凝胶110 V电压电泳30 min,溴化乙锭染色20 min,紫外凝胶成像仪下观察结果并记录。
1.6 ISH技术检测EBV编码小RNA(EBER) (1)标本的收集和预处理:选取经PCR检测EBV DNA表达阳性的石蜡包埋组织,显微切割成4 μm的切片,60℃烤片过夜后用新鲜二甲苯脱蜡,然后在新鲜100%乙醇中放置数分钟后空气干燥。(2)酶处理:组织切片加入适量新鲜配制的胃酶工作液37℃孵育30 min,弃去胃酶工作液,逐级乙醇脱水(70%、95%和100%)各1 min,空气干燥。(3)杂交程序:组织切片上加10 μL地高辛标记的EBER RNA探针,加盖盖玻片于湿盒中37℃杂交过夜,后用PBS缓冲液冲洗切片数次并使盖玻片自然脱落。(4)检测和显色程序:切片上加入适量HRP酶标记的抗地高辛抗体,37℃孵育30 min,PBS缓冲液冲洗1 min×3次;加入适量DAB工作液,显色10 min,光镜下观察显色情况;后用蒸馏水冲洗切片。(5)复染:选择苏木素复染10 s,蒸馏水冲洗,常规脱水、透明、封片。(6)结果判定:显微镜下观察见细胞核着棕褐色者为阳性,证实为EBV感染;无细胞核着色者为阴性。
1.7 统计学方法 采用SPSS 17.0软件进行统计分析,2组指标比较采用χ2检验或校正χ2检验,胃癌组织中EBV与Hp感染的相关性分析采用行×列表资料的关联性分析,Plt;0.05为差异有统计学意义。
2 结果
2.1 2组EBV、Hp的感染 胃癌组有9例(9.0%)呈EBV感染阳性,且几乎所有癌细胞可见浓染呈棕褐色的EBER表达阳性细胞核,胃炎组均未检测到EBV基因,差异有统计学意义(χ2=5.967,P<0.05)。胃癌组、胃炎组分别有56例(56.0%)、33例(40.2%)呈Hp感染阳性,胃癌组高于胃炎组(χ2=4.476,P<0.05),见图1~3。

Figure 1 PCR analysis of EBV DNA图1 PCR检测EBV DNA
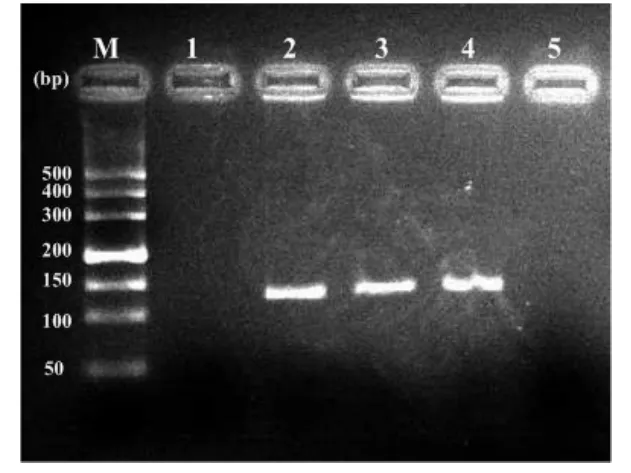
1、5:Hp DNA阴性;2、3、4:Hp DNA阳性Figure 2 PCR analysis of Hp DNA图2PCR检测Hp DNA
2.2 EBV、Hp感染与胃癌患者临床病理特征的关系 贲门胃体癌较胃窦癌、低分化癌较中高分化癌EBV感染率高(P<0.05),不同性别、年龄、民族以及有无淋巴结转移间EBV感染率差异无统计学意义。低分化癌较中高分化癌Hp感染率高(P<0.05),不同性别、年龄、民族、发生部位及有无淋巴结转移间Hp感染率差异无统计学意义,见表2。
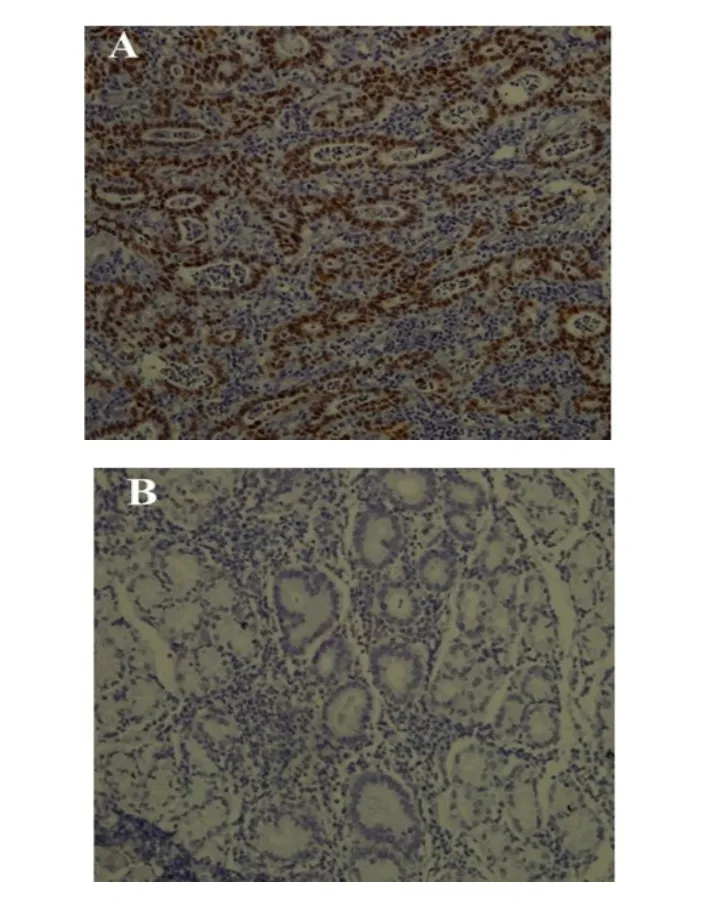
Figure 3 In situ hybridization detection of EBV RNA in gastric cancer(×200)图3 ISH检测胃癌组织中EBV RNA表达(×200)
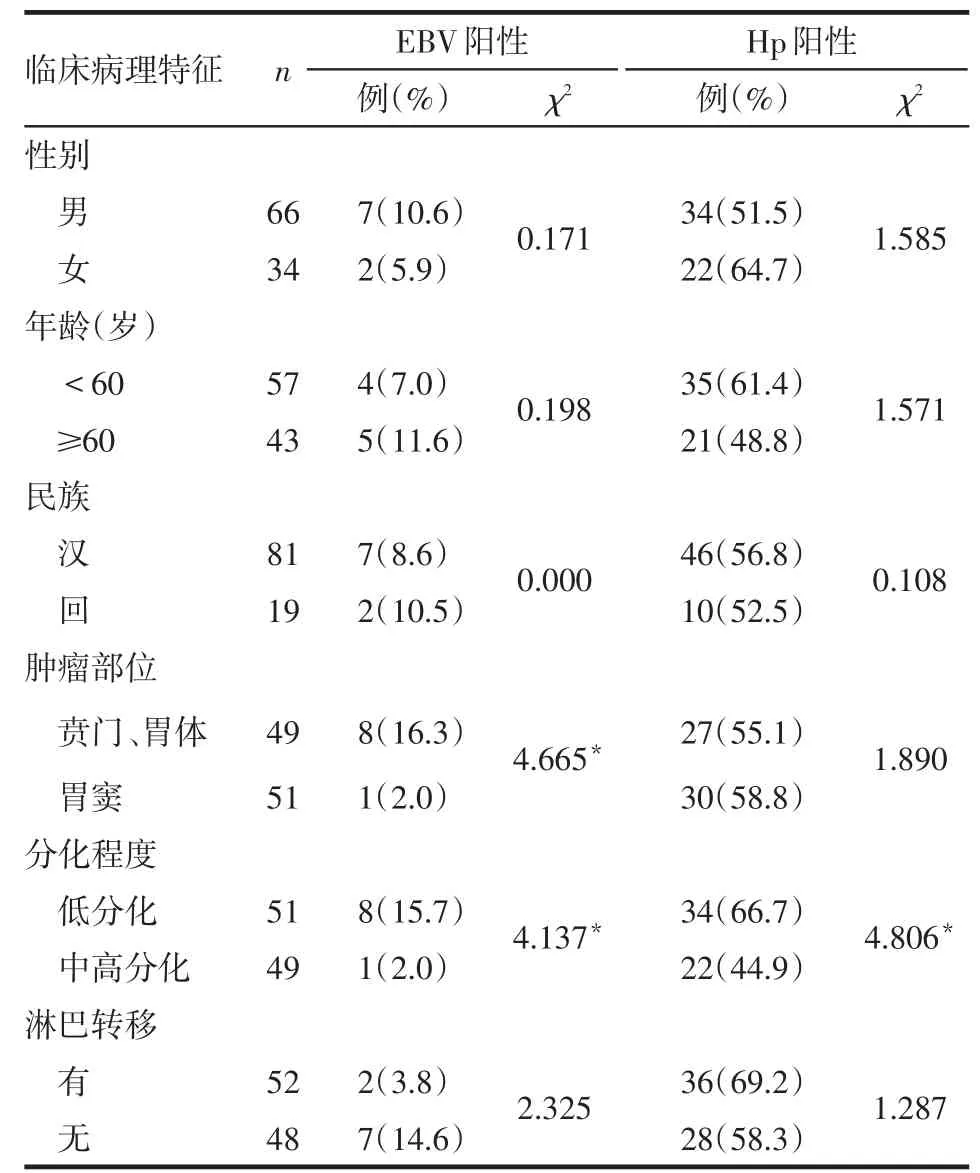
Table2 Correlation between EBV,Hp infection and clinical and pathological features in patients with gastric cancer表2 EBV、Hp感染与胃癌患者临床病理特征的关系
2.3 胃癌组EBV、Hp感染的相关性 9例EBV感染阳性者中有7例(77.8%)Hp感染阳性,而91例EBV阴性者中有49例(53.8%)Hp亦呈阳性,胃癌组EBV与Hp感染间无相关性(r=0.137,P>0.05)。
3 讨论
3.1 EBV感染与胃癌 EBV属人类疱疹病毒科γ亚科成员,最早从人Burkitt’s淋巴瘤组织中分离获得,已证实它与多种上皮细胞疾病有关。自1990年Burke等[5]首次报道EBV与胃癌相关以来,EBV相关胃癌(EBV associated gastric cancer,EBVaGC)逐渐受到人们重视。目前检测肿瘤细胞中EBV的主要方法是PCR和ISH技术,前者简单、经济,但假阳性率高,后者为确诊EBV感染的金标准,但价格昂贵,综合考虑,本研究采用2种技术协同的方法。结果显示82例胃炎组织中均无EBV阳性表达,而100例胃癌组织中有9例呈EBV感染阳性,且几乎所有癌细胞胞核中均可见呈棕褐色的EBER颗粒,同郭云娣等[6]研究结果一致,提示EBV感染是胃癌发生的早期危险因素,结合相关文献,笔者推测其作用机制是:受EBV感染的上皮细胞在病毒基因组的指导下产生各种EBV相关抗原(如EBNA1、LMP2A、BARF1等),进而使胃上皮细胞的癌基因活化和抑癌基因突变或失活,促进胃上皮细胞恶性转化而导致胃癌[7-8],一些抑癌基因启动子区CpG岛的异常甲基化被认为是EBVaGC最早出现且最主要的分子异常表现[9-10],但具体作用机制仍待进一步研究。本研究结果发现EBVaGC以贲门、胃体多见,且以低分化癌为主,提示此类患者恶性度较高,对胃中上部疾患(如溃疡、癌前病变等),可考虑开展EBV筛查项目,对检查结果阳性者定期胃镜随访观察,谨防癌变。
3.2 Hp感染与胃癌 Hp是1983年前澳大利亚学者Marshall和Warren首次分离培养发现的,已被证实Hp感染可导致慢性胃炎、消化性溃疡等疾病的发生,并可增加溃疡出血的风险,且与胃癌的发生关系密切[11]。本研究也表明胃癌组Hp阳性感染率高于胃炎组,提示Hp是促进胃癌发生发展的另一重要因素,考虑可能与Hp产生的大量毒性物质如尿素酶、细胞毒素相关蛋白(cagA)、细胞空泡毒素A(vacA)等有关,它们不仅可削弱胃黏膜及黏液层的屏障保护作用,还可引起各种不良反应。近期研究发现Hp破坏宿主细胞质膜,使局部的细胞外Ca2+逆流,Ca2+可促进膜联蛋白家族成员A1和A4及细胞表面修复因子LMAP-2的表达增加,进而促进宿主细胞增殖[12];国内也有研究证实Hp感染可以诱导胃上皮细胞染色体DNA双链断裂,进而刺激一系列染色体的修复,基因重组过程中增加了染色体错配的概率,进而导致癌变的发生[13]。本研究结果表明低分化癌组织Hp阳性感染率显著高于中、高分化癌组织,与相关研究结果一致[14-15],提示Hp感染可能参与胃癌的恶性进展过程。
3.3 胃癌组织中EBV、Hp感染的相关性 目前关于EBV与Hp在胃癌发生发展中的相关性研究报道较少。有极少研究认为EBV和Hp cagA在胃癌的发生发展中具有协同作用,推测可能是Hp cagA菌定植于胃黏膜上皮细胞诱发炎性变,增加了EBV的易感性所致[16]。本研究结果显示胃癌组织中EBV与Hp感染阳性率间无相关性,提示EBV和Hp感染可能是致胃癌发生的2个独立危险因素,同Wang等[15]研究结果一致。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]罗兵.Epstein-Barrr virus(EBV)感染与胃癌发生的分子机理研究[D].山东:青岛大学,2008.
[3]Telenti A,Marshall WF,Smith TF.Detection of Epstein-Barr virus by polymerase chain reaction[J].J Clin Microbiol,1990,28(10):2187-2190.
[4]Yamazaki S,Kato S,Matsukura N,et al.Identification of Helico⁃bacter pylori and the cagA genotype in gastric biopsies using highly sensitive real-time PCR as a new diagnostic tool[J].FEMS Immunol Med Microbiol,2005,44(3):261-268.
[5]Burke AP,Yen TS,Shekitka KM,et al.Lym-phoepithelial carcino⁃ma of the stomach with Ep-stein-Barr virus demonstrated by poly⁃merase chain reaction[J].Mod Pathol,1990,3(3):377-380.
[6]何影娟,白光辉,郭云娣.EB病毒感染与血管生成在胃癌组织芯片中的关系[J].世界华人消化杂志,2011,19(30):3172-3176.
[7]Sivachandran N,Dawson CW,Young LS,et al.Contributions of the Epstein-Barr virus EBNA1 protein to gastric carcinoma[j].J Virol,2012,86(1):60-68.
[8]Zhu S,Sun P,Zhang Y,et al.Expression of c-myc and PCNA in Ep⁃stein-Barr virus-associated gastric carcinoma[J].Exp Ther Med,2013,5(4):1030-1034.
[9]Chen JN,He D,Tang F,et al.Epstein-Barr virus-associated gastric carcinoma:a newly defined entity[J].J Clin Gastroenterol,2012,46(4):262-271.
[10]Tsao SW,Tsang CM,Pang PS,et al.The biology of EBV infection in human epithelial cells[J].Semin Cancer Biol,2012,22(2):137-143.
[11]Sablet T,Piazuelo MB,Shaffer CI,et al.Phylogeographic origin of Helicobacterpylori is a determinant of gastric cancer risk[J].Gut,2011,60(9):1189-1195.
[12]Lin LL,Huang HC,Ogihara S,et al.Helicobacter pylori Disrupts Host Cell Membranes,Initiating a Repair Response and Cell Prolif⁃eration[J].Int J Mol Sci,2012,13(8):10176-10192.
[13]王传芳.幽门螺杆菌进化起源与胃癌发生关系的研究[D].山东:青岛大学,2012.
[14]Noto JM,Khizanishvili T,Chaturvedi R,et al.Helicobacter pylori promotes the expression of Krüppel-like factor 5,a mediator of car⁃cinogenesis,in vitro and in vivo[J].PLoS One,2013,8(1):e54344.
[15]Wang DZ,Zhang XH,Wu WX,et al.Exploration of the association of H.pylori and EBV infection with cardiac and distal gastric adeno⁃carcinoma among residents in Cixian County,a high-risk area of esophgeal cancer in Hebei province[J].Zhonghua Zhong Liu Za Zhi,2012,34(6):446-449.
[16]张文杰,唐世孝,王健.EB病毒、幽门螺杆菌cagA和vacA基因型感染与胃癌的关系研究[J].西南军医,2009,11(2):188-192.
