人类神经母细胞瘤骨转移模型的建立及鉴定
2013-12-03赵红宇蔡炜嵩李帅笪祖科孙寒雪马良林耀新智德豹
赵红宇,蔡炜嵩,李帅,笪祖科,孙寒雪,马良,林耀新,智德豹
(中国医科大学附属盛京医院1.神经外科;2.肿瘤科;3.病理科,沈阳110004)
神经母细胞瘤(neuroblastoma,NB)是儿童和婴儿期最常见的颅外神经内分泌性实体肿瘤,占儿童恶性肿瘤的8%~10%,约占儿童肿瘤死亡病例的15%[1,2]。NB 由于具有自发修复、转化、侵袭性生长特性而造成预后不佳[3]。约70%的NB患者出现肿瘤扩散及转移,骨、骨髓和肝脏是最常见的转移部位[4]。NB转移患者中骨转移发生率可达56%,影像学上可见溶骨性表现[4],常引起疼痛、病理性骨折、高钙血症及脊髓压迫等症状[5]。骨转移的调控机制复杂,目前尚未明确[6]。建立理想的动物模型对理解NB细胞与骨微环境的相互作用十分重要。本研究拟通过直接注射NB细胞系(SY5Y,KNCR)细胞至裸鼠股骨骨髓腔内,建立新的NB骨转移模型,模仿NB细胞与骨微环境之间的相互作用,观察NB的骨转移特征,同时检测多种与骨侵袭、转移相关的蛋白因子在NB骨转移模型中的表达。
1 材料与方法
1.1 细胞培养
SY5Y和KNCR细胞系购于美国ATCC公司(American Type Culture Collection)。2种细胞系接种在完全培养液中[含IMDM(Bio Whittaker公司,美国),3 mmol/L L-谷氨酰胺(Gemini Bioproducts公司,美国);5 μg/mL 胰岛素,5 μg/mL 转铁蛋白,5 ng/mL亚 硒 酸 (ITS CultureSupplement;Colaborative Biomedical Products公司,美国),20%热灭活胎牛血清(Omega Scientific公司,美国)]。使用的2种细胞系均低于30代,培养于5%CO2/95%空气的湿润环境中,无附加抗生素。2种细胞系均为支原体检验阴性,未进行体外耐药试验的筛选。
1.2 动物及NB细胞骨侵袭/转移模型的建立
1.2.1 实验动物:4~6周龄雌性无胸腺balb/c(nu/nu)裸鼠,由中国医科大学附属盛京医院实验动物中心提供。裸鼠自由饮食水,明/暗每12 h交替光照,温度、湿度和通风符合中国医科大学动物管理条例,同时获得伦理委员会批准。
1.2.2 动物模型的建立:吸入麻醉后,沿裸鼠右侧膝关节外侧做10 mm长纵向切口,分离膝部韧带及肌肉,暴露股骨远端。以带有26号针头的骨钻钻进股骨远端制成骨孔,将连接有30号针头的Hamilton10 μL针管沿骨孔插入骨髓腔内约3 mm,将2 μL SY5Y或KCNR NB细胞悬浮液(约2×105个肿瘤细胞,悬浮于无血清、不含钙镁的L-15培养液中)分别注射入10只裸鼠骨髓腔内。术毕后,安置裸鼠于体温控制箱中至完全苏醒。研究遵循伦理委员会的指导并得到中国医科大学伦理委员会的核准。
1.3 NB细胞骨侵袭/转移模型的确定
1.3.1 影像学检查:对全部动物每周进行1次X线检查。采用Faxitron MX-20小动物X线装置(Faxitron X-ray Corp,美国)、乳房摄影专用的计算机摄影暗盒、高清晰度单面乳胶摄影胶片(Fuji EC-MA cassette,Fuji Photo Film Co,日本)。拍照过程中,将动物以合适的体位置于拍摄装置内,保证其尾部包括双侧下肢包含在拍摄范围内。建立骨病变的影像分级系统进行骨侵袭/转移的定量评估:1级:与对侧股骨比较病变肢体为正常骨质;2级:局限于股骨远端的无症状的非进展性的可透射线的骨质病变,或为与骨髓腔内注射相关的外伤性改变;3级:无症状性的溶骨性改变或朝向股骨近端延伸的进展性改变;4级:出现病理性骨折或骨皮质的断裂及连续性的破坏。影像学结果由2名独立的放射科医师决定。影像学上出现4级病变或出现显著不适时处死裸鼠,记录该时间作为终末时间点(end point),用以评估肿瘤的进展情况及NB细胞的侵袭能力。
1.3.2 肿瘤细胞骨侵袭的组织学分级及评估:1级:未发现骨及骨髓侵袭;2级:侵袭的肿瘤细胞仅局限于骨髓腔内;3级:肿瘤细胞已侵袭进入骨质中,但尚未穿破骨膜;4级:肿瘤细胞已穿破骨膜,侵袭入软组织甚至肌肉组织中。所有组织学切片均由2名独立的病理医生进行判断分级。
1.3.3 免疫组化检测:10%中性缓冲甲醛溶液固定骨标本24 h。10%甲酸脱钙,石蜡包埋。将标本切成5 mm厚,二甲苯脱蜡,梯度乙醇再水合。0.3%过氧化氢中孵化后,磷酸盐缓冲生理盐水洗涤。染色检测骨保护素(osteoprotegerin,OPG)、NF-κB 受体激活物配体(receptor activator of nuclear factor kappa B ligand,RANKL)、甲状旁腺激素相关蛋白(parathyroid hormone related protein,PTHrP)、内皮素1(endothelin-1,ET-1) 和 CXC趋化因子受体 4(C-X-C chemokine receptor type 4,CXCR4)的表达。为了减少异种组织的非特异性结合,用各含5%马、山羊和鸡的混合血清封闭样本1 h。在血清封闭溶液中稀释初级抗体。用家兔IgG或者免疫前血清代替初级抗体,以相同的方法处理对照载玻片。生物素次级抗家兔抗体作为底物,应用ABC试剂盒和DAB进行免疫组化染色。苏木精复染,应用Histomount(Zymed公司,美国)盖片。样本中肿瘤细胞比例>10%者为阳性标本。
1.4 统计学分析
2 结果
2.1 骨侵袭/转移模型的大体及影像学观察(图1,图2)

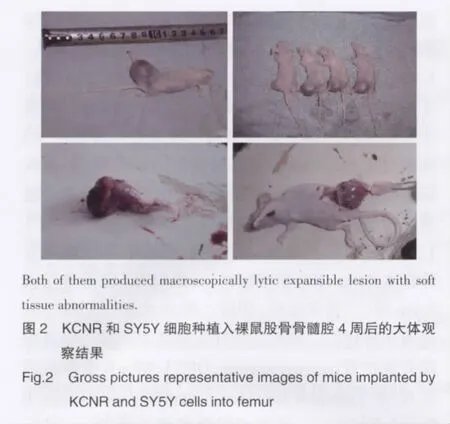
X线检查结果显示:裸鼠股骨骨髓腔注入SY5Y或KCNR细胞4周后,均出现明显的溶骨性反应,表现为病理性骨折或骨皮质断裂及连续性破坏,且均产生肉眼可见的膨胀性溶骨性病变,并伴有周围软组织异常。
2.2 组织学及免疫组织化学观察
SY5Y和KCNR NB细胞在股骨骨髓腔内引起溶骨性反应,表现为骨皮质的破坏以及骨侵袭表面的形成。在被侵袭的股骨中,破骨细胞大量出现并侵蚀骨质,同时未观察到新生骨的形成。免疫组化结果表明:在KCNR和SY5Y细胞接种后形成的肿瘤中,PTHrP、RANKL、OPG、ET-1 均呈强阳性表达,且PTHrP和RANKL的阳性表达率显著高于OPG和ET-1(P<0.001),PTHrP在肿瘤细胞及骨细胞中均有阳性表达。CXCR4在骨转移瘤中不表达或表达极弱(图3)。在骨侵袭生长的微环境中可以找到成骨细胞和破骨细胞(图4)。

3 讨论
NB是婴幼儿最常见的颅外实体肿瘤[7],具有高度转移倾向及明显的异质性,包括自我修复、恶变和侵袭性生长等多种特性,预后极差[8]。大部分NB患者在诊断时即已出现转移[9],其中56%发生骨转移[10]。肿瘤的转移是一个高度有序的复杂过程,由多个相互关联的步骤组成,包括:肿瘤细胞在邻近组织的局部侵袭,进入血循环进行迁移运动,随后定位于远隔的转移部位。骨成为NB肿瘤细胞的常见转移部位是由于NB细胞与骨和骨髓的独特的微环境之间存在着密切的相互作用。
肿瘤骨转移动物模型有助于研究其机制。理想的NB骨转移动物模型应该能完全模拟人类患病的各个方面。但实践证明建立一个肿瘤细胞能自发转移的动物模型十分困难,在NB细胞尚未转移到骨组织时,荷瘤动物往往已经因肿瘤广泛播散到身体其他部位而死亡,从而阻碍了骨破坏进程的监测及NB骨转移机制的研究[11]。本研究通过直接注射NB细胞至裸鼠的股骨骨髓腔内建立了NB骨转移动物模型,并观察到NB骨转移的形态学表现以及生化反应情况。本研究结果发现,NB细胞直接注射到裸鼠的股骨骨髓腔内后,骨组织增殖同时激发了溶骨反应,影像学和组织学检查均发现肿瘤侵袭骨质的现象,并都产生了肉眼可见的膨胀性溶骨病变以及软组织病变。这种直接髓腔内注射肿瘤细胞的方法是人为造成的转移,这种模型不能反映肿瘤转移的早期事件,如迁移和外渗等,这对于研究NB的迁移具有一定的局限性。
研究表明,NB细胞能够表达RANKL,直接刺激破骨细胞增生。成骨细胞产生的BDNF刺激PTHrP产生,使得成骨细胞的RANKL表达进一步增强,从而导致破骨细胞的进一步激活和成熟,促进溶骨反应的发生。而在RANKL表达缺失的情况下,NB细胞则可以与骨髓间充质细胞(BM-MSC)或者肿瘤相关巨噬细胞(TAMO)相互作用,促进SDF-1、MMPs和 OAFs(如 IL-6、IL-8 和 MIP-1β)的分泌,同样可促进溶骨反应的发生[12]。为了评价NB骨转移模型中NB细胞与骨的相互作用,本研究还检测了多种与溶骨反应相关以及在骨侵袭转移机制中发挥重要作用的蛋白因子。结果发现:裸鼠骨转移瘤中OPG和RANKL均表达上调,PTHrP和ET-1均呈强阳性表达,而且相对于对侧正常骨组织,这些蛋白的表达在骨的特殊环境中均有上调,与人类NB的行为一致。此外,PTHrP和RANKL的免疫反应性明显高于OPG和ET-1,其差异有统计学意义(P<0.001)。结果还发现:在骨转移瘤中,相对于正常骨组织,骨转移相关蛋白CXCR4的表达下调,且其免疫反应性明显低于其他骨转移相关因子。以上结果均提示PTHrP和RANKL在骨侵袭/转移中可能发挥更为重要的作用,并进一步证明CXCR4能促进原发性和继发性肿瘤的生长及肿瘤细胞的迁移,但是不参与肿瘤细胞的骨侵袭作用[13]。
综上所述,本研究所建立的裸鼠NB骨转移模型高度类似于人类NB骨转移,将为NB肿瘤细胞的转移途径与机制以及药物对NB骨转移的作用机制的研究提供有效的动物模型。
[1]Sharp SE,Gelfand MJ,Shulkin BL.Pediatrics:diagnosis of neuroblastoma[J].Semin Nucl Med,2011,41(5):345-353.
[2]Dickey A,Schleicher S,Leahy K,et al.GSK-3β inhibition promotes cell death,apoptosis,and in vivo tumor growth delay in neuroblastoma Neuro-2A cell line[J].J Neurooncol,2011,104(1):145-153.
[3]Owens C,Irwin M.Neuroblastoma:the impact of biology and cooperation leading to personalized treatments[J].Crit Rev Clin Lab Sci,2012,49(3):85-115.
[4]Granchi D,Corrias MV,Garaventa A,et al.Neuroblastoma and bone metastases:clinical significance and prognostic value of Dickkopf1plasma levels[J].Bone,2011,48(1):152-159.
[5]Poretti A,Grotzer MA.Neuroblastoma with spinal cord compression:is there an emergency treatment of choice?[J].Dev Med Child Neurol,2012,54(4):297-298.
[6]Matthay KK,George RE,Yu AL.Promising therapeutic targets in neuroblastoma[J].Clin Cancer Res,2012,18(10):2740-2753.
[7]Maris JM,Hogarty MD,Bagatell R,et al.Neuroblastoma[J].Lancet,2007,369(9579):2106-2120.
[8]孟艳,张景艳,王蓉,等.人神经母细胞瘤株SY5Y细胞PI3 K信号转导通路的研究[J].首都医科大学学报,2008,29,(2):167-170.
[9]Sorrentino S,Rosanda C,Parodi S,et al.Cyto-morphologic evaluation of bone marrow in infants with disseminated neuroblastoma [J].J Pediatr Hematol Oncol,2012,34(2):154-158.
[10]Yamamoto Y,Makimoto A.A case of stageⅣneuroblastoma treated with aggressive surgery following intensive neoadjuvant chemotherapy with autologous stem cell transplantation[J].Jpn J Clin Oncol,2012,42(4):359.
[11]Sartelet H,Durrieu L,Fontaine F,et al.Description of a new xenograft model of metastatic neuroblastoma using NOD/SCID/Il2rg null(NSG)mice[J].In Vivo,2012,26(1):19-29.
[12]Feng C,Zuo Z.Regulatory Factor X1-induced down-regulation of transforming growth factor β2 transcription in human neuroblastoma cells[J].J Biol Chem,2012,287(27):22730-22739.
[13]Ma M,Ye JY,Deng R,et al.Mesenchymal stromal cells may enhance metastasis of neuroblastoma via SDF-1/CXCR4 and SDF-1/CXCR7 signaling[J].Cancer Lett,2011,312(1):1-10.
