全反式维甲酸对人肝癌SMMC-7721细胞侵袭能力的影响
2013-12-03李海燕曹励民王秉亮
李海燕,曹励民,王秉亮
(1.西安交通大学医学院医学技术系,西安 710021;2.中铁一局集团中心医院普外科,西安 710021)
肝癌为世界第六大恶性肿瘤,影响肝癌预后的主要因素就是复发和转移。临床资料显示,约60%以上的肝癌(含早期肝癌)确诊时已发生临床或显微镜下转移[1]。因此,抗肝癌治疗的关键在于抗侵袭转移。全反式维甲酸(all-trans retinoic acid,ATRA)已广泛用于白血病的治疗,新近研究发现[1~3],它还可抑制乳腺癌、肝癌、胃癌等多种恶性肿瘤的侵袭和转移,但其作用机制还不明确。人肝癌细胞株SMMC-7721是来源于人低分化肝细胞癌的细胞系,与正常肝细胞比较,增殖速度快,具有较强的恶性行为(如迁移能力和侵袭能力)。因此我们探讨ATRA对人肝癌细胞株SMMC-7721迁移侵袭能力的影响,为ATRA应用于临床的肝癌治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞株:人肝癌细胞株SMMC-7721(中国科学院上海细胞生物研究所),以PRMI1640培养基+10%小牛血清常规培养。
1.1.2 实验试剂与配制:ATRA购自Sigma公司,以二甲基亚矾(DMSO)配制。小牛血清RPMI1640培养基(Gibco公司),Matrigel胶(美国BD公司),Transwell侵袭小室 (Coming公司),fluorophore Sybr Green(Netherlands 公司),Total RNA Kit(Omega 公司)。BCA蛋白定量试剂盒(Pierce公司),CD147、MMP-2、α-tublin一抗(Abcam公司)。
1.2 方法
1.2.1 划痕试验:把1×106个SMMC-7721细胞种植于6孔板,至细胞融合状态(90%),血清培养基饥饿24 h;用10 μL移液器枪头在培养板底部做“十”字划痕,划痕时要用直尺定位。加新鲜无血清培养基,加入 ATRA,调节浓度分别为10、20、40 μmol·L-1。37℃、5%CO2培养箱中培养24 h后,倒置显微镜观察并拍照,使用Image J软件测量并统计划痕区宽度。未处理组(对照组)与实验组均设3个平行样本。
1.2.2 Transwell小室试验:无血清培养基与Matrigel胶以9∶1配制,放Transwell小室于24孔板内,将稀释好的Matrigel胶50 μL置于Transwell上层。37℃过夜,待Matrigel胶凝固后,每孔加无血清培养基300 μL,每个孔种植细胞1×105个,加入ATRA,调节药物浓度为10、20、40 μmol·L-1,置于细胞培养箱孵育。24 h后分别取出小室,分别以PBS清洗3次,棉签刮除滤膜上的细胞,膜下面细胞用甲醛固定,1%结晶紫染色15 min,PBS洗3次。倒置显微镜下高倍镜观察并拍照,Image J软件计数细胞数值,结果以细胞数表示。
1.2.3 Real-time PCR:以10,20,40 μmol·L-1ATRA处理细胞,在24 h以Total RNA Kit提取细胞总RNA,逆转录合成 cDNA。GAPDH、CD147、MMP-2基因引物及内参GAPDH基因引物设计及反应参数参考文献[4,5],引物经上海生物工程有限公司合成。CD147,F:5′-ACTCCTCACCTGCTCCTTGA,R:5′-GCC TCCATGTTCAGGTTCTC-3′;MMP-2,F:5′-GGCAGTG CAATACCTGAACACC-3′,R:5′-GTCTGGGGCAGTCC AAAGAACT-3′;GAPDH,F:5′-GCACCGTCAAGGCTG AGAAC-3′,R:5′-TGGTGAAGACGCCAGTGGA-3′。用仪器 CFD3120 MiniOpticon Detector(美国BIO-RAD公司)进行实时定量PCR,按仪器使用说明书进行设置及操作。结果应用GraphPad Prism5.0软件进行数据分析,相对表达量采用2-△△Ct方法计算[6]。
1.2.4 Western blot:以10、20、40 μmol·L-1ATRA 处理细胞,在24 h收集细胞,以RIPA细胞裂解液(加1∶100 PMSF)裂解细胞,提取细胞总蛋白。蛋白质定量变性后上样,SDS-PAGE电泳后转PVDF膜,标准转膜75 min。将转有蛋白条带的膜常规封闭、洗膜后分别与特异性一抗4℃孵育过夜,PBST洗4次,每次5 min,二抗室温孵育1 h,PBST洗4次,每次5 min,化学发光剂检测蛋白质印迹,薄层扫描仪测定印迹区带的光密度值。观察各条带深浅变化并加以分析,α-tublin作为对照。实验重复3次。结果在凝胶成像仪上照相并使用BIO-RAD公司Quantity One分析软件测量条带灰度值,目的条带与α-tublin条带灰度值比值即为该目的蛋白的相对表达量。
1.3 统计学分析
2 结果
2.1 ATRA对人肝癌SMMC-7721细胞迁移能力的影响
划痕试验结果显示,对照组的SMMC-7721在24 h,细胞距离比0 h减少(P<0.05),这个实验结果说明SMMC-7721细胞的迁移能力较强。各剂量ATRA实验组与对照组细胞在0 h划痕距离比较一致,但以ATRA处理24 h后,较对照组划痕距离增加(P<0.05),实验结果表明ATRA可呈剂量依赖性抑制SMMC-7721细胞的迁移能力(图1)。
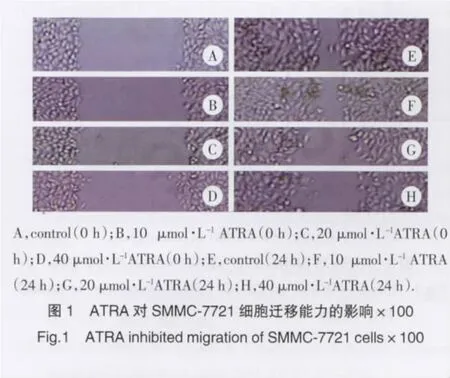
2.2 ATRA对人肝癌SMMC-7721细胞侵袭能力的影响
Transwell试验结果显示,10,20,40 μmol·L-1ATRA处理SMMC-7721细胞24 h后,穿膜细胞数分别为55.3±0.52、42.8±0.21、31.1±0.34,与对照组(73.6±0.45)比较,明显减少(P<0.05),该结果表明 ATRA可呈剂量依赖性降低SMMC-7721细胞侵袭能力(图2)。
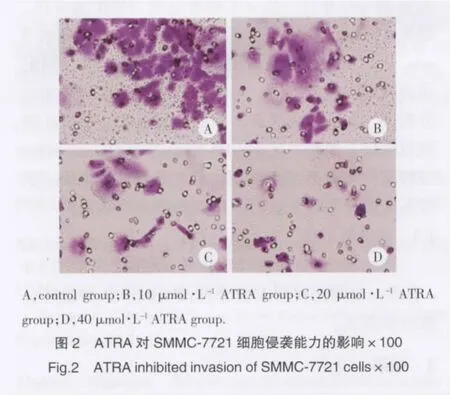
2.3 ATRA对SMMC-7721细胞CD147表达的影响
Real-time PCR 结果显示,以10、20、40 μmol·L-1ATRA处理SMMC-7721细胞24 h后,CD147mRNA表达水平明显下调,与对照组比较差异具有统计学意义 (P<0.01);Western blot结果显示,10、20、40 μmol·L-1ATRA处理 SMMC-7721细胞24 h后,CD147蛋白表达下调(P<0.05),呈剂量依赖性(图3、图 4)。


2.4 ATRA对SMMC-7721细胞MMP-2表达的影响
Real-time PCR 结果显示,以10、20、40 μmol·L-1ATRA处理SMMC-7721细胞24 h后,MMP-2mRNA的表达水平下调,与对照组比较差异具有统计学意义(P<0.05);Western blot结果显示,以10、20、40 μmol·L-1ATRA处理SMMC-7721细胞24 h后,与对照组比较MMP-2蛋白表达下调(P<0.05)。实验结果表明ATRA可呈剂量依赖性明显下调MMP-2(图5、图 6)。


3 讨论
恶性肿瘤患者死亡的主要原因是侵袭和转移。因此抑制肿瘤的侵袭转移就成为了治疗肿瘤的突破点,寻找抑制肿瘤转移的药物更是研发的热点[7~9]。在肿瘤发展过程中,抑制肿瘤细胞的黏附、侵袭和迁移都有可能降低肿瘤的转移能力[10~15]。
ATRA作为诱导分化剂在急性早幼粒细胞白血病中的应用取得了令人鼓舞的成效,近年来,很多研究者已从细胞学、动物实验以及临床试验的角度对胃癌、肝癌、肺癌、乳腺癌、甲状腺癌等恶性肿瘤用ATRA进行诱导、分化治疗。初步的结果发现,ATRA对恶性肿瘤细胞具有诱导分化、抑制增殖、诱导凋亡等作用,同时在抑制实体肿瘤的侵袭转移中也逐渐显示作用[16]。
划痕愈合实验、Transwell小室细胞侵袭实验是目前常用的体外研究肿瘤细胞迁移、侵袭行为的经典方法。在划痕愈合实验中我们发现,对照组具有很强的迁移能力,划痕后24 h,划痕处大部分愈合。而在实验组,ATRA作用于SMMC-7721细胞后,其迁移能力却非常弱,对比划痕0 h的图片结果,经过24 h的培养划痕处未见愈合。这与陈宏辉等[17]研究结果一致;Transwell小室细胞侵袭实验中,我们的研究表明,随着ATRA作用于SMMC-7721细胞时间的延长,与对照组比较,SMMC-7721细胞的穿膜数明显降低,这提示ATRA可呈剂量依赖性抑制SMMC-7721细胞的侵袭能力,这与汪思应等[18]和李冰等[19]的研究结果一致。
CD147是一种高表达于肝癌细胞的细胞表面跨膜糖蛋白,属免疫球蛋白超家族成员,参与肝癌细胞的生长调控以及侵袭、转移等多种过程,其表达量的高低与肝癌的复发、转移及耐药性形成等恶性行为存在明显的正相关关系,是一种影响治疗效果和预后的重要标志性分子。我们的研究结果显示,ATRA无论从mRNA水平还是蛋白水平均呈剂量依赖性下调CD147的表达。
细胞外基质金属蛋白酶 (extracellular matrix metalloproteinase,MMPs),是一个锌离子依赖的蛋白酶家族,目前已发现26个成员。MMPs的主要功能是降解细胞外基质,肿瘤细胞利用MMPs的基质降解能力迁移到其他部位。在肿瘤与间质交界处,MMPs往往呈高表达。研究证实,CD147能够诱导肿瘤细胞本身表达MMPs,尤其是MMP-2增加明显。我们的研究结果显示,ATRA无论从mRNA水平还是蛋白水平均呈剂量依赖性下调MMP-2表达。
本研究初步证明了ATRA能够抑制人肝癌SMMC-7721细胞的迁移和侵袭能力,该作用可能与下调CD147引发的MMP-2下调有关,具体分子机制尚需进一步研究。上述研究为ATRA抑制肝癌侵袭与转移的临床应用提供了思路。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009 [J].CA Cancer J Clin,2009,59(4):225-249.
[2]Huagn ME,Ye YC,Chen SR,et al.Use of all-trans retinoic acid in the treatment of acute promvelocvtic leukemia[J].Blood,1988,72(2):567-572.
[3]Kantarjian H,O′Brien S,Cortes J,et al.Therapeutic advances in leukemia and myelodysplastic syndrome over the past 40 years[J].Cancer,2008,113(7 suppl):1933-1952.
[4]Ling MK,Liao CG,Fei F,et al.Transcription factor Sp1 regulates expression of cancer-associated molecule CD147 in human lung cancer[J].Cancer Sci,2010,101(6):1463-1470.
[5]Wang YY,Meng JS,Zhuang HJ,et al.Expressions and clinical significances of MMP-2 and TIMP-2 mRNA in bladder transitional cell carcinomas[J].Chinese-German J Clin Oncol,2011,10(5):278-281.
[6]Livak KJ,Schmittqen TD.Analysis of relative gene expression Data using real-Time quantitative PCR and the2-△△Ctmethod[J].Methods,2001,25(4):402-408.
[7]Gay ID,Felding-Habermann B.Contribution of platelets to tumour metastasis[J].Nat Rev Cancer,2011,11(2):123-134.
[8]Steeg PS,Camphausen KA,Smith QR.Brain metastases as preventive and therapeutic targets[J].Nat Rev Cancer,2011,11(5):352-363.
[9]Wilson WR,Hay MP.Targeting hypoxia in cancer therapy[J].Nat Rev Cancer,2011,11(6):393-410.
[10]Wu XZ,Shi PC,Hu P,et al.N-all-trans-retinoyl-L-proline inhibits metastatic potential of hepatocellular carcinoma cells[J].Cell Biol Int,2006,30(8):672-680.
[11]苏晓晖,尤振宇,郑志超,等.RNA干扰沉默S100A2和E-cadherin基因后对胃癌细胞增殖和侵袭力的影响[J].中国医科大学学报,2012,41(4):297-299.
[12]赵月,孙波,高路,等.Dishevelled-1,3影响肺癌细胞侵袭机制的研究[J].中国医科大学学报,2012,41(4):311-315.
[13]单广夷,孔垂泽,李军,等.雷帕霉素对膀胱癌T24细胞增殖及侵袭能力的影响[J].中国医科大学学报,2011,40(4):301-303.
[14]鲁润春,贾桂军,冉然,等.PTTG、bFGF及PCNA在垂体腺瘤中的表达及其与侵袭性的关系[J].首都医科大学学报,2011,32(6):825-828.
[15]刘展,张明亮,李毅妮,等.SiRNA抑制p63基因表达对胆管癌细胞增殖和侵袭的影响[J].南方医科大学学报,2012,32(2):207-210.
[16]simeolle AM,Colella S,Krahe K,et al.N-(4-HydroxyphenyⅠ)retinamide and nitric oxide pro-drugs exhibit apoptotic and anti-invasive effects against bone metastatic breast cancer cell[J].Carcinogenesis,2006,27(3):568-577.
[17]陈宏辉,彭蕾.全反式维甲酸对肝癌细胞HepG2的分化、侵袭迁移的影响[J].世界华人消化杂志,2011,(33):3381-3389.
[18]汪思应,江岩,郑红,等.全反式维甲酸抑制Ets-1介导的肝癌7402细胞离散和侵袭及其分子机制[J].中国药理学通报,2011,(33):689-693.
[19]李冰,田波.全反式维甲酸对肝癌细胞分泌Ⅳ胶原酶的影响[J].肝胆胰外科杂志,2003,15(4):232-233.
