P63在肛门直肠畸形大鼠直肠发育过程中的表达及意义
2013-12-03苏朋俊袁宇航张志波黄英王大佳
苏朋俊,袁宇航,张志波,黄英,王大佳
(中国医科大学附属盛京医院小儿外科,沈阳110004)
先天性肛门直肠畸形(anorectal malformations,ARM)是小儿常见的先天性消化道畸形,据文献报道,其发生率为1/5000~1/1500,居先天性消化道畸形首位,其畸形发生的病理机制十分复杂,至今具体原因不清[1,2]。近年来研究发现P63基因与脊椎动物肢体末端、肛门直肠和泌尿生殖系统发育密切相关[3,4],但在ARM胚胎发育过程中的表达及作用尚不清楚。本研究通过乙烯硫脲(ethylenethiourea,ETU)诱导Wistar大鼠胚胎产生肛门直肠畸形动物模型,观察P63在肛门直肠发育过程中的表达情况,探讨P63在肛门直肠畸形胚胎发生机制中的作用。
1 材料与方法
1.1 实验动物及分组
健康成熟未育的Wistar大鼠妊娠第10天(E10,Ex表示大鼠妊娠第X天)经胃管注入乙烯硫脲(125 mg/kg),制作 ARM 大鼠动物模型(20只)。正常对照组:12只大鼠于妊娠第10天经胃管注入等量的生理盐水。分别于E13~E16正常组各取3只、畸形组(ARM组)各取5只孕鼠,取出所有胎鼠置于4%多聚甲醛磷酸缓冲液中固定,常规脱水,石蜡包埋,进行矢状面连续切片,厚4 μm。另一部分胎鼠置于液氮中保存,以备提取组织蛋白和mRNA。显微镜下观察,确定肛门直肠畸形的存在,合并神经管闭合不全、腰骶部脊膜膨等畸形未列入本实验研究。
1.2 免疫组化染色
将正常组切片和已确认肛门直肠发育畸形的胎鼠正中矢状面连续切片,进行P63免疫组化染色,采用SP法,参照试剂盒推荐方法进行操作:一抗为1∶200山羊抗大鼠P63抗体(美国Santa Cruz公司),4℃孵育12 h,DAB显色,苏木素复染,逐步脱水、透明后封片。P63免疫组织化学染色见胞核呈棕黄色为阳性。每次染色均设阴性和阳性对照。应用NIS-Elements Basic Research软件进行图像分析。
1.3 Western blot方法
应用手工显微切割方法准确切取泄殖腔标本,采用南京凯基全蛋白提取试剂盒提取总蛋白。按改良Lowry法测定,提取40 μL总蛋白,经6%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移至硝酸纤维膜(Invitrogen公司)上,5%牛血清白蛋白封闭抗原后,加入山羊抗大鼠P63抗体(1∶200稀释,Santa Cruz公司)和 β-actin抗体(1∶5000稀释,Sigma公司),4℃孵育12 h。次日洗膜后加碱性磷酸酶标记的兔抗山羊IgG(工作浓度1∶2000,Santa Cruz公司)进行二抗杂交、显色。结果采用GIS-2020凝胶图像分析系统扫描分析结果,对蛋白质含量进行密度分析,以相对灰度值代表表达量。采用凝胶图像分析系统对蛋白质含量进行密度分析,以相对灰度值代表蛋白表达量。
1.4 荧光实时定量PCR(qRT-PCR)方法
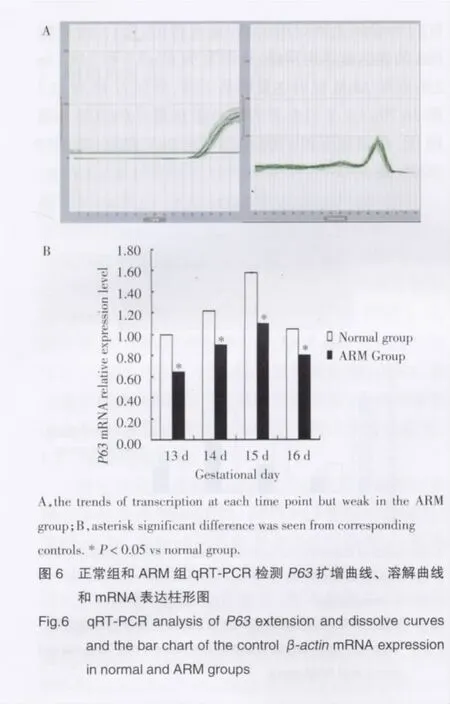
正常组及ARM组胎鼠冰冻切片,采用手工显微切割法切取胚胎肛门直肠标本。(1)各组织标本50 mg,参照 TRIzolTMRNA Isolation Reagent提取RNA;经紫外分光光度法检测浓度;(2)应用Prime-Script1st Strand cDNA Synthesis Kit将总RNA转换为 cDNA,反转录体系 (10 μL):5×PrimescriptTMBuffer(for Real Time)2 μL,PrimeScriptTMRT Enzyme Mix I0.5 μL,Oligo dT Prime (5O μmol/L )0.5 μL,Random 6 mer(100 μmol/L)0.5 μL,RnaseFree dH2O加至10 μL,37 ℃15 min,85 ℃5 s;(3) 提 cDNA 样品,依次作10 倍倍比稀释(106~10 copies/μL),以判断PCR的扩增效率。利用Primer5.0软件设计引物:P63F5′-CCACGATGAGGTCAGAGATG-3′,R5′-CTGAAACAGATGT TCTCTCAAGTC-3′,退火温度为57℃,片段扩增长度234 bp。内参照选用β-actin,片段扩增长度190 bp,45个循环后制作熔点曲线,明确产物特异性;⑷测定各个样品P63和β-actinmRNA Ct值,相对定量方式每个样品P63的△Ct,△Ct=Ct目的基因-Ct内参基因。根据△△Ct=△Ct目的基因-△Ct参照因子,计算2-△△Ct。
1.5 统计学处理
2 结果
正常对照组大鼠共产胎鼠192只,无畸形发生。ARM组胎鼠196只,肛门直肠畸形发生率为67.9%(133/196)。
2.1 免疫组化结果
正常对照组大鼠第13天时,大量的P63阳性细胞分布于尿直肠隔、后肠和泄殖腔膜的上皮层(图1A);第14天时,阳性细胞主要出现在尿直肠隔与泄殖腔膜的接近融合区域,同时,后肠的末段和尿道组织内也可见大量的阳性细胞(图2A);第15天,尿直肠隔与泄殖腔膜的融合区域的上皮内可见大量的阳性细胞;菲薄的肛膜上也出现免疫反应强的阳性细胞,并且免疫反应的强度几乎达到顶峰(图3A);第16天,肛膜破裂,肛门直肠形成,P63在肛管黏膜层表达及外层表皮中表达,但在直肠远端不表达(图4A)。
ARM组大鼠第13天,P63表达于尿直肠隔和后肠上皮中,强度极弱,在泄殖腔膜上皮细胞中仅见到零星的阳性细胞分布(图1B)。第14天,在泄殖腔膜、泄殖腔隔、后肠的上皮中可以观察到散在分布的阳性细胞(图2B)。第15天,直肠尿道瘘清晰可见,P63在瘘管和直肠远端上皮中表达明显较弱(图3B)。第16天,阳性细胞散在出现在瘘管和直肠末端上皮中,表达较弱(图4B)。

2.2 Western blot结果
Western blot结果显示,与正常组比较,P63的表达在ARM组中表现出相对的时间不均衡性。在肛门形成的关键时期(第14天和15天),正常组P63的表达量达到顶峰,分别为94.67±3.5和144.13±2.9;而在ARM组表达量明显下降,分别为46.17±2.1和 86.79±3.5,2 组差异有统计学意义(P<0.05);第16天,在正常组和ARM组均可见P63的表达减弱(P<0.05,图5)。

2.3 qRT-PCR结果
在正常和ARM组大鼠胚胎中均能检测出P63表达。在胎龄14~15 d为表达高峰期,胎龄16 d后逐渐降低。ARM组与正常组比较,P63mRNA的表达在13~16 d明显降低,差异有统计学意义(P<0.05,图 6)。
3 讨论
ARM是小儿外科最常见的消化道畸形,其病理改变除肛门直肠缺陷外,还常合并其他畸形,是一个涉及多因素的复杂疾病,其病因及胚胎形成机制至今未完全阐明。近年来流行病学和动物实验表明遗传因素在其发病过程中发挥重要作用,有研究表明Shh/HOX 信号通路[5]、EphB2[7]以及 Wnt5a/Tcf4[8,9]参与了肛门直肠畸形的发生。
P63基因是P53基因家族中的成员之一,在DNA序列上与P53基因高度同源,主要包含P53家族经典的3部分结构,即N-端的转录激活区、核心DNA结合区和寡聚化区。P63基因位于人类第3号染色体,在人类多种器官组织,如皮肤、口咽、腭、胸腺、胎盘、睾丸、肾盂、子宫颈等各种上皮组织的基底细胞中表达;而在胚胎发育过程中,P63基因特定地在胚胎外胚层和中胚层及上皮组织中表达[10]。由于P63基因具有不同启动子和多种内含子剪接方式,不同异构体间可以相互并存、相互拮抗,因此P63基因在胚胎发育的不同时期、不同器官,甚至是同一组织器官的不同发育阶段,发挥着重要的生物学功能。在胚胎发育的复杂过程中,P63的不同异构体间相互转化,既能够激活目的靶DNA序列,也能够抑制转录、合成;既能够维持组织结构塑形,也能够诱导构型转换;既可以促进细胞的增殖,也可以诱导细胞凋亡。近年来有研究发现,在外胚层发育不良、手足裂畸形和面部裂的人类疾病中均存在P63基因显性突变[11,12]。同时有研究发现,P63 参与了肛门直肠畸形发生相关的Shh/Gli2、Bmp4、Hox等基因的调控[13],是外胚层、面部、膀胱泌尿生殖器、直肠和四肢发育的一个关键调节因子。P63基因缺陷的小鼠出生后四肢截短,毛囊、牙齿、泪腺或唾液腺、皮肤、前列腺、乳腺和尿道上皮、膀胱壁缺如、泄殖腔畸形和肛门闭锁等结构畸形[3,4]。此外也有研究发现,P63下游调控基因DLX5、BMP7等也参与了消化道末端的发育,敲除DLX5、BMP7基因的小鼠出现尾端发育不良、泄殖腔畸形[14,15]。
本研究通过免疫组织化学方法、Western blot和qRT-PCR方法检测正常胎鼠和ETU致肛门直肠畸形胎鼠泄殖腔和直肠P63的表达情况。在大鼠胚胎发育过程中,正常及畸形泄殖腔中均表达P63基因,并且其表达特点具有时空依赖性;通过免疫组化染色连续动态观察P63在正常和ARM胎鼠肛门直肠区的表达时发现其表达具有明显差异。在E13~16,P63主要表达于尿直肠隔和泄殖腔膜或肛管(瘘管)上皮,并且在E14、E15时表现为强阳性。P63在ARM组泄殖腔和直肠黏膜亦有表达,但表达强度较正常组明显减低。通过Western blot和qRT-PCR的方法,发现在肛门形成的关键时期即胎龄14 d和15 d时在正常组P63的蛋白和mRNA的水平达到最高水平,说明在肛门直肠发育过程中P63可能发挥了重要的作用;而在同时期的ARM组表达明显降低(P<0.05)。因此我们认为,在胚胎泄殖腔发育的关键时期,特异性P63表达下调会干扰肛门直肠的正常发育,影响了靶基因在此区域的转录和翻译,导致泄殖腔尾区细胞周期调控及凋亡程序紊乱、背侧泄殖腔细胞过度凋亡,细胞间黏附分子的转化停滞,背侧泄殖腔细胞运动障碍,尿直肠隔和泄殖腔膜的融合缺陷,产生肛门直肠畸形。
综上所述,在肛门直肠畸形大鼠胚胎发育过程中,尿直肠隔及后肠上皮层、泄殖腔膜或肛管(瘘管)上皮层内均存在P63的差异表达,P63基因在肛门直肠胚胎发育过程中可能发挥了重要的作用。泄殖腔/后肠胚胎发育过程中,P63表达下调可能影响了下游靶基因的正常转录和翻译,或者影响了体内其他信号系统的调节作用,进而导致肛门直肠畸形的发生。
[1]Herman RS,Teitelbaum DH.Anorectal malformations[J].Clin Perinatol,2012,39(2):403-422.
[2]Stoll C,Alembik Y,Dott B,et al.Associated malformations in patients with anorectal anomalies[J].Eur J Med Genet,2007,50(4):281-290.
[3]Cheng W,Jacobs WB,Zhang JJ,et al.△Np63 plays an anti-apoptotic role in ventral bladder[J].Development,2006,133 (23):4783-4792.
[4]Ching BJ,Wittler L,Proske J,et al.p63(TP73L)a key player in embryonic urogential development with significant dysregulation in human bladder exstrophy tissue[J].Int J Mol Med,2010,26(6):861-867.
[5]Welsh IC,O′Brien TP.Signaling integration in the rugae growth zone directs sequential SHH signaling center formation during the rostral outgrowth of the palate[J].Dev Biol,2009,336(1):53-67.
[6]Mandhan P,Quan QB,Sullivan M,et al.Sonic hedgehog,BMP4,and Hox genes in the development of anorectal malformations in Ethylenethiourea-exposedfetalrats[J].JPediatrSurg,2006,41(12):2041-2045.
[7]Wang DJ,Bai YZ,Zhang SW,et al.Expression of EphB2 in the development of anorectal malformations in fetal rats[J].J Pediatr Surg,2009,44(3):592-599.
[8]Jia H,Chen Q,Zhang T,et al.Wnt5a expression in the hindgut of fetal rats with chemically induced anorectal malformations--studies in the ETU rat model[J].Int J Colorectal Dis,2011,26(4):493-499.
[9]Zhang T,Bai YZ,Wang DJ,et al.Spatiotemporal pattern analysis of transcription factor 4 in the developing anorectum of the rat embryo with anorectal malformations[J].Int J Colorectal Dis,2009,24(9):1039-1047.
[10]Goncalves CK,Fregnani ER,Leon JE,et al.Immunohistochemical expression of p63,epidermal growth factor receptor (EGFR)and notch-1 in radicular cysts,dentigerous cysts and keratocystic odontogenic tumors[J].Braz Dent J,2012,23(4):337-343.
[11]Luo T,Yu W,Yuan Z,et al.A novel mutation of p63 in a Chinese family with inherited syndactyly and adactylism[J].Mutat Res,2008,637(1-2):182-189.
[12]Wang X,Yang J,Tao AL.Mutation analysis of p63 gene in the first Chinese family with ADULT syndrome[J].Chin Med J(Engl),2009,122(16):1867-1871.
[13]Liu G,Moro A,Zhang JJ,et al.The role of Shh transcription activator Gli2 in chick cloacal development[J].Dev Biol,2007,303(2):448-460.
[14]Wu X,Ferrara C,Shapiro E,et al.Bmp7 expression and null phenotype in the urogenital system suggest a role in re-organization of the urethral epithelium[J].Gene Expr Patterns,2009,9(4):224-230.
[15]Suzuki K,Haraguchi R,Ogata T,et al.Abnormal urethra formation in mouse models of split-hand/split-foot malformation type1and type 4[J].Eur J Hum Genet,2008,16(1):36-44.
