动物低氧实验箱自动控制系统的组建及其在缺氧缺血脑损伤动物模型制作中的应用
2013-12-03侯伟健佟浩柏树令陈庆和田晓红张保功
侯伟健,佟浩,柏树令,陈庆和,田晓红,张保功
(中国医科大学1.基础医学院组织工程学教研室;2.实验设备处;3.基础医学院解剖学教研室,沈阳110001)
新生儿缺氧缺血性脑病(hypoxic ischemic encephalopathy,HIE)是由于围产期供血闭塞、窒息缺氧导致胎儿或新生儿脑的缺氧缺血性损伤。该病对患儿脑发育可造成严重的影响,产生一系列神经系统后遗症。HIE的死亡率高,存活者常有轻重不一的神经后遗症。因此,HIE被认为是儿童神经伤残的重要病因之一。国内外研究者[1,2]对HIE的致病机制和治疗方法进行了长期、细致的研究,积累了一定的经验并取得了较大的进展,但仍有较多的问题需进行深入研究。在缺氧缺血性脑损伤的致病和再生机制的研究中,适当的动物模型是不可缺少的。目前最为常用的经典动物模型是参照 Rice等[3]于1981年制作的新生大鼠缺氧缺血脑损伤(hypoxia and ischemia brain damages,HIBD)模型,对新生 7 d大鼠手术结扎单侧颈总动脉并经低浓度氧(8%)处理数小时,常可得到较好的缺氧缺血效果,适于进行较长时程的大脑神经病理与功能损害的研究。该制作过程主要由手术和术后低氧处理两大部分组成,二者缺一不可。用该方法制作动物模型,手术部分比较容易实现,但稳定可靠的低氧处理条件则是一个需要解决的重要问题。不同的研究者基于各自的条件采用不同的方法进行低氧处理,得到了相应的处理结果[4,5]。本实验室不具有此种低氧处理条件,我们根据细胞培养CO2孵箱的原理并参考国外的专用设备,自行购买相应的组(配)件,组建了可以人为设置并由仪器自动调节控制氧浓度的动物低氧处理箱,并利用其进行新生大鼠缺氧缺血模型的制作,得到了较好的效果。
1 材料与方法
1.1 材料
新生7 d龄SD大鼠(中国医科大学实验动物部),KY-2F型控氧仪及氧浓度检测探头(浙江省建德市梅城电化仪器厂),透明有机玻璃密闭箱(50 cm×40 cm×40 cm,中国医科大学解剖技术室制做),电磁感应开关(QIANJI RELAY Co.LTD),电磁阀(国产),高压氮气(沈阳医用气体厂),超低温冰箱(-80℃,SANYO,MDF-U32V),细胞超声破碎仪(美国Sonics&Materials公司,Model:Vcx130),低温高速离心机(SIGMA1-15k,德国),Bradford蛋白浓度测定试剂盒(碧云天生物技术研究所),酶标仪(Bio-Rad Model 680),HIF-1α抗体(北京博奥森生物技术公司),Cofilin和 p-Cofilin抗体、LIMK 抗体、Erk及p-Erk抗体(美国Santa Cluz公司),HRP-标记羊抗兔IgG(北京中杉金桥生物技术公司),化学发光试剂盒(碧云天生物技术研究所),医用X线感光胶片(Kodak公司,厦门医用胶片厂),免疫组化试剂盒(武汉博士德生物技术公司)。
1.2 方法
1.2.1 低氧箱自动氧浓度控制系统的组建与调试:利用自制的透明有机玻璃密闭箱,连接购买的KY-2F型控氧仪,同时在控氧仪的信号输出端连接电磁感应开关,电磁感应开关之后连接电磁阀门,氮气管路通过此电磁阀门进入密闭箱。
调试使用及工作原理:连接控氧仪电源线,安装氧浓度检测探头,打开仪器电源主开关。仪器首先初始化并与大气中氧平衡,调整仪器微调旋钮使显示为21.0%,设置控氧范围上限为9.9%。打开氮气瓶总阀,再打开减压表阀门,使氮气通过管道进入密闭箱。随着氮气的进入,密闭箱中的氧气浓度逐渐降低,氧检测探头将检测信号送入控氧仪,并通过仪器的输出端,将氧浓度信号送入电磁感应开关,由感应开关的动作控制器下方的电磁阀门开关。当仪器检测的氧浓度值高于设定值时,感应开关打开,电磁阀门打开,气体进入密闭箱;而当仪器检测密闭箱中的氧浓度低于设定值(9.9%)时,感应开关关闭,并控制电磁阀门关闭,此时氮气停止进入密闭箱。在电磁阀门关闭后的一段时间内,密闭箱中的氧浓度仍有一段惯性降低,一般可继续降低1.0%~2.0%(随通入氮气的速度而不同),实际值可达7.5%~8.5%。随后改调仪器的控制上限值(8.5%)和气体通入速度,可使密闭箱中的氧浓度值基本稳定于8.0%~8.5%范围内。一旦气体流量和设置上限调节完毕,整个系统即可自动进行调节维持密闭箱中氧浓度的恒定。
1.2.2 HIBD模型手术:取7 d龄新生大鼠,体质量10~14 g,分为手术组与假手术组,2%水合氯醛腹腔注射麻醉(10 mL/kg)后,仰卧固定于手术台上,颈正中切口,分离左侧颈总动脉,于动脉下方穿入手术线双点结扎,并于双结扎点中间剪断血管,缝合切口。动物术后放于35℃温箱中复苏2~4 h后,将手术组动物放入缺氧密闭箱中低氧(8.0%~8.5%)处理2~2.5 h,然后放入母鼠笼中,由母鼠继续喂养。术后动物按1h,12 h,24 h,48 h,72 h,7 d,14 d,21 d 分组处死取脑组织,于-80℃冰箱冻存备用或用4%多聚甲醛灌流固定以备进行免疫组化检测。
1.2.3 Western blot检测细胞内与损伤相关的信号蛋白表达:取各处理组大鼠大脑皮层组织1~2 mg,加入RIPA裂解液(含100 μmol/L PMSF),冰上裂解30 min,0~4℃下超声粉碎。利用Bradford法测定蛋白浓度,计算后用5×蛋白上样缓冲液(loading buffer)调整至50 μg/样品,加热100 ℃处理5 min。(1)配胶:分离胶浓度11.5%,浓缩胶浓度4%,上样进行SDS-PAGE电泳,电压70~110V,电泳时间约100 min。经电转移将电泳分离胶中蛋白区带转移至PVDF膜,电压100 V,时间2 h。转移后的PVDF膜用5%脱脂奶粉-TBST溶液封闭1 h;(2)多克隆一抗 :HIF-1α、LIMK、cofilin、p-Cofilin、Erk、p-Erk 及 内参β-actin按适当稀释度稀释后与膜的适当位置孵育4℃过夜,TBST溶液洗5 min×4;HRP标记的羊抗兔二抗室温孵育1 h,TBST漂洗5 min×4;暗室中用化学发光试剂显迹,X线胶片感光记录。
1.2.4 免疫组化法检测特定蛋白在细胞内的表达:模型动物经心脏灌流,用生理盐水冲出血液,然后灌注4%多聚甲醛(溶于0.1 mol/L PBS)约100 mL,至四肢抽搐变硬,取出脑组织,浸泡于4%多聚甲醛固定。数日后经石蜡包埋切片,切片脱蜡和水化后,PBS冲洗3次,加1滴过氧化物酶阻断溶液,室温孵育10 min,PBS冲洗后,加1滴小牛血清及50 μL Cofilin或 p-Cofilin一抗(Santa Cruze),室温下孵育60 min,PBS冲洗后,加生物素标记的第二抗体,室温孵育10 min,然后依次加入链霉卵白素—过氧化物酶溶液及DAB酶底物显色剂等,光镜下观察3~10 min后,自来水冲洗,苏木素复染,中性树胶封固。
1.3 统计学分析
2 结果
2.1 密闭低氧动物实验箱氧控系统在缺氧缺血动物模型处理中的自动控制效果
氮气瓶、低氧密闭箱、氧感应探头和控氧仪及其他控制开关和阀门连接安装后,放入颈总动脉结扎手术后的幼大鼠,关闭密闭箱盖,仪器先与大气氧平衡,校准仪器显示氧浓度为21%,然后开始通入氮气。随着氮气的输入,仪器测量的氧浓度值逐渐降低,至设定的上限值时电磁阀门自动关闭。此后一段时间氮气停止输入,密闭箱内的氧浓度维持在设定范围内,当密闭箱内氧浓度再度升高超过设定上限值时,电磁阀门再次自动开启,氮气输入,氧浓度再度降低。如此维持密闭箱中的氧浓度基本稳定在设定范围内。
2.2 大鼠缺血术后低氧处理脑损伤直观效果
缺氧缺血处理后1,3,7,14 d取脑组织标本观察脑损伤直观效果并留样待测。部分标本缺氧缺血损伤效果明显,肉眼可见明显缺血缺氧损伤灶,左脑后侧部皮质明显苍白或皮质组织液化或塌陷(图1)。

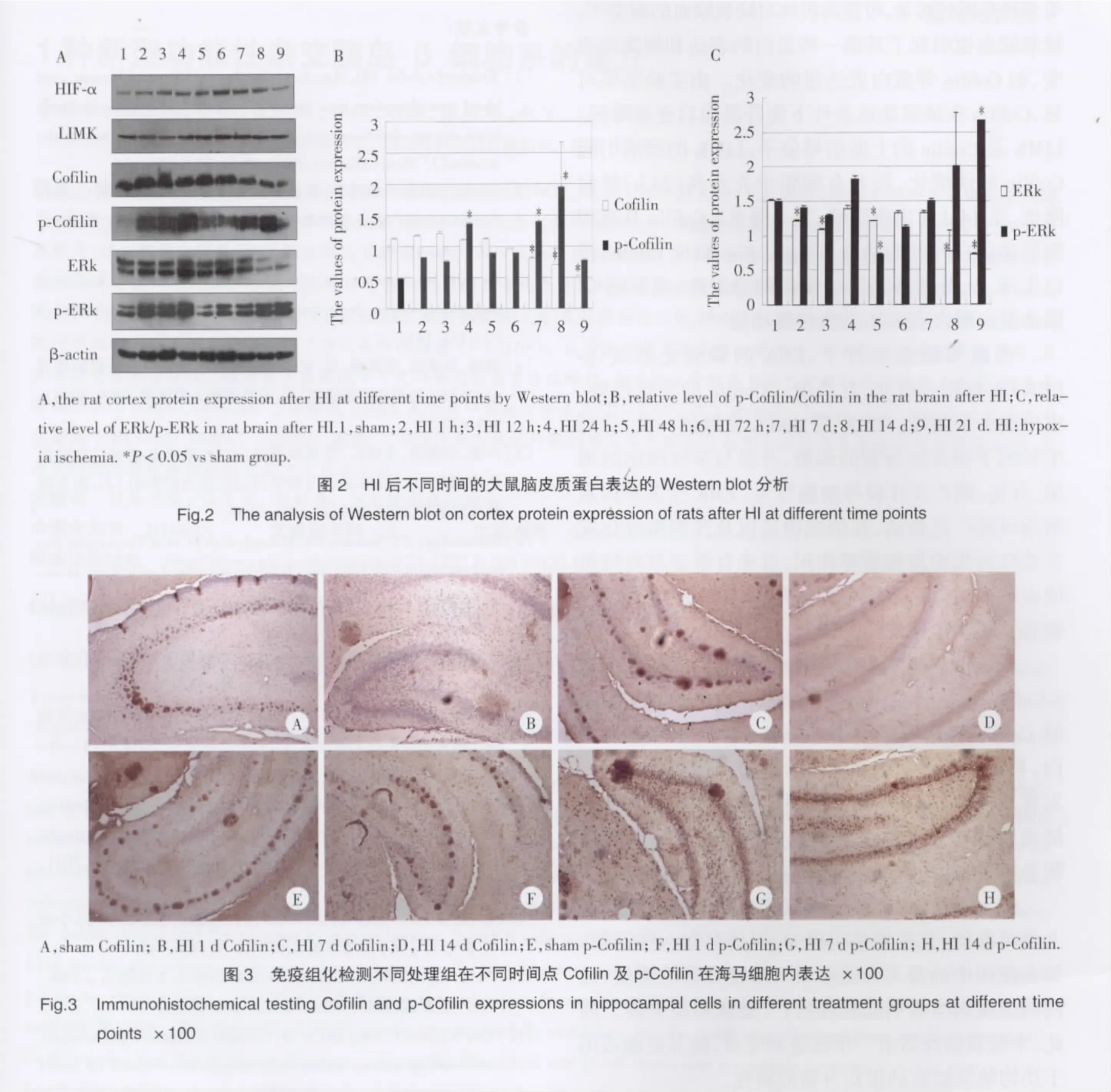
2.3 Western blot检测 HIF-α、LIMK、Cofilin 及 ERk等蛋白的表达
结果可见,在缺氧缺血后不同的时间段,大脑皮质细胞中蛋白表达及化学修饰发生不同的改变(图2)。
2.4 缺氧缺血后不同时间大鼠脑免疫组化表达
结果显示,用Cofilin和p-Cofilin抗体孵育杂交,可见不同处理对大鼠脑海马细胞产生不同的影响,缺氧缺血后损伤脑组织p-Cofilin明显比对照组增强,也比相同实验组的Cofilin表达明显增强。见图3。
3 讨论
在新生儿发育期,脑组织代谢非常旺盛,氧耗量最大,对缺氧极其敏感,易造成缺氧性损伤[6]。围产期的缺氧缺血性脑损伤常由于血液供应障碍(同时缺氧)引起。在缺血缺氧性脑损伤动物模型的制作过程中,颈总动脉结扎手术较易实现,而缺氧条件的实现则有一定的困难,其中氧浓度的测控则成为一个重要的限制因素。目前一些实验室采用从医用气体厂购买事先按比例混合好的O2(8%)和N2(92%)混合气体,使用时直接将混合气体通入一个密闭容器中[4,5,7]。此种方法操作容易,但无法实时测知密闭箱中的确切氧浓度及其变化,无法随时调控氧的浓度,实际氧浓度值往往高于预期(8%)。
本实验借鉴了国外同类设备的调控机制,利用反馈调节的原理,采用简单而经济实用的方法和配件,自行组配了可以自动调节氧浓度的低氧动物处理箱。经过数十次实验,证实其使用的可行性和可靠性。用该低氧箱制作的动物缺氧缺血模型,从脑组织形态到细胞内蛋白质表达和修饰及免疫组化等方面,都可获得明显的改变。
从本实验结果可以看到,在损伤较轻时,基本无异常可见或略有肿胀;当损伤加重时可见左脑组织变苍白;当损伤进一步加重时,则可见左脑皮质甚至海马出现液化坏死,脑组织损伤现象与文献报道相似[7,8]。从脑组织明显损伤的情况看,本低氧处理箱的作用与缺血手术的联合作用是明显的。
从Western blot结果上看,缺氧缺血侧的脑组织细胞中某些分子表达和修饰状态也发生了明显改变。HIF-1α的表达在缺氧缺血诱导后随时间增加而逐渐增高,72 h后又逐渐降低。HIF-1α是由低氧诱导的,在缺氧状态下HIF-1α的表达被诱导升高,进而激活红细胞生成素、血管内皮生长因子、糖酵解酶等多种基因的转录,可提高机体对缺氧缺血的耐受[9]。缺氧缺血也引起了其他一些蛋白的表达和修饰的改变,如Cofilin等蛋白表达量的变化。由实验结果可见,Cofilin在缺氧缺血条件下先升高而后逐渐降低。LIMK是Cofilin的上游信号分子,LIMK的激活引起Cofilin的磷酸化,后者在细胞中先升高(24 h)然后降低,至14 d又出现高峰,21 d降低。Cofilin具有切割肌动蛋白纤丝的活性,而p-Cofilin则使Cofilin蛋白失活,从而提高F-肌动蛋白的稳定性,或促进G-肌动蛋白聚合成F-肌动蛋白的功能[10]。
在缺氧缺血条件下,ERK的磷酸化形式(p-ERK)亦有较大改变,且类似p-Cofilin的变化趋势,也出现2个高峰。ERK是MAPK家族的一员,受到生长因子等有丝分裂的刺激,并参与多种细胞的增殖、分化、凋亡及迁移等细胞行为。ERK受多种因素刺激可被广泛激活,在细胞增殖以及在细胞分化发育恶性转化中发挥重要作用,近来有报道其在缺氧缺血脑损伤后大鼠脑中表达升高,并与GAP-43等敏感基因表达相关[11,12]。
从免疫组化结果来看,缺氧缺血后损伤脑组织p-Cofilin表达明显比对照组增强,也比相同实验组的Cofilin表达明显增强。Cofilin作为一种丝切蛋白,具有切断丝状肌动蛋白的作用,在细胞的迁移、发育及再生过程中起重要作用。本研究中发现缺氧缺血脑损伤后大脑海马组织中Cofilin蛋白磷酸化明显增强,其具体意义尚有待探讨。
综上所述,本实验中低氧箱自动调控系统基本上是可靠的,其效果是明确的,但仍存在一些问题。如在使用中尚需人为监测氧气浓度降低的速度,过快的速度则容易引起动物死亡,造成实验失败。因此,本低氧箱尚需进一步改进和完善,使其更加适用于动物缺氧缺血脑损伤方面的研究。
[1]Pimentel-Coelho PM,Magalh觔es ES,Lopes LM,et al.Human cord blood transplantation in a neonatal rat model of hypoxic-ischemic brain damage:functional outcome related to neuroprotection in the striatum[J].Stem Cells Dev,2010,19(3):351-358.
[2]侯伟健,田晓红,柏树令,等.缺氧缺血脑损伤大鼠脑组织Cofilin1与ERK1/2蛋白表达与磷酸化的分析[J].解剖科学进展,2012,18(1):41-45,49.
[3]Rice JE3rd,Vannucci RC,Brierley JB.The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].Ann Neurol,1981,9(2):131-141.
[4]刘旭,封素娟,张彩艳,等.低氧预适应对小鼠缺血脑的保护及其p38MAPK机制的实验研究[J].首都医科大学学报,2009,30(5):643-647.
[5]卢娜,李晓娟,李成长,等.低氧预适应对大鼠缺血-再灌注性脑损伤中HSP-70、Survivin蛋白和学习记忆能力的影响[J].南方医科大学学报,2007,27(12):1856-1859.
[6]Niatsetskaya ZV,Sosunov SA,Matsiukevich D,et al.The oxygen free radicals originating from mitochondrial complex I contribute to oxidative brain injury following hypoxia-ischemia in neonatal mice[J].J Neurosci,2012,32(9):3235-3244.
[7]许晓霞,栾佐,古桂雄,等.新生大鼠重度缺氧缺血性脑损伤模型的建立[J].中国新生儿科杂志,2009,24(3):165-167.
[8]王来栓,周瑾,邵肖梅,等.石杉碱甲改善新生大鼠缺氧缺血性脑损伤和智能缺陷的实验研究[J].中华儿科杂志,2003,41(1):41-45.
[9]Tang B,Qu Y,Wang D,et al.Targeting hypoxia inducible factor-1α:a novel mechanism of ginsenoside Rg1 for brain repair after hypoxia/ischemia brain damage[J].CNS Neurol Disord Drug Targets,2011,10(2):235-238.
[10]赵微,苏玉虹,巴彩凤,等.Cofilin蛋白功能及活性调节[J].中国生物化学与分子生物学报,2007,23(9):706-710.
[11]周艳.他克莫司对缺氧缺血性脑损伤新生大鼠海马p-ERK、GAP-43表达的影响[D].四川大学,2007:1-49.
[12]Hou Y,Zhou L,Yang QD,et al.Changes in hippocampal synapses and learning-memory abilities in a streptozotocin-treated rat model and intervention by using fasudil hydrochloride[J].Neuroscience,2012,200(1):120-129.
