犬肝射频消融后移行区PET/CT表现与血管内皮细胞生长因子表达的相关性
2013-12-03杜小丽畅智慧王传卓刘兆玉崔鹏
杜小丽,畅智慧,王传卓,刘兆玉,崔鹏
(中国医科大学附属盛京医院放射科,沈阳 110004)
近年来,射频消融(radiofrequency ablation, RFA)迅速发展,逐渐成为临床上有效治疗肝脏恶性肿瘤的一项非外科手术疗法[1],尤其是小肝癌[2]。但RFA术后肿瘤的残留和复发率相对较高[3],在治疗肝脏肿瘤时,RFA治疗安全区域应超过肿瘤边缘1.0 cm,以提高肿瘤灭活率[4]。因此,肿瘤周边(移行区)的正常肝组织也会受到热损伤。已有大量关于影像学评价RFA治疗肝脏肿瘤疗效的报道,其中PET/CT集形态学及功能学于一体而优势明显,但热损伤的肝组织与残余肿瘤在18F FDG-PET/CT上均可出现高代谢,导致鉴别困难[5~7]。组织损伤后会有一个修复过程,其中不仅有多种修复细胞参与,还有许多生长因子在这一过程中发挥重要作用。目前认为,血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)通过影响与其相应的血管内皮上的受体来促进血管通透性的增加和血管的增生,促进肉芽组织的形成,在介导内皮细胞迁移及组织修复中起重要作用[2,8,9]。深入研究移行区肝组织在修复过程中的代谢机制,将有助于与残余肿瘤鉴别。本实验通过观察犬肝组织RFA术后移行区PET/CT表现及VEGF的表达情况,探讨移行区肝组织PET/CT表现特点及其机制。
1 材料与方法
1.1 实验设备和材料
消融设备为北京为尔福电子公司生产的WE-7568多极射频肿瘤消融仪和WHK-8型多极针消融电极(由母针1枚、子针10枚构成,子针完全展开成扁球型,最大直径5 cm)。CT与PET/CT扫描均使用GE公司生产的Discovery ST-16 PET/CT一体机,PET扫描示踪剂由GE Mini-Tracer回旋加速器生产(示踪剂为18F-FDG,放射性纯度>95%),图像分析在Xeleris工作站上完成。
1.2 实验动物及分组
本实验符合动物实验伦理学,已通过中国医科大学伦理委员会的批准。选成年健康杂种犬15只,雌雄不拘,体质量15~20 kg,所有实验犬均由中国医科大学附属盛京医院动物部提供。每次行RFA及影像检查前,实验犬禁饮食12 h;PET/CT检查前监测血糖,确保实验犬在行PET/CT检查时的血糖值在正常范围内(血糖过高或过低可能会影响肝脏对18F-FDG的摄取)。实验全程使用联合麻醉,速眠新(盐酸二氢埃脱啡、氟哌啶醇、保定宁合剂)0.1~0.15 mL/kg肌肉注射行全身麻醉,戊巴比妥钠10 mg/kg增加麻醉效果。术中根据情况追加速眠新,剂量为首次剂量的1/3~1/2。
按随机数字表法将15只犬分成5组,每组3只,对每只犬肝脏行2次RFA治疗,共得到30个消融灶。根据RFA术后行影像检查时间的不同,将实验组命名为即刻组、1周组、2周组、4周组和8周组。即刻组:RFA治疗后2 h内行PET/CT扫描,完成检查后将犬处死,取肝脏病理;1周组:RFA治疗后,将犬送回动物部常规饲养,1周后行PET/CT扫描,完成检查后将犬处死、取病理;依此类推,2周组、4周组和8周组分别是RFA治疗后将犬饲养2周、4周和8周再行PET/CT扫描,完成检查后将犬处死、取病理。
1.3 RFA
每次RFA均在CT引导下实施,将犬的双前肢及肝区备皮,仰卧,外电极固定于双前肢。肝区铺定位纸,CT平扫定位后选择合适的体表穿刺点(有意选择远离肝包膜、肝门区及大血管分支的肝实质),常规碘伏消毒,将射频电极分别穿刺入肝左、右叶,展开电极子针,直径2 cm,进行RFA治疗。设定射频发生器治疗温度90℃,脉冲频率290 kHz,每个治疗区消融10 min,消融过程中功率逐渐上升,最大输出功率为200 W。术后连续3 d肌肉注射青霉素抗炎(80万U/d)。
1.4 PET/CT扫描
以5 Mbq/kg的剂量沿预先安置的套管针注射18F-FDG,注药后将犬安放在安静、避光的房间,60 min后开始采集图像。PET采用3D扫描模式,采集1个床位,时间3 min。图像经衰减校正,采用有序子集最大期望值法进行重建。
1.5 PET/CT图像分析
PET/CT影像由1名放射科医师与1名核医学科医师进行评估。整个过程采用盲法(医生各自阅片,互不交流),分析各组犬肝脏的PET/CT表现并测量30个消融灶移行区的标准摄取值(standardized uptake value,SUV),每个指标测量3次,结果取平均值。具体方法:选取消融灶最大截面及其上、下临近层面,在每个层面的移行区勾画3个直径2~4 mm的小圆形兴趣区(region of interest,ROI),避开大血管,尽量避开消融灶中心坏死区及周围正常肝组织,测量其SUV。
1.6 组织病理学检查
每组实验犬完成规定的影像检查后被处死(沿预先安置在股静脉的套管针注射10%氯化钾溶液30 mL,使其心脏停跳而死亡),剖腹取治疗后的肝脏组织进行病理检查。横断切开凝固坏死灶及与之相邻的正常肝组织,行HE染色。取移行区肝组织行ELISA法测定VEGF含量。
1.7 测定VEGF含量
采用双抗体夹心ELISA法测定肝组织VEGF含量。以抗大鼠VEGF单抗包被于酶标板上,移行区肝组织匀浆上清液中的VEGF与单抗结合,加入生物素化的抗鼠VEGF,形成免疫复合物连接在板上,辣根过氧化物酶标记的Streptavidin与生物素结合,加入酶底物邻苯二胺,出现黄色,加稀硫酸终止反应。在492 nm处测吸光度(A)值,VEGF浓度与A值成正比,通过标准曲线求出标本中VEGF浓度(阳性对照为标准品,阴性对照采用无VEGF的标准品)。
1.8 统计学分析
采用SPSS 17.0统计软件,采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 RFA结果
15只实验犬均成功行RFA手术,术后犬恢复良好,无手术并发症。本研究对15只犬的30个消融灶进行评估与分析。
2.2 各组PET/CT与病理表现
即刻组、1周组、2周组及8周组消融灶PET/CT图像(图1)均表现为18F-FDG低代谢,1周组、2周组消融灶周围可见环形FDG高代谢区,由内向外依次为低-高-等代谢(图1B、1C);4周组 PET/CT表现与1周组相似。即刻组病理表现:3层带状结构,中央区为早期凝固坏死的肝组织,呈嗜酸性染色,肝细胞分解,小叶及肝索结构破坏;中间移行带表现为肝窦扩张、充血,残留的肝细胞萎缩;外带肝细胞反应较轻,可见水肿及空泡样变性,细胞核多正常(图2A)。2周组病理表现:凝固坏死的肝组织细胞核模糊,周围可见肝窦局灶性扩张、充血,大量中性粒细胞、巨噬细胞浸润,少量纤维组织形成(图2B)。8周组病理表现:中央区为坏死的肝组织,外周纤维组织增生明显,其内可见慢性炎性细胞浸润(图2C)。
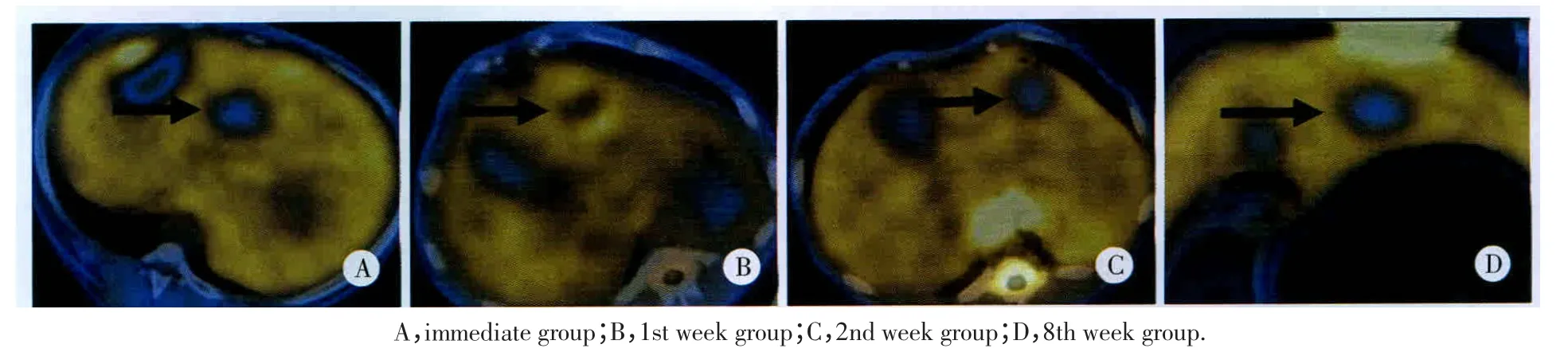
图1 各组犬肝脏RFA术后PET/CT表现Fig.1 The image of PET/CT after RFA in canine liver in all groups
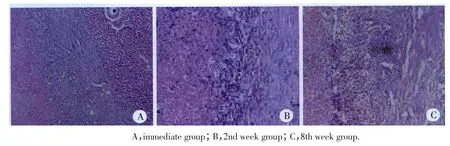
图2 各组犬肝脏RFA术后病理表现Fig.2 The pathology after RFA in canine liver in all groups
2.3 VEGF含量与SUV值相关性分析
每组移行区肝组织平均VEGF水平与平均SUV 值呈显著相关(r=0.933,P<0.05),见图3。
3 讨论
随着RFA技术的不断发展,在临床肿瘤治疗等领域中也得到了广泛的应用,RFA的原理是通过高温产生热损伤,使组织细胞发生凝固性坏死[7]。目前对RFA在临床应用的疗效报道较多,但对RFA术后正常组织修复过程的特点鲜有报道。正常肝组织会对RFA热损伤产生一系列炎性反应,在PET/CT上多表现为坏死灶周围组织的高代谢,而大部分恶性肿瘤亦有上述影像表现,因此这种炎性反应严重影响了肿瘤残留或复发的准确判断[10]。组织损伤后会有一个修复过程,其中不仅有多种修复细胞参与,还有许多生长因子在这一过程中发挥重要作用。目前认为,VEGF通过影响与其相应的血管内皮上的受体来促进血管通透性的增加和血管的增生,促进肉芽组织的形成,在介导内皮细胞迁移及组织修复中起重要作用[2,8,9]。鉴于此,研究肝组织 RFA 后移行区不同时间点VEGF表达,将有助于了解移行区组织修复的过程,并与PET/CT表现对照,为鉴别肿瘤残留或复发提供理论依据。并且有研究结果表明,血清及肝组织中VEGF水平高,肝脏RFA术后预后较差[11]。
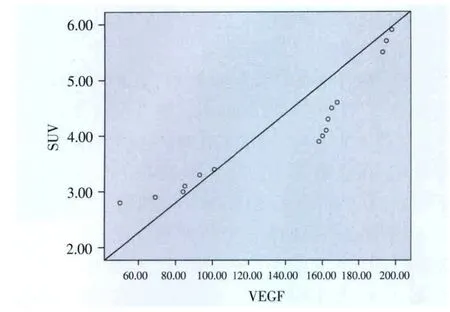
图3 各组犬肝RFA术后移行区组织SUV值与VEGF表达的相关性分析Fig.3 The correlation analysis of SUV and VEGF expressionsafter RFA in canine liver in all groups
本研究结果表明,PET/CT可反映犬肝脏RFA术后不同时期病理变化,移行区VEGF的表达与SUV值变化具有一定的相关性。RFA术后超急性期(即刻组)消融灶中央的凝固坏死导致血液流出道受阻、肝窦扩张充血,PET/CT上未出现代谢变化,表现为等代谢,VEGF浓度与SUV值均接近正常肝组织。此后,炎性细胞的浸润和肉芽组织的形成使组织代谢增高,PET表现高代谢,VEGF浓度与SUV值逐渐增高;随着肉芽组织逐渐成熟,代谢程度也随之减低,VEGF浓度与SUV值逐渐降低;肉芽组织被纤维组织代替后(8周组),代谢接近正常肝组织,VEGF浓度与SUV值也恢复到正常肝组织水平(图1、2)。
本研究小组之前的研究证实肝脏恶性肿瘤患者RFA后早期复查PET/CT(24 h内)可避开炎性反应干扰、准确评价消融效果,但存在假阳性病例[6,8,10],并主张肝脏肿瘤RFA治疗后2 h内复查PET/CT,以便更早、更准确地判断RFA效果。正常肝组织对射频损伤产生的炎性反应一般持续4周左右,表现为消融灶周围组织的高代谢,在这期间正常肝组织的炎性反应在PET/CT上的表现会对准确判断是否存在肿瘤残余造成干扰。术后4周,尤其到术后8周时,PET/CT受炎性反应的干扰均较小。对于术后8周影像复查,PET/CT扫描将不受炎性反应干扰。经本研究相关分析显示,SUV值与VEGF的表达显著相关(图3),且 Veit等[12]研究显示残余灶平均SUV值为8.7(7.7~10.5),显著高于移行区,监测肝脏肿瘤患者血浆VEGF浓度可能将有助于评价RFA治疗效果,但肿瘤残存组织PET/CT表现与VEGF的关系还有待进一步研究。随着分子影像学的发展,已有关于VEGF及其受体显像的研究报告,利用分子影像手段,通过监测VEGF表达来评价RFA治疗肝脏肿瘤疗效将是未来发展的趋势。
从上述分析可以看出,犬正常肝组织RFA术后,热损伤的肝组织经过一个有序的修复过程,VEGF在修复过程中有着重要的作用,并与PET/CT表现存在一定的相关性。本研究不足之处:(1)移行区较薄,对比测量其SUV值影响较大,并且无法排除部分容积效应的影响;(2)正常肝组织RFA术后的病理修复和PET/CT表现及VEGF的表达,还是有别于肝癌等病理组织RFA后的变化,在临床工作中肝脏恶性肿瘤伴(或不伴)肝硬化背景下这些因素可能会对射频效果产生影响,影像特点可能与正常肝组织消融有所不同,相应的病理变化也可能存在差异。为能更准确地判断临床肿瘤RFA治疗后的变化,还有待对肝癌的RFA术后的变化做进一步的实验研究。
[1]Cammà C,Di Marco V,Orlando A,et al.Treatment of hepatocellular carcinoma in compensated cirrhosis with radio-frequency thermal ablation(RFTA):a prospective study[J].J Hepatol,2005,42(4):535-540.
[2]Waki K,Aikata H,Katamura Y,et al.Percutaneous radiofrequency ablation as first-line treatment for small hepatocellular carcinoma:results and prognostic factors on long-term follow up [J].J Gastroenterol Hepatol,2010,25(3):597-604.
[3]Maier-Hein L,Tekbas A,Seitel A,et al.In vivo accuracy assessment of a needle-based navigation system for CT-guided radiofrequency ablation of the liver[J].Med Phys,2008,35(12):5385-5396.
[4]邹立秋,郭辉,杜端明,等.射频毁损后正常兔肝脏CT与病理变化的相关性研究[J].中国医学影像技术,2008,24(1):17-19.
[5]Veit P,Antoch G,Stergar H,et al.Detection of residual tumor after radiofrequency ablation of liver metastasis with dualmodality PET/CT:initial results[J].Eur Radiol,2006,16(1):80-87.
[6]畅智慧,刘兆玉,等.18F-FDG PET、CT及PET/CT对肝脏恶性肿瘤射频消融术后残余瘤诊断的分析[J].中国临床医学影像杂志,2010,21(11):774-777.
[7]Goldberg SN,Charboneau JW,Dodd GD 3rd,et al.Image-guided tumor ablation:proposal for standardization of terms and reporting criteria[J].Radiology,2003,228(2):335-345.
[8]刘兆玉,畅智慧,卢再鸣,等.肝脏恶性肿瘤射频消融术后PETCT早期复查的临床价值[J].中华放射学杂志,2009,43(11):527-530.
[9]范仲凯,谷艳婷,曹阳,等.VEGF121转染对诱导后血管内皮细胞增殖的影响[J].中国医科大学学报,2010,39(8):628-631.
[10]刘兆玉,王传卓,畅智慧,等.正常犬肝脏射频消融后CT、正电子发射计算机体层成像-CT与病理表现的比较[J].中华放射学杂志,2009,44(11):436-441.
[11]Poon RT,Lau C,Pang R,et al.High serum vascular endothelial growth factor levels predict poor prognosis after radiofrequency ablation of hepatocellular carcinoma:importance of tumor biomarker in ablative therapies[J].Ann Surg Oncol,2007,14(6):1835-1845.
[12]Veit P,Antoch G,Stergar H,et al.Detection of residual tumor after radiofrequency ablation of liver metastasis with dual-modality PET/CT:initial results[J].Euro Radiology,2006,16(1):80-87.
