大鼠心肌缺血再灌注早期心肌及血清中IL-6、TNF-α的表达
2013-12-03邹吉丽尹照萍张利群王永权齐国先
邹吉丽,尹照萍,张利群,王永权,齐国先
(1.中国医科大学附属第一医院心血管内科,沈阳 110001;2.宽甸县中心医院心血管内科,辽宁 宽甸 118200;3.辽宁盘锦辽河油田妇婴医院心血管内科,辽宁 盘锦 124010;4.沈阳医学院人文教研室,沈阳 110034)
近年来炎症学说备受重视,炎症在冠心病的发生、发展、治疗、预后中起重要的作用。过度的炎性反应是心肌缺血再灌注损伤的主要机制之一,如白细胞渗出、水肿、组织坏死及炎性细胞因子的释放。主要表现为促炎因子释放增加,其中白细胞介素6(interlukin-6,IL-6)、肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)占主导位置[1]。而确定缺血再灌注损伤早期炎性细胞因子的动态变化,观察其变化规律及峰值出现时间对应用炎性因子抑制剂有积极的指导作用,可进一步有效控制炎症、保护心肌。本研究应用缺血再灌注模型,研究缺血再灌注早期占主导地位的细胞因子IL-6、TNF-α的表达情况,观察其动态变化规律及峰值出现时间。
1 材料与方法
1.1 实验动物及分组
雄性Wistar大鼠98只,体质量260~300 g,由中国医科大学动物实验中心提供。分笼饲养于恒温(20±2)℃、恒湿(50%~60%)、无特殊病原体条件下,饮用水和标准饲料均经灭菌后供动物自由取用。将大鼠随机分为缺血再灌注组:根据大鼠再灌注时间不同分为7个小组,缺血(45 min)再灌注15 min、30 min、1 h、2 h、4 h、6 h、24 h 组,每组 8 只大鼠;假手术组:开胸穿线不结扎,按照再灌注时间又分7个小组,每组6只大鼠。
1.2 主要实验试剂及仪器
ELASA试剂盒(美国R&D公司)、考马斯亮蓝蛋白测定试剂盒(南京建成科技有限公司,批号:090828)、心电图机(上海光电仪器有限公司)、动物人工呼吸机(上海嘉鹏科技有限公司)、石蜡切片机(德国LEICA公司)、高速冰冻离心机(德国Sigma公司)、光学显微镜(日本OLYMPUS公司)、低温冰箱(日本SANYO公司)、ELX-800型酶标仪(美国Bio-tek公司)。
1.3 大鼠心肌缺血再灌注损伤模型制备
大鼠用10%水合氯醛0.04 L/kg腹腔注射麻醉,取仰卧位固定,气管切开插管行小动物呼吸机辅助呼吸,潮气量 0.002~0.003 L,吸呼比 1∶1.5,呼吸频率75次/min。经左前胸第3、4肋间开胸,打开心包,挤出大部分心脏,暴露心脏及左心耳,以5/0线在距冠状动脉前降支根部1~2 mm系1个袢,其间穿过1根塑料管,拉紧袢,观察心电图变化,ST抬高为结扎成功,结扎线以下心肌组织颜色变暗。45 min后拔出塑料管,使冠状动脉血流再通,再灌时局部组织充血。分别于再灌注 15 min、30 min、1 h、2 h、4 h、6 h、24 h,先从右心房取血0.002~0.003 L,注入清洁干燥玻璃试管内,待血液凝固后立即放入离心机3 000 r/min(4℃),离心15 min,取上清液,即得血清标本,-80℃保存待测。取前降支结扎线下2 mm至心尖部左心室缺血心肌组织100 mg,捣碎组织,按1 mg/L加入含蛋白酶抑制剂与细胞裂解液的混合物4°C过夜后,20 000 r/min离心20 min。取上清于-80℃保存待测。假手术组在心脏同样部位穿线但不结扎LAD,于相同时间点相同方法采集标本。
1.4 血清及心肌组织中IL-6、TNF-α含量检测
1.4.1 血清IL-6、TNF-α水平测定:将试剂盒平衡至室温,加入标准品和待测样品,绘制标准曲线。温育、洗涤、显色、终止,以空白孔调零450 nm波长依序测量各孔的吸光度(optical density,OD),计算IL-6、TNF-α的含量。
1.4.2 心肌组织中IL-6、TNF-α含量测定:标本均采用ELISA法检测,操作过程同血清内细胞因子检测,同时用考马斯亮蓝蛋白测定法检测每个组织标本的蛋白含量,得出数值后,将匀浆液中的细胞因子含量(/mL)换算成蛋白中的细胞因子含量(/mg)。
1.5 统计学处理
2 结果
2.1 各组大鼠心肌组织中TNF-α、IL-6含量比较
如表1、表2所示,在假手术组中,大鼠心肌组织中各时间点TNF-α、IL-6含量无明显变化(P>0.05)。在缺血再灌注组,TNF-α和IL-6含量再灌注15 min时开始增高,2 h达高峰,4~6 h逐渐下降,24 h略有回升。与假手术组各对应时间比较有统计学差异(P<0.01)。
表1 心肌组织中TNF-α含量比较(±s,pg/mg)Tab.1 Comparison of content of TNF-αin myocardial tissue(±s,pg/mg)

表1 心肌组织中TNF-α含量比较(±s,pg/mg)Tab.1 Comparison of content of TNF-αin myocardial tissue(±s,pg/mg)
1)P<0.01 vs sham group.
Group TNF-α 15 min 30 min 1 h 2 h 4 h 6 h 24 h I/R 17.61±2.081) 21.75±2.761) 33.56±3.311) 40.23±3.231) 39.35±3.051) 20.55±2.661) 23.77±3.361)Sham 12.61±1.94 14.12±1.70 13.56±1.72 12.96±1.91 13.85±1.27 12.96±2.14 13.71±2.18
表2 心肌组织中IL-6含量比较(±s,pg/mg)Tab.2 Comparison of content of IL-6 in myocardial tissue(±s,pg/mg)

表2 心肌组织中IL-6含量比较(±s,pg/mg)Tab.2 Comparison of content of IL-6 in myocardial tissue(±s,pg/mg)
1)P<0.01 vs sham group.
Group IL-6 15 min 30 min 1 h 2 h 4 h 6 h 24 h I/R 16.34±2.181) 21.23±3.661) 33.54±3.661) 39.24±3.621) 38.15±3.831) 18.93±3.051) 21.93±2.751)Sham 14.48±1.75 15.20±2.02 14.60±1.72 15.56±2.10 15.40±1.73 14.51±2.03 13.68±2.41
2.2 各组大鼠血清不同时间点TNF-α、IL-6含量比较
在假手术组中,TNF-α、IL-6各时间点比较无明显变化(P>0.05)。在缺血再灌注组血清中TNF-α、IL-6再灌注15 min增高,之后持续升高,2 h达高峰,6 h有所下降,24 h略有升高。与假手术组相同时间点比较有统计学差异(P<0.01)。见表3、4。
表3 血清中TNF-α含量比较(±s,ng/mL)Tab.3 Comparison of content of TNF-αin serum(±s,ng/mL)
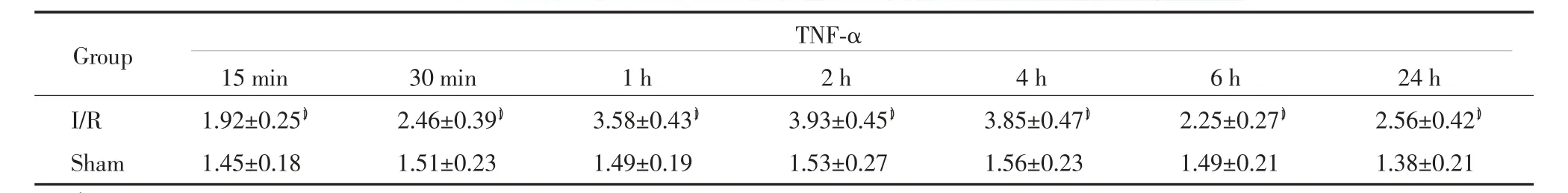
表3 血清中TNF-α含量比较(±s,ng/mL)Tab.3 Comparison of content of TNF-αin serum(±s,ng/mL)
1)P<0.01 vs sham group.
TNF-α 15 min 30 min 1 h 2 h 4 h 6 h 24 h I/R 1.92±0.251) 2.46±0.391) 3.58±0.431) 3.93±0.451) 3.85±0.471) 2.25±0.271) 2.56±0.421)Sham 1.45±0.18 1.51±0.23 1.49±0.19 1.53±0.27 1.56±0.23 1.49±0.21 1.38±0.21 Group
表4 血清中IL-6含量比较(±s,pg/mg)Tab.4 Comparison of content of IL-6 in serum(±s,pg/mg)
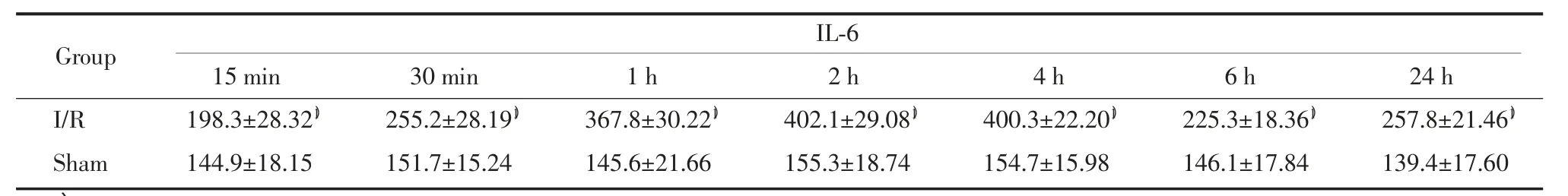
表4 血清中IL-6含量比较(±s,pg/mg)Tab.4 Comparison of content of IL-6 in serum(±s,pg/mg)
1)P<0.01 vs sham group.
IL-6 15 min 30 min 1 h 2 h 4 h 6 h 24 h I/R 198.3±28.321) 255.2±28.191) 367.8±30.221) 402.1±29.081) 400.3±22.201) 225.3±18.361) 257.8±21.461)Sham 144.9±18.15 151.7±15.24 145.6±21.66 155.3±18.74 154.7±15.98 146.1±17.84 139.4±17.60 Group
3 讨论
心肌缺血再灌注损伤是指原缺血心肌恢复血供后发生更为严重的损伤,表现为再灌注心律失常、无复流、心肌顿抑、微循环障碍、猝死等。心肌缺血再灌注存在较复杂的机制,在这过程中,心肌中TNF-α含量明显增加。TNF-α是分子量为17 kDa的可溶性多肽,以二聚体、三聚体或五聚体的形式存在于溶液中,它在机体处于应激状态时由激活的单核细胞、巨噬细胞产生,具有广泛的生物学效应,参与体内肿瘤细胞的杀伤、调节细胞的增殖及体内的免疫代谢等作用,也参与炎性反应、介导休克、组织损伤等病理生理反应[1,2]。TNF-α 可激活细胞因子级联反应,促进氧自由基产生、活化中性粒细胞、诱导心肌细胞凋亡等,加重心肌缺血再灌注损伤。TNF-α产生的具体机制主要包括[3]:(1)过氧化氢诱导的 p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)信号通路,近年来发现该通路为一类新的MAPK通路,不但在炎症、应激反应中起重要作用,而且参与细胞的存活、分化和凋亡等过程。再灌注过程可激活p38 MAPK,使细胞因子产生增多,其中包括TNF-α。(2)心肌缺血再灌注过程可激活核因子 κB (nuclear factor-kappa B,NF-κB),NF-κB 在TNF-α产生的过程中起重要作用。激活NF-κB后,kB 抑制蛋白(inhibition-kappa B,I-κB)磷酸化,导致NF-κB-I-κB 复合物分裂和 I-κB 的降解。NF-κB 一旦从I-κB中裂解出来,就从细胞质转位到细胞核,并与4个NF-κB结合位点中的1个位点相结合而定位于 DNA。I-κB 被 MAPKs磷酸化并激活 NF-κB,转位到细胞核,激活TNF-α基因启动转录。在此过程中,TNF-α通过与靶细胞膜上TNF受体结合,活化的TNF-α受体通过一系列的反应,激活细胞内的信号蛋白,如 Caspases、p38 MAPK 等,导致 Apo-1、NF-κB活化,启动基因转录,调节细胞分化、存活和死亡[3]。因此阻断TNF-α的产生,抑制其活化就可减轻缺血再灌注损伤的发生。
IL-6由多种细胞产生,主要由活化的中性粒细胞产生,也可由内皮细胞和血管平滑肌细胞产生,活化的单核细胞是血液中IL-6的主要来源,局部组织的IL-6主要由成纤维细胞或局部巨噬细胞产生。IL-6是分子量19~28 kDa的糖蛋白,人IL-6前体为212肽,包括一段28肽的信号肽,成熟的IL-6含184个氨基酸残基,转录后修饰时有N糖基化、O糖基化和磷酸化。对免疫应答、急性期反应、造血和神经系统有多方面的作用。在病理状态下,细胞因子IL-6会出现异常表达,表现为IL-6及其受体的缺陷、IL-6表达过高以及可溶性细胞因子受体的水平增加等[4]。研究表明,心肌细胞产生IL-6主要由缺血及再灌注诱导[5]。IL-6处于炎症调控的枢纽位置,可诱导中性粒细胞内流入缺血心肌组织,刺激中性粒细胞、心肌细胞表面分别表达CDllb/CDl8及细胞间黏附分子1,介导与心肌细胞结合,损伤心肌。目前已知,炎性细胞因子一方面能够引起心肌收缩力下降,同时也能促使心肌细胞肥大、诱导心肌细胞表达胚胎型蛋白、促进细胞凋亡及心肌细胞外基质发生改变,动物实验证实心肌梗死后激活免疫系统而发生的自身免疫反应也是导致心肌细胞丧失的原因之一[6]。心肌梗死后,细胞因子明显表达,在急性冠脉综合征早期干预治疗的过程中[7],特别是在缺血再灌注损伤的保护机制中,炎性细胞因子起着明显的反面作用。研究表明[7],细胞因子参与冠状动脉硬化形成过程。动物实验亦证实心肌梗死后因免疫系统激活而发生的自身免疫反应也是导致心肌细胞丧失的原因之一[6]。
本实验结果发现,在缺血再灌注损伤早期细胞因子IL-6、TNF-α明显表达,并呈动态变化,再灌注15 min,TNF-α、IL-6 已增高,2~4 h 达峰值,4 h 后逐渐下降,可以观察到,血清与心肌组织中炎性细胞因子的表达浓度、动态变化基本相同。但通过观察外周血炎性细胞因子的变化和浓度是否可以来判断组织的损伤时间及程度还需要我们进一步研究和探讨。
综上所述,本研究探讨了缺血再灌注损伤早期炎性细胞因子的表达及规律,为早期应用炎性细胞因子抑制剂、进一步保护心肌提供理论依据,但其具体机制及更有效的药物及给药方法还需要我们进一步的研究和探讨。
[1]刘保江.丙泊酚对大鼠急性心肌缺血再灌注损伤时NF-κB、TNF-α及IL-6表达的影响[D].山西医科大学,2007.
[2]Morgan MJ,Kim YS,Liu ZG.TNF-alpha and reactive oxygen species in necrotic cell death[J].Cell Res,2008,18(3):343-349.
[3]Bartee E,Mohamed MR,McFadden G.Tumor necrosis factor and interferon:cytokines in harmony[J].Curr Opin Microbiol,2008,11(4):378-383.
[4]Dhingra S,Sharma AK,Slngla DK,et al.P38 and ERKI/2MAPKs mediate the interplay of TNF-alpha and IL-10 in regulating oxidative stress and cardiac myoyte apoptosis[J].Am J Physiol Heart Circ Physiol,2007,293(6):H3524-3531.
[5]齐晓云,徐萍,李春华,等.血浆组织因子及其途径抑制物对急性心肌梗死患者雷帕霉素支架置入后血栓形成的影响[J]中国医科大学学报,2011,40(7):639-641.
[6]谷高玲,赵国安,孙海燕,等.冠心病患者细胞因子信号转导抑制剂 1基因多态性的临床意义[J].中国医科大学学报,2013,42(5):436-438.
[7]Chao W.Toll-like receptor signaling:a critical modulator of cell survivalandischemicinjuryintheheart[J].AmJPhysiolHeartCircPhysiol,2009,296(1):H1-12.
