NODAL基因在室间隔缺损胎儿心脏组织中的表达变化及作用机制的研究
2013-12-03孙磊宋双李辉苏冬梅
孙磊,宋双,李辉,苏冬梅
(1.中国医科大学附属盛京医院妇产科,沈阳 110004;2.国家计生委科学技术研究所遗传实验室,北京 110081)
NODAL基因是最早的合子基因,它在哺乳动物的心脏发育中发挥了重要作用[1]。研究显示,在与心脏发育密切相关转录因子CITED2缺失的小鼠胚胎中,伴随着左侧侧板中胚层中信号转导因子如PITX2C、EBAF、NODAL等表达明显降低,进而造成心脏流道、房室间隔畸形等的产生[2]。本研究以中国人群为研究对象,通过检测先心病和正常组织中NODAL基因表达变化,初步确定NODAL信号通路异常与先心病发生的关系,并通过荧光素酶报告基因系统和免疫共沉淀实验对SMAD2、CITED2(camp反应元件结合蛋白/p300结合转化激活因子,含谷氨酸和天冬氨酸丰富羧基末端域)与NODAL基因之间相互作用进行研究。
1 材料与方法
1.1 试剂
TaKaRa RNAiso Reagent(日本TaKaRa公司);逆转录试剂盒(美国Promega公司);实验室常用化学药品(北京化学试剂公司);引物(从北京英俊生物公司合成);在质粒构建实验过程中所需要使用的各种限制性内切酶、连接酶、DNA Marker和普通PCR反应中的Premix ExTaq(日本TaKaRa公司);荧光素酶报告基因检测试剂盒(美国Promega公司);鼠抗 β-肌动蛋白抗体(美国 Sigma公司);兔抗NODAL抗体(美国Abcam公司);SuperSignala West Pico化学发光底物(美国Pierce公司);兔抗CITED2抗体(美国Abcam公司);兔抗SMAD2抗体(美国Cell Signaling Technology公司);Lipofectamine 2000试剂盒(美国Invitrogen公司);二抗:辣根过氧化物酶标记的山羊抗鼠和山羊抗兔二抗(美国Pierce公司);蛋白:兔IgG蛋白(北京中衫金桥生物技术有限公司);H9C2细胞系(协和基础医学细胞中心)等。
1.2 实验分组和心脏组织的处理
选取2009年10月至2011年10月在中国医科大学附属盛京医院住院的超声和解剖同时诊断的孕周为24~26周引产的先心病胎儿心脏组织16例为实验组,并以同期同孕周因计划外妊娠引产、难免流产等16例正常胎儿心脏组织为对照组(本试验在孕妇及家属签署知情同意书和医院伦理委员会同意下进行)。组织取出液氮速冻4 h后-80℃保存。
1.3 荧光定量逆转录聚合酶链反应(RT-qPCR)
1.3.1 逆转录(Reverse Transcription,RT):逆转录使用Promega公司的Reverse Transcription System试剂盒进行,按照试剂盒说明书进行实验。
1.3.2 荧光定量 PCR(Real-time PCR):(1)Real-time PCR实验使用ABI PRISM誖7000序列检测系统(PE Applied Biosystems,美国)。PCR反应采用两步法进行,反应条件为95℃60 s,然后95℃15 s和60℃60 s,持续40个循环,做3个复孔。所得结果的Ct值(threshold cycle)定义为达到超出荧光信号的检测阈值时所需要的循环数;ΔCt值=目的基因Ct值-βactinCt值;ΔΔCt值=样品组 ΔCt值-对照组 ΔCt值。所得的数据应用ABI公司(Applied Biosystems)所提供的软件以2-ΔΔCt方法来计算。(2)引物及内参:NODAL 基因引物序列为 sense,5′-GAGACATATGT GCATGTATTTTGGA-3′,antisense,5′-TGAGATTGAC GGACTCTTTTTAATC-3′。β-肌动蛋白(β-actin)的引物序列为:sense,5′-TCGTGCGTGACATTAAGGAG-3′,antisense,5′-ATGCCAGGGTACATGGTGGT-3′。其中β-actin作为内参。
1.4 蛋白免疫印迹
免疫印迹(Western blot)采用聚丙烯酰胺凝胶电泳。将10~20 μL组织裂解物进行SDS-PAGE电泳;将蛋白样品从SDS-PAGE凝胶转移至PVDF膜,将转移后的PVDF膜置于封闭液中,37℃封闭1 h;PBST洗膜3次,加入用抗体稀释液稀释为工作浓度的一抗(兔抗NODAL抗体1∶500,兔抗CITED2抗体1∶500,兔抗SMAD2抗体1∶300稀释)4℃过夜孵育。PBST缓冲液中洗膜3次;加入用抗体稀释液稀释的辣根标记的二抗(1∶2 000稀释),37℃轻轻摇动40 min,PBST缓冲液洗膜3次,加入发光底物反应5 min,曝光。
1.5 质粒构建、细胞培养,转染和荧光素酶报告基因检测
通过采用聚合酶链反应(PCR)扩增人类基因组DNA中NODAL启动子区1个长794碱基的片段,将此片段克隆到两端加酶切位点EcoRⅠ和KpnⅠ与荧光素酶报告 PGL3-basic载体连接,PGL3-NODAL质粒构建成功。SMAD2片段PCR扩增,插入XhoⅠ和HindⅢ双酶切位点和GFP载体相连,pEGFP-SMAD2质粒构建成功。CITED2片段PCR扩增,插入HindⅢ和XhoⅠ双酶切位点和pcDNA3-Flag载体相连,pcDNA3-Flag-CITED2质粒构建成功 。 H9C2 细 胞 在 Iscove′s Modified Dulbecco′s Medium(IMDM)培养基(包含10%胎牛血清,青霉素100 mg/mL,链球菌100 mg/mL)在37°C含有5%CO2潮湿环境下培养。H9C2细胞瞬时转染使用Lipofectamine 2000(Invitrogen)试剂盒,检测转染细胞荧光素酶报告使用Promega公司的双荧光素酶报告基因检测系统。将要检测的SMAD2、CITED2表达质粒与报告基因质粒PGL3-NODAL质粒共转染H9C2细胞。如果SMAD2和CITED2能够激活NODAL基因启动子,则荧光素酶基因就会表达,荧光素酶的表达量与转录因子的作用强度成正比。
1.6 免疫共沉淀
免疫共沉淀在H9C2心肌细胞系中进行,SMAD2-GFP、Flag-CITED2和转染细胞的总细胞提取物加入40 μL protein A琼脂糖珠4°C孵育1 h,将40 μL protein A琼脂糖珠加入到上清液中和抗体孵育过夜的细胞裂解液中4°C缓慢摇晃孵育3 h,使抗体与protein A琼脂糖珠偶连。免疫沉淀反应后,用100 μL 2×loading buffer将琼脂糖珠-抗原抗体复合物悬起并煮沸10 min。采用聚丙烯酰胺凝胶电泳将蛋白质从聚丙烯酰胺凝胶转移至PVDF膜上和CITED2抗体 (Abcam)或者SMAD2抗体(Cell Signaling Technology)做免疫检测。
1.7 统计学分析
2 结果
2.1 室间隔缺损心脏组织中的NODAL基因的表达降低
NODAL mRNA表达水平的RT-PCR分析结果(图1):NODAL mRNA在室间隔缺损心脏组织较对照组的表达水平显著降低,差异有统计学意义(P<0.01)。见图1A。
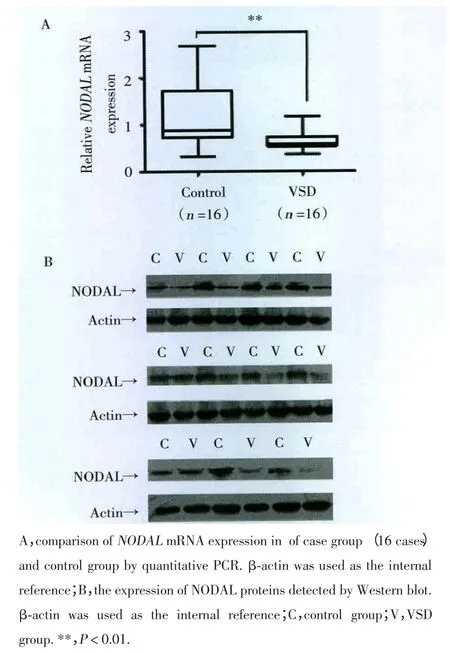
图1 室间隔缺损心脏组织NODAL基因表达降低Fig.1 Down-regulation of NODAL in the cardiac tissues from patientswith VSDs
NODAL蛋白质表达水平的Western blot分析结果:室间隔缺损心脏组织中可检测出NODAL蛋白质,并且在室间隔缺损中表达量明显小于对照组,差异有统计学意义(P<0.01)(图1B)。
2.2 Smad2、Cited2能够上调NODAL基因表达,激活NODAL基因启动子
荧光素酶报告基因检测实验发现SMAD2和CITED2分别能上调NODAL基因表达。CITED2和SMAD2同时表达时NODAL基因的启动子活性呈4.3倍上调,SMAD2和转录辅因子CITED2协同调控NODAL基因表达。因此推测CITED2作为转录因子SMAD2转录辅因子共同调控NODAL基因的表达,(图2)。
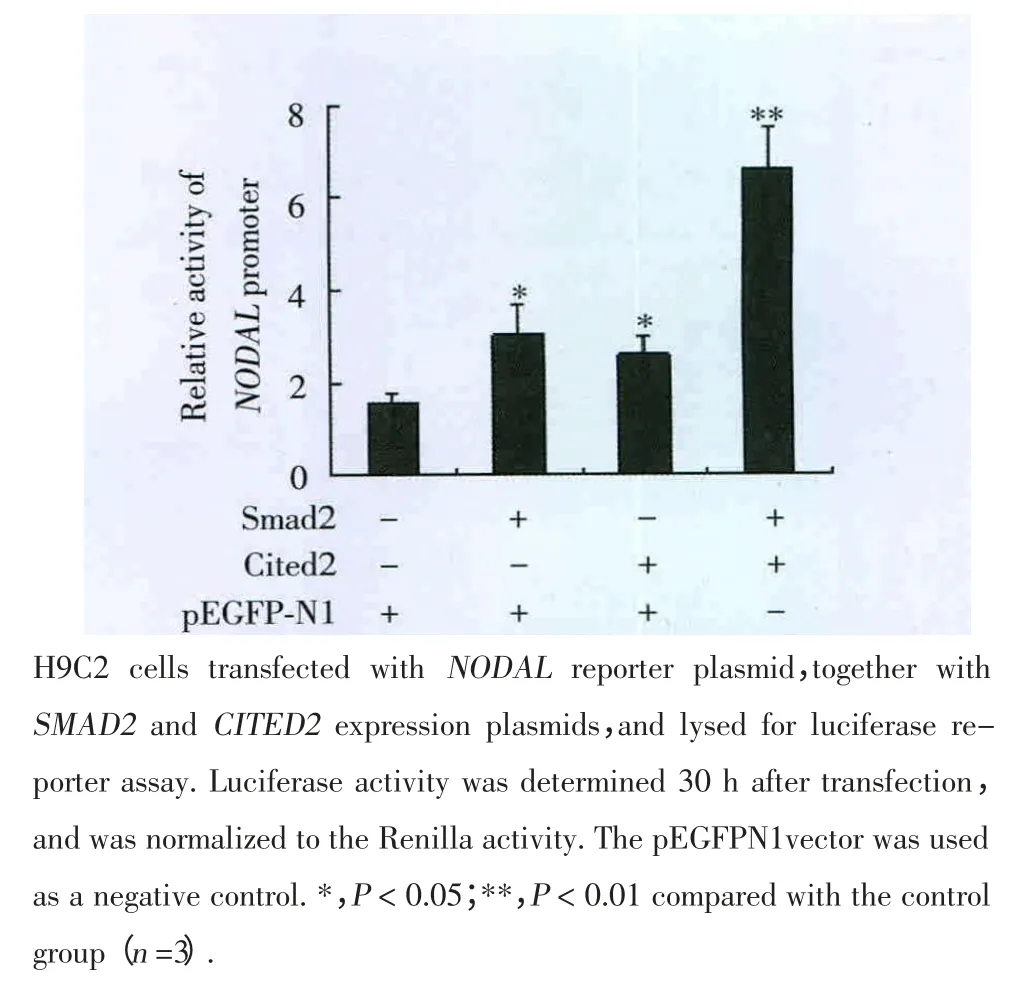
图2 荧光素酶报告基因检测Cited2和Smad2协同调控NODAL基因表达Fig.2 Luciferase reporter gene assay experimental results:CITED2functions co-operatively with SMAD2 for expressionof NODAL gene
2.3 CITED2、SMAD2存在于同一转录复合物中
荧光素酶报告基因检测表明SMAD2和转录辅因子CITED2协同调控NODAL基因表达。同时本研究采用了免疫共沉淀实验来探讨是否存在两个转录调节因子之间的相互作用。在免疫共沉淀实验中,H9C2细胞和SMAD2-GFP表达载体共同转染,加入抗GFP抗体进行免疫沉淀,沉淀的蛋白质和CITED2抗体进行免疫印迹检测(图3A)。同时H9C2细胞和Flag-CITED2表达载体共同转染,加入抗Flag抗体进行免疫沉淀,沉淀的蛋白质和SMAD2抗体进行免疫印迹检测(图3B)。通过免疫共沉淀实验表明CITED2和SMAD2存在于同一转录复合物中共同调控NODAL基因的表达。
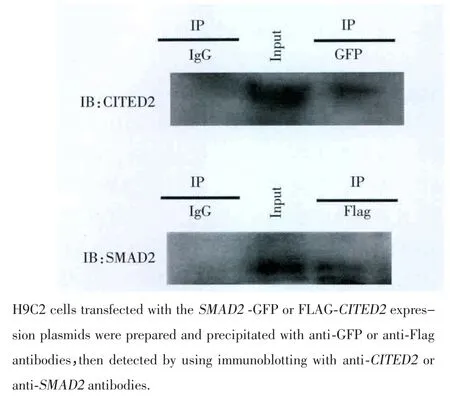
图3 CITED2和SMAD2免疫共沉淀实验结果Fig.3 Co-IP assays results of CITED2 and SMAD2
3 讨论
先天性心脏病(congenital heart disease,CHD)是指胎儿时期心脏、血管发育障碍所导致的形态、结构和功能异常的一组先天畸形,是一类常见的危害婴幼儿健康的疾病,其在新生儿中的发病率约为1%[3,4]。 随着全球患病率逐年增长,CHD已引起广大学者和临床医生的高度重视,CHD病因学的研究对提高出生人口质量、降低出生人口病死率具有重大意义。室间隔缺损是常见的CHD之一[5],胚胎期遗传因素和环境因素在其形成中扮演着重要的角色。但这种心脏缺陷形成的确切的分子生物学机制目前依然不明。
最新研究揭示了大量CHD的致病和易患基因[6,7],心脏特异转录因子是其中的一部分,主要指的是在心肌细胞中表达并调控编码心肌细胞结构蛋白或调节心脏基因蛋白表达的关键的转录活化因子[8,9]。转录共激活因子CITED2是转录激活因子家族中的新成员,通过乙酰化组蛋白和p300同源蛋白质来控制其他转录因子的活性,从而调控相关基因的表达,其活性异常可引起一些疾病。CITED2和SMAD2被形容为心脏特异性基因表达的重要调节基因。敲除掉CITED2的小鼠表现为各种心脏畸形,包括心房和心室间隔缺损,右侧主动脉弓,右心室双出口,共同动脉干和主动脉骑跨[10]。信号传导蛋白SMAD2基因其磷酸化不利于心脏的正常发育[13,14],SMAD2的异常磷酸化也可引起心脏发育异常。有研究显示在散发的先心病患者中存在CITED2和SMAD2基因突变,其中CITED2基因突变也在少量室间隔缺损病例中被发现[11,12]。本研究中荧光素酶报告检测分析和免疫共沉淀实验的结果表明CITED2、SMAD2存在于同一转录复合物中共同调控NODAL基因的表达。本研究还发现室间隔缺损心脏组织中的NODAL基因的表达降低。
本研究通过病变组织的研究确定了NODAL信号异常表达很可能是人类室间隔缺损发生的原因之一,为先心病的诊断、治疗、预防、预后及风险预测提供了一定的科学理论依据。同时还发现SMAD2和CITED2分别能调节NODAL基因的表达,CITED2、SMAD2可能存在于同一转录复合物中共同调控NODAL基因的表达。综上所述我们可以推测:CITED2和SMAD2基因突变导致心脏畸形的原因可能是由于NODAL信号通路缺陷所致。
[1]Range R,Lapraz F,Quirin M,et al.Cis-regulatory analysis of NODAL and maternal control of dorsal-ventral axis formation by Univin,a TGF-beta related to Vg1[J].Development,2007,134(20):3649-3664.
[2]Weninger WJ,Lopes Floro K,Bennett MB,et al.CITED2 is required both for heart morphogenesis and establishment of the left-right axis in mouse development[J].Development,2005,132(6):1337-1348.
[3]Hoffman JI,Kaplan S.The incidence of congenital heart disease[J].J Am Coll Cardiol,2002,39(12):1890-1900.
[4]Garne E,Stoll C,Clementi M.Evaluation of prenatal diagnosis of congenital heart diseases by ultrasound:experience from 20 European registries[J].Ultrasound Obstet Gynecol,2001,17(5):386-391.
[5]Zhu C,Yu ZB,Chen XH,et al.Screening for differential methylation status in fetal myocardial tissue samples with ventricular septal defects by promoter methylation microarrays[J].Mol Med Report,2011,4(1):137-143.
[6]Srivastava D,Olson EN.A genetic blueprint for cardiac development[J].Nature,2000,407(6801):221-226.
[7]Nemer M.GenetiCINsights into normal and abnormal heart development[J].Cardiovasc Pathol,2008,17(1):48-54.
[8]Bruneau BG.Transcriptional regulation of vertebrate cardiac morphogenesis[J].Circ Res,2002,90(5):509-519.
[9]Bentham J,Bhattacharya S.Genetic mechanisms controlling cardiovascular development[J].Ann N Y Acad Sci,2008,1123:10-19.
[10]Bamforth SD,Braganca J,Farthing CR,et al.CITED2 controls leftright patterning and heart development through a NODAL-Pitx2c pathway[J].Nat Genet,2004,36(11):1189-1196.
[11]Yang XF,Wu XY,Li M,et al.Mutation analysis of CITED2 in patients with congenital heart disease [J].Zhonghua Er Ke Za Zhi,2010,48(4):293-296.
[12]Sperling S,Grimm CH,Dunkel I,et al.Identification and functional analysis of CITED2 mutations in patients with congenital heart defects[J].Hum Mutat,2005,26(6):575-582.
[13]Roest PA,Molin DG,Schalkwijk CG,et al.Gittenberger-de Groot,Specific local cardiovascular changes of Nepsilon-(carboxymethyl)lysine,vascular endothelial growth factor,and SMAD2 in the developing embryos coincide with maternal diabetes-induced congenital heart defects[J].Diabetes,2009,58(5):1222-1228.
[14]Tang S,Snider P,Firulli AB,et al.Trigenic neural crest-restricted Smad7 over-expression results in congenital craniofacial and cardiovascular defects[J].Dev Biol,2010,344(1):233-247.
