柴胡皂苷d对SH-SY5Y细胞一氧化氮及JNK磷酸化水平的影响
2013-12-03李妍纪朋艳彭顺利张巍吕士杰何哲
李妍,纪朋艳,彭顺利,张巍,吕士杰,何哲
(吉林医药学院1.生物化学与分子生物学教研室;2.生物化学与分子生物学实验室;3.临床医学院;4.药学院,吉林 吉林 132013)
柴胡是我国的传统中药,始载于《本经》,按性状及生长地理位置的不同又分为北柴胡和南柴胡[1]。柴胡性味苦,微寒,归肝胆实经,中医认为其具有升阳举气、躯散退热、疏肝解郁等功效,在临床上常用于治疗头痛目眩、寒热往来、口苦耳聋、胸满肋痛、月经不调、子宫下垂等症[2]。柴胡所含化学成分较多,目前已经发现或提取的有效成分有柴胡皂苷(Saikosaponin,SS)、挥发油、黄酮、多元醇、脂肪酸、多糖等成分,其主要活性成分为SS及挥发油。现已从柴胡属植物中分离出90多种齐墩果烷型皂苷类成分。研究发现,SS具有广泛的药理作用,如抗癌、抗炎、抗病毒、镇静、止痛等。根据SS化学结构的差异,可分为 SSa、SSb、SSc、SSd 等,其中 SSd 的生物学活性最强。本实验以人神经母细胞瘤SH-SY5Y细胞为研究对象,在前期的研究基础上进一步观察了SSd对SH-SY5Y细胞培养基中一氧化氮(nitric oxide,NO)含量的影响,并观察了SSd预处理后细胞JNK蛋白磷酸化水平的改变,以期对SSd抑制肿瘤细胞增殖的相应机制进行初步研究。
1 材料与方法
1.1 材料
1.1.1 细胞系及主要试剂:SH-SY5Y细胞,购自中国科学院上海生命科学研究院;SSd,购自中国药品生物制品检定所;胎牛血清,元亨生物科技有限公司产品;DMEM高糖培养基,美国Hyclone公司生产;DMSO,购自天津市大茂化学试剂厂;NO检测试剂盒,碧云天生物技术研究所产品;JNK及p-JNK抗体,美国Cell Signaling Technology公司产品;ECL化学发光剂,碧云天生物技术研究所生产。
1.1.2 仪器:细胞培养箱,北京东方安若生化科技有限公司生产;超净台,苏州净化仪器厂产品;酶标仪,购自美国Bio-Rad公司;细胞培养瓶,加拿大JET公司生产;96孔板,美国Cornning公司产品。
1.2 方法
1.2.1 SH-SY5Y细胞培养:SH-SY5Y细胞株接种于无菌培养瓶中,加入DMEM高糖培养基(含体积分数为10%的灭活胎牛血清,100 U/mL青霉素及100 U/ml链霉素),置于体积分数为5%CO2的37℃恒温培养箱中常规培养,待细胞长至培养瓶底面积80%之后传代,传代时用0.25%胰蛋白酶消化2~3 min,再以培养基吹打制成细胞悬液后重新接种。
1.2.2 SSd药物配制:我们的先期实验筛选了溶解SSd的溶剂DMSO的无毒作用浓度,发现0.1%~0.4%的DMSO对SH-SY5Y细胞生长增殖没有明显影响[3],故将SSd标准品粉末溶于含0.3%DMSO的DMEM高糖培养基,0.22微孔滤膜过滤除菌,使SSd在DMEM高糖培养基中的终浓度分别为0(对照组)、4、8、10 μmol/L。
1.2.3 SSd对SH-SY5Y细胞培养基中NO含量的影响:取对数生长期的SH-SY5Y细胞,吸弃其细胞培养液,用0.25%胰酶消化后按3×104/mL接种于24孔板中,常规培养。待细胞贴壁后,给予溶于0.3%DMSO的不同浓度SSd。继续培养48 h,取出培养板,按照碧云天生物技术研究所NO检测试剂盒说明书测定各组培养基中NO含量,每个样本均设8个平行组。
1.2.4 Western blot检测SH-SY5Y细胞中JNK及p-JNK 表达水平:SH-SY5Y细胞以含 0、4、8、10 μmol/L SSd的DMEM完全培养基培养48 h后,吹打收集细胞,预冷的裂解液每组100 μL冰上裂解10 min,BCA蛋白定量试剂盒测定蛋白含量后进行聚丙烯酰胺凝胶电泳,各组样品上样量均为50 μg蛋白,4℃低温条件下电转。将NC膜以50 g/L脱脂奶粉封闭液室温封闭2 h。将JNK及p-JNK一抗分别用封闭液按1∶1 000稀释后加于NC膜上,4℃过夜。后用封闭液洗膜3次×5 min,将二抗用封闭液按比例稀释后滴加于NC膜上,37℃作用1 h,TBS洗膜3次×5 min。待NC膜稍干后,在膜上滴加1 mL化学荧光液,反应约1 min后用保鲜膜覆盖,在暗盒中用X线胶片压片成像,后显影、定影。图像经GeneGenius凝胶成像分析系统进行分析。
1.3 统计学分析
2 结果
2.1 SSd对SH-SY5Y细胞培养基中NO含量的影响
如图1所示,与对照组相比,当SSd浓度为4 μmol/L、8 μmol/L 及 10 μmol/L 时,SH-SY5Y 细胞培养基中NO含量均明显减少,其中4 μmol/L SSd组培养基中NO含量最低。上述结果表明,一定浓度的SSd可抑制该肿瘤细胞中NO的生成及释放。
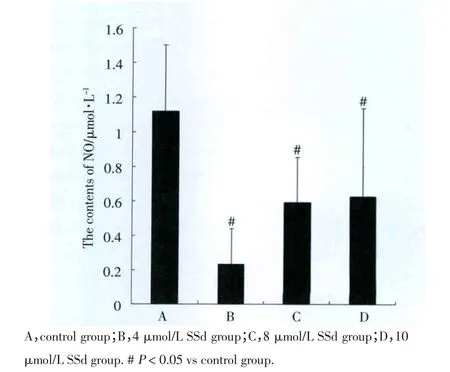
图1 SSd对SH-SY5Y细胞培养基中NO含量的影响Fig.1 The effects of SSd on the levels of NO in cell culture ofSH-SY5Y cells
2.2 Western blot结果
SH-SY5Y 细胞给予 0、4、8、10 μmol/L SSd 作用48 h 后,与对照组相比,4 μmol/L SSd 组、8 μmol/L SSd组及10 μmol/L SSd组JNK蛋白磷酸化水平明显升高,且随着SSd浓度的增加,SH-SY5Y细胞p-JNK表达量逐渐增加(图2)。

图2 SSd对SH-SY5Y细胞JNK磷酸化水平的影响Fig.2 The effects of SSd on JNK phosphorylation in SH-SY5Ycells
3 讨论
NO为一种无色无味的气体,早在十六世纪初期,比利时科学家Helmont首次制备出该气体分子。1980年美国药理学家Furchgott等发现血管内皮细胞可产生并释放一种具有舒血管作用的生物活性物质——内皮源性舒张因子,1986年多个实验小组经实验证实内皮源性舒张因子就是NO。作为1992年美国《科学》杂志评选的该年度“明星分子”,NO的研究自二十世纪九十年代以来发展迅速,一跃成为生物医学领域研究的热点和前沿之一[4]。随着研究的深入,其在生物体内各种生理及病理过程中所起的重要作用被不断发现。目前认为,NO是一种重要的气体信号转导分子和效应分子,广泛存在于生物体内的各种组织、器官,具有影响细胞凋亡、免疫调节、参与心血管疾病发生及发展、预防肺部疾病发生等多种功效[5~9]。研究发现,NO在不同的生理及病理条件下对不同的细胞可以表现出促进或抑制细胞增殖的双重作用,这也体现了NO生物活性的多样性和复杂性。本课题组率先研究了SSd对SH-SY5Y细胞的作用及相应分子机制。我们前期观察了不同浓度的SSd对SH-SY5Y细胞生长、增殖的影响,并证实一定浓度的SSd可明显抑制SH-SY5Y细胞的生长及增殖,且呈浓度效应关系。在此基础上,我们进一步研究了SSd是否对SH-SY5Y细胞NO的生成量有所影响。研究结果显示,在一定范围内,随着SSd浓度的增加,SH-SY5Y细胞培养基中NO的浓度与对照组相比明显降低,证实SSd可减少该肿瘤细胞系产生及释放NO分子,提示SSd可能通过抑制NO信号分子的产生而影响细胞生长增殖。同时,我们观察到4 μmol/L SSd组NO浓度下降最为明显,这可能是由于该浓度的SSd对SH-SY5Y细胞一氧化氮合酶活性的影响较大,因此对NO的生成抑制作用较强。
JNK又被称为应激活化蛋白激酶,为丝裂原激活的蛋白激酶家族的主要成员之一。研究发现,体内外的各种信号分子,如电离辐射、渗透压、热休克、氧化损伤、细胞因子、生长因子等均可激活JNK信号转导通路。目前认为,JNK信号转导通路在应激反应、细胞分化、细胞凋亡以及多种疾病的发生及发展过程中起着至关重要的作用。JNK信号转导通路异常改变可引起肿瘤、神经退行性改变、缺血再灌注损伤、慢性炎症、糖尿病等多种病理变化[10~14]。大量研究结果证实,JNK活化后可促进多种细胞发生凋亡。有研究显示,JNK的激活在NO诱导的细胞凋亡中起一定的作用,具体机制可能与caspase-3的活性增强有关[15]。
我们的实验结果表明,一定浓度的SSd可引起SH-SY5Y细胞中p-JNK表达量明显增加,且随着SSd浓度的增加,JNK磷酸化水平呈逐渐上升趋势,提示在SSd引起的肿瘤细胞生长增殖抑制过程中有JNK信号转导分子的激活。由此可见,NO及JNK在不同诱导因素的作用下发生的改变也有所不同。接下来,我们将进一步深入研究SSd引起的NO生成量的变化及JNK蛋白磷酸化水平改变的分子机制以及二者之间是否存在相关性。
[1]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010,263-264.
[2]轩宇鹏.新编百草名方大全[M].西安:陕西科学技术出版社,2010,318-320.
[3]李妍,张巍,罗军,等.五味子甲素对MPP+诱导的SH-SY5Y细胞毒性作用的影响[J].毒理学杂志,2013,27(1):7-9.
[4]Koshland DE.The molecule of the year [J].Science,1992,258(5090):1861-1861.
[5]Patruno A,Tabrez S,Amerio P,et al.Kinetic study on the effects of extremely low frequency electromagnetic field on catalase,cy-tochrome P450 and inducible nitric oxide synthase in human HaCaT and THP-1 cell lines[J].CNS Neurol Disord Drug Targets,2011,10(8):936-944.
[6]Song S,Zhou F,Chen WR,et al.PDT-induced HSP70 externalization up-regulates NO production via TLR2 signal pathway in macrophages[J].FEBS Lett,2013,587(2):128-135.
[7]Drake MG,Kaufman EH,Fryer AD,et al.The therapeutic potential of Toll-like receptor 7 stimulation in asthma [J].Inflamm Allergy Drug Targets,2012,11(6):484-491.
[8]Severcan C,Cevik C,Acar HV,et al.The effects of acupuncture on the levels of blood pressure and nitric oxide in hypertensive patients[J].Acupunct Electrother Res,2012,37(4):263-275.
[9]Sharma S,Sun X,Agarwal S,et al.Role of carnitine acetyl transferase in regulation of nitric oxide signaling in pulmonary arterial endothelial cells[J].Int J Mol Sci,2012,14(1):255-272.
[10]Yang XJ,Chen GL,Yu SC,et al.TGF-β1 enhances tumor-induced angiogenesis via JNK pathway and macrophage infiltration in an improved zebrafish embryo/xenograft glioma model[J].Int Immunopharmacol,2013,15(2):191-198.
[11]Chambers JW,Howard S,LoGrasso PV.Blocking c-Jun N-terminal kinase(JNK)translocation to the mitochondria prevents 6-hydroxydopamine-induced toxicity in vitro and in vivo[J].J Biol Chem,2013,288(2):1079-1087.
[12]Chambers JW,Pachori A,Howard S,et al.Inhibition of JNK mitochondrial localization and signaling is protective against ischemia/reperfusion injury in rats[J].J Biol Chem,2013,288(6):4000-4011.
[13]Lu XT,Liu YF,Zhao L,et al.Chronic psychological stress induces vascular inflammation in rabbits[J].Stress,2013,16(1):87-98.
[14]Sedeek M,Gutsol A,Montezano AC,et al.Renoprotective effects of a novel Nox1/4 inhibitor in a mouse model of type 2 diabetes[J].Clin Sci,2013,124(3):191-202.
[15]郑关毅,陈晓春,刘昌云,等.一氧化氮激活应激活化蛋白激酶/c-Jun氨基末端激酶及p38 MAP激酶诱导脑缺血再灌注后神经元凋亡[J].解剖学报,2006,37(6):633-639.
