TRPC6在PDGF诱导的大鼠气道平滑肌细胞增殖中的作用*
2013-12-01许继德岳喜磊韩志远杨春涛
成 莹, 曾 欣, 许继德, 岳喜磊, 韩志远, 杨春涛
(广州医科大学生理学教研室,广东广州510182)
支气管哮喘是由多种细胞及其组分共同参与,以可逆性气流阻塞和气道高反应性为特征的慢性炎症性疾病,气道重塑是其主要特征之一。哮喘气道重塑时气道结构发生诸多改变,其中气道平滑肌细胞 (airway smooth muscle cells,ASMCs)肥大和增生是气道重塑主要的病理改变。有效抑制ASMCs的过度增殖,是治疗难治性哮喘的重要途径。目前参与哮喘气道平滑肌细胞增殖的机制尚不清楚。已知Ca2+参与调节细胞的生长和增殖[1],而TRPC在调控细胞内Ca2+平衡中和细胞增殖中发挥重要作用。TRPC基因家族可编码介导胞外Ca2+内流的通道,是构成钙库操纵性Ca2+通道(store-operated Ca2+channels,SOCs)及受体操纵性Ca2+通道 (receptor-operated Ca2+channels,ROCs)的重要分子基础。血小板源性生长因子 (platelet-derived growth factor,PDGF)作为重要的促有丝分裂原可引起ASMCs的增殖,已有研究证实经典瞬时受体电位通道6(transient receptor potential channel 6,TRPC6)在 PDGF诱导的大鼠肺动脉平滑肌的增殖中发挥重要作用[2],但目前尚未明确在其促进ASMCs增殖中是否有TRPC的参与。本实验以体外培养的大鼠ASMCs为研究对象,探讨TRPC通道是否参与了PDGF诱导的ASMCs增殖,为临床防治哮喘提供新的靶点。
材料和方法
1 材料
清洁级雄性SD大鼠(10~12周)购自广东省医学实验动物中心;胎牛血清(fetal bovine serum,FBS)和DMEM/F12培养基购自HyClone;PDGF购自R&D;CCK-8检测试剂盒购自日本同仁化学研究所;小鼠抗大鼠α-SMAⅠ抗购自Sigma-Aldrich;兔抗大鼠TRPC6Ⅰ抗购自Abcam;β-actin单克隆抗体购自杭州联科生物科技有限公司;FITC标记的山羊抗小鼠的Ⅱ抗和FITC标记的山羊抗兔的Ⅱ抗购自北京中杉金桥生物技术有限公司;HRP标记羊抗兔IgG和HRP标记羊抗小鼠IgG购自武汉博士德生物技术有限公司;TRPC6阻断剂 SKF96365购自 Sigma-Aldrich;PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒和SYBR® Premix Ex TaqTMⅡ(Perfect Real Time)试剂盒购自日本宝生物工程有限公司;PCR扩增引物由大连宝生物公司合成,引物序列见表1。

表1 引物序列Table 1.The sequences of the primers
2 方法
2.1 大鼠气道平滑肌细胞的培养和鉴定 酶消化法联合组织贴块法培养ASMCs并对ASMCs进行形态学及细胞内α-SMA进行间接免疫荧光鉴定,取3~6代细胞用于实验。
2.2 CCK-8法检测 PDGF诱导大鼠ASMCs增殖的作用 第3~6代ASMCs接种于96孔培养板中,按照以下方式分组处理:(1)2.5%FBS培养基(无细胞)空白对照组;(2)2.5%FBS培养基阴性对照组;(3)10%FBS培养基阳性对照组;(4)20μg/L PDGF+2.5%FBS培养基组。当细胞融合度达50%左右时,换用无血清培养基继续培养24 h,以使细胞同步化于G0期后按上述分组,将各孔细胞分别换用相应的培养基分别继续培养6 h、12 h、24 h和48 h后加入CCK-8试剂继续于37℃、5%CO2培养箱内孵育2 h。用酶联免疫检测仪,选择450 nm波长,测定各孔吸光度,记为A450。按照以下公式计算细胞增殖率:细胞增殖率(%)=(各孔测得的A450值-空白孔A450值)/(阴性对照组 A450值 -空白孔 A450值)×100%。
2.3 细胞间接免疫荧光法检测TRPC6在ASMCs上的表达 第3代细胞接种于24孔板中,在培养箱中培养24 h后,4%多聚甲醛溶液固定,室温下0.3%Triton X-100通透细胞,5% 牛血清白蛋白37℃封闭30 min后加入稀释比例为1∶100的兔抗大鼠TRPC6Ⅰ抗100μL,4℃孵育过夜。次日,于37℃复温30 min,加入稀释比例为1∶100的FITC标记的山羊抗兔的Ⅱ抗100μL,37℃避光孵育1 h,DAPI溶液室温孵育5~10 min,在荧光显微镜下观察并拍片。
2.4 Real-time PCR检测PDGF诱导ASMCs增殖时TRPC6 mRNA的表达 取第4代ASMCs接种于60 mm细胞培养皿中,待细胞生长24 h后,换用无血清的培养基继续培养24 h以使细胞同步化于G0期,再按照以下方式分组处理:(1)2.5%FBS培养基对照组;(2)20μg/L PDGF+2.5%FBS培养基组。按Trizol法提取总 RNA,按照 PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒说明书操作,合成cDNA。逆转录条件:反应条件:37℃ 15 min;85℃ 5 s。然后再按照 SYBR® Premix Ex TaqTMⅡ (Perfect Real Time)试剂盒说明书在ABI公司7500荧光定量PCR仪中进行PCR扩增反应。反应条件:95℃30 s预变性,95℃ 5 s,60℃ 34 s,重复循环40次,熔解曲线分析95℃ 15 s,60℃ 1 min,95℃ 15 s。以βactin 为内参照,2-ΔΔCt法计算各组 TRPC6 mRNA 的相对表达量。
2.5 Western blotting检测TRPC6蛋白的表达 取第4代ASMCs接种于60 mm细胞培养皿中,待细胞生长24 h后,换用无血清的培养基继续培养24 h以使细胞同步化于G0期,再按照以下方式分组处理:(1)2.5%FBS培养基对照组;(2)20μg/L PDGF+2.5%FBS培养基组。按细胞裂解液说明书提取细胞蛋白。用BCA蛋白定量试剂盒进行蛋白定量。加入SDS-PAGE蛋白上样缓冲液,置沸水煮5 min变性蛋白质;选用5% 浓缩胶,8% 分离胶进行电泳,分别用80 V和100 V电压。然后在300 mA恒流,4℃条件下电转3 h;5%脱脂奶粉室温封闭1 h;TBST洗膜3次,每次10 min;分别孵育1∶500兔抗大鼠TRPC6Ⅰ抗及1∶2 000小鼠β-actin单克隆抗体,4℃孵育过夜。TBST洗膜3次,每次10 min;再室温分别孵育与其Ⅰ抗相对应的HRP标记的羊抗兔IgG及HRP标记的羊抗小鼠IgG 1 h;TBST洗膜3次,每次10 min;加入ECL反应,用凝胶成像系统曝光成像,并用ImageJ软件对所得到的条带进行分析。以β-actin为内参照,分析各组TRPC6蛋白的相对含量。
2.6 CCK-8检测 TRPC6阻断剂对 PDGF诱导的ASMCs增殖的作用 第3~6代ASMCs接种于96孔培养板中,待细胞融合度达到50%左右时,换用无血清培养基继续培养24 h,使细胞同步化于G0期,再按照以下方式分组处理:(1)2.5%FBS培养基(无细胞)空白对照组;(2)2.5%FBS培养基阴性对照组;(3)20μg/L PDGF+2.5%FBS培养基组;(4)25μmol/L SKF96365+2.5%FBS培养基组;(5)5 μmol/L SKF96365+20 μg/L PDGF+2.5%FBS培养基组;(6)15μmol/L SKF96365+20μg/L PDGF+2.5%FBS培养基组;(7)25 μmol/L SKF96365+20μg/L PDGF+2.5%FBS培养基组。分别继续培养6 h、12 h、24 h和48 h后,每孔加入CCK-8试剂10μL,于37℃、5%CO2培养箱内孵育2 h。用酶联免疫检测仪,选择450 nm波长,测定各孔吸光度,记为A450。
3 统计学处理
实验重复3次以上,数据以均数 ±标准误(mean±SEM)表示,采用SPSS17.0统计软件分析。计量资料间的比较在确定方差齐后采用单因素方差分析(One-way ANOVA),各组间的多重比较采用LSD法;如果方差不齐则采用Welch法,组间多重比较采用Dunnett's T3检验。以P<0.05为差异有统计学意义。
结 果
1 大鼠ASMCs细胞形态学观察及鉴定
在倒置相差显微镜下观察到细胞多呈梭形,待细胞生长融合至60%左右时,可见细胞胞质透明,彼此融合生长在一起,成束的细胞平行排列,呈现平滑肌细胞特征性的“峰-谷”状生长,见图1A。细胞内α-SMA免疫荧光检测可见:胞浆内可见大量绿色荧光,α-SMA与细胞长轴平行排列,呈网状或丝状,见图1B。采用Image-Pro Plus 6.0软件进行计数分析,得到的细胞纯度在94%左右。
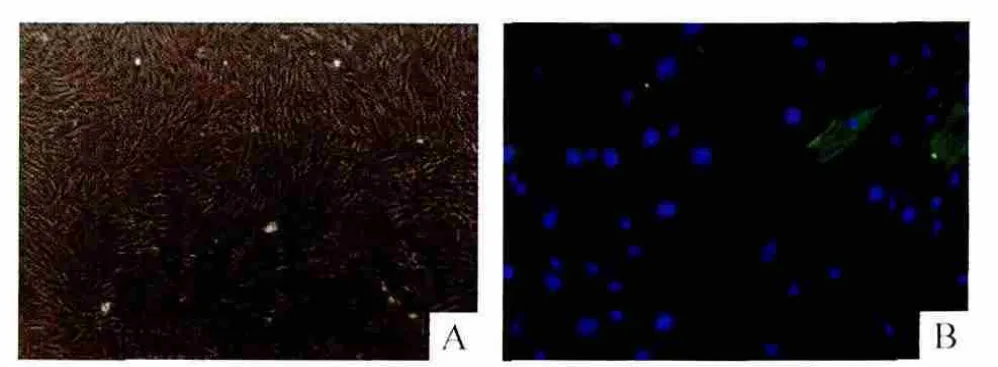
Figure 1.Identification of rat ASMCs.A:morphology of the cells(×100);B:immunofluorescence staining(×200)for α-SMA (green), with DAPI-stained nuclei(blue).图1 大鼠ASMCs的鉴定
2 PDGF诱导大鼠ASMCs增殖
PDGF作用6 h后,PDGF组ASMCs的活力与阴性对照组相比差异无统计学意义(P>0.05);PDGF作用12 h后,ASMCs的活力与阴性对照组相比显著升高(P<0.05);作用24 h和48 h后,ASMCs的活力与阴性对照组相比亦显著升高(P<0.01),见图2。

Figure 2.Proliferation of ASMCs induced by PDGF.Mean ±SEM.n=6.*P < 0.05,**P < 0.01 vs negative control.图2 PDGF诱导ASMCs增殖
3 TRPC6在大鼠ASMCs上的表达
用兔抗大鼠TRPC6抗体进行间接免疫荧光检测,在荧光显微镜下观察到 TRPC6广泛表达于ASMCs,见图 3。
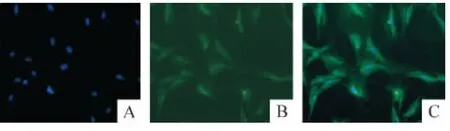
Figure 3.The expression of TRPC6 in ASMCs(FITC-immunofluorescence staining,×200).A:DAPI;B:FITC;C:merged.图3 TRPC6在ASMCs的表达
4 ASMCs TRPC6 mRNA表达
PDGF作用12 h后TRPC6 mRNA表达明显增加(P <0.05),24 h和48 h升高更明显(P <0.01),见图4。
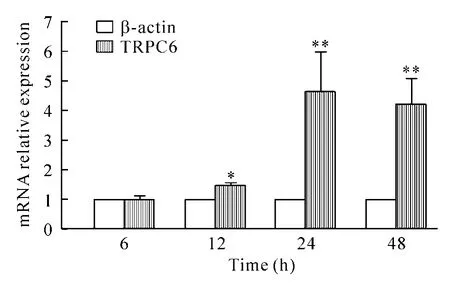
Figure 4.The mRNA expression of TRPC6 in ASMCs.β-actin served as internal reference.Mean ± SEM.n=4.*P <0.05,**P <0.01 vsβ-actin.图4 ASMCs TRPC6 mRNA的表达
5 ASMCs TRPC6蛋白的表达
PDGF作用6 h和12 h后,TRPC6蛋白表达较对照组稍升高,但差异无统计学意义(P>0.05);PDGF作用24 h和48 h后,TRPC6蛋白表达量与相应对照组相比明显增多(P<0.05),见图5。
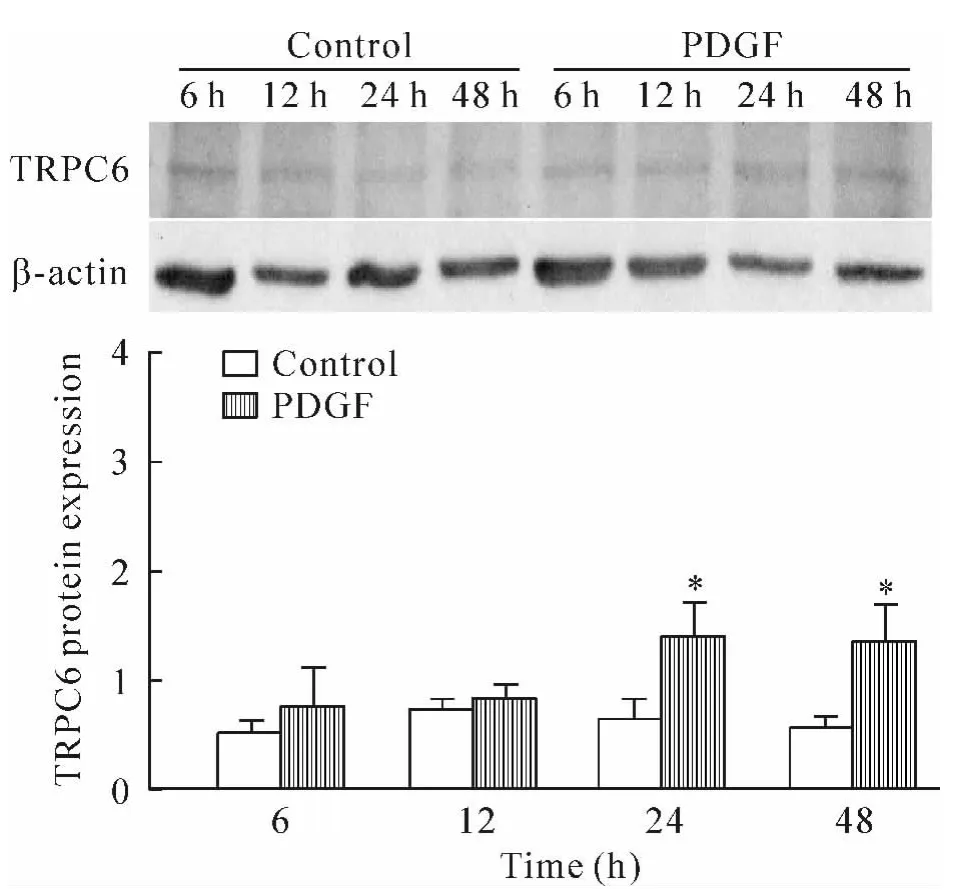
Figure 5.The protein expression of TRPC6 in ASMCs.Mean ±SEM.n=4.*P <0.05 vs control group.图5 ASMCs TRPC6蛋白的表达
6 SKF96365对PDGF诱导的大鼠ASMCs增殖的作用
所有组在处理6 h和12 h时ASMCs未出现明显增殖,各组间的差异无统计学意义(P>0.05);15 μmol/L和25μmol/L SKF96365与PDGF共同作用组在作用24 h和48 h时才显著抑制了PDGF诱导的ASMCs增殖(与 PDGF 组相比,P <0.01),而 5 μmol/L SKF96365只在作用48 h时显著抑制了ASMCs的增殖(与 PDGF组相比,P<0.01);25 μmol/L SKF96365单独作用于ASMCs时对其增殖无明显作用,见表2。
讨 论
支气管哮喘是一种由多种细胞及细胞组分参与的慢性气道炎症性疾病,是严重危害人类健康的常见病。虽然积极正规的抗炎和平喘治疗能够较好地控制症状发作,却不能彻底根治哮喘。随着病程的不断进展,哮喘患者还是会出现不同程度的气道重塑,最终发展为不可逆的气流阻塞。气道重塑是指哮喘时气道壁的结构发生的一系列改变,包括气道壁增厚、气道纤维化、平滑肌细胞增生和肥大、上皮下纤维化及血管分布增多等。气道重塑几乎在所有哮喘患者的活检标本中都可被检测到,其与哮喘患者的预后关系密切。因而,研究气道重塑的机制已成为哮喘防治的重点。气道平滑肌细胞作为气道管壁结构的主要构成细胞,是参与气道重塑的关键性效应细胞。在气道重塑的过程中,ASMCs的过度增殖不仅会加重气道高反应性,而且还会使气道壁增厚变形,出现不可逆转的气道重塑;此外在增殖中,气道平滑肌细胞还能由收缩型变成合成型,通过表达黏附分子,释放细胞因子并产生基质成分和蛋白酶来促进和加重气道重塑[3-4]。2007 年,Cox 等[5]报道利用支气管热成形术对哮喘患者进行治疗,消减患者的部分支气管平滑肌,随访1年后发现这些患者的哮喘症状得到明显的控制。这提示我们气道平滑肌可以作为治疗哮喘的重要靶点,有效抑制气道平滑肌细胞的增殖可以改善哮喘症状,因此,研究哮喘气道重塑时ASMCs增殖的机制具有十分重要的意义。
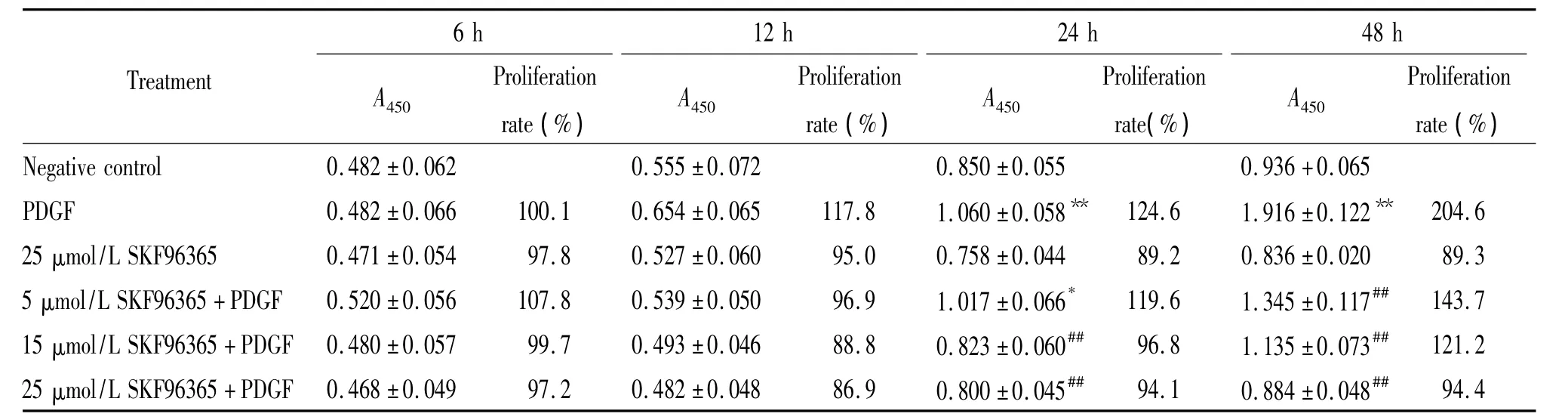
表2 SKF96365对PDGF诱导ASMCs增殖的作用Table 2.The influence of SKF96365 on the proliferation of ASMCs induced by PDGF(Mean±SEM.n=12)
Ca2+作为一个重要的第二信使涉及一系列细胞功能,例如受精、增殖、生长、学习和记忆、细胞迁移、收缩和分泌、免疫防御及细胞凋亡等[6]。几乎所有细胞被生长因子、激素和有丝分裂原刺激后都会激活磷脂酶 C(phospholipase C,PLC),水解 4,5-二磷酸磷脂酰肌醇产生三磷酸肌醇(inositol triphosphate,IP3)和二脂酰甘油(diacylglycerol,DAG)。IP3与其在内质网上的受体结合引起钙离子的释放,即受体操纵性 Ca2+内流(receptor-operated Ca2+entry,ROCE),这个过程还伴随着跨细胞膜的钙内流[7],被命名为钙库操纵性Ca2+内流(store-operated Ca2+entry,SOCE)。其确切激活机制及涉及的通道尚需更多研究确认。目前已明确的是钙库耗竭就能引起SOCE,在没有IP3生成的情况下,肌浆网或内质网上Ca2+泵的抑制剂毒萝卜素可以通过耗竭钙库引起钙内流。但是其它钙离子通道是通过下游的PLC激活,而与钙库耗竭没有直接关系[8]。哺乳动物TRP超家族成员被认为在许多细胞内组成PLC依赖性钙离子内流通路[9-12]。
PDGF作为重要的促有丝分裂原,与哮喘气道重塑关系密切。PDGF主要由巨核细胞合成,其它如内皮细胞、血管平滑肌细胞、单核细胞和成纤维细胞等亦可产生。它能作用于成纤维细胞,促进其增殖,也能引起包括气道平滑肌细胞、血管平滑肌细胞和视网膜上皮细胞等多种细胞的增殖。它通过与靶细胞膜上的PDGF受体结合,刺激多条信号通道:PLC通路,进而通过Ca2+调节控制一系列的生理过程;PDGF可以增加花生四烯酸和前列腺素的合成和提高cAMP水平,导致DNA合成增加和细胞增殖。此外,PDGF还可以诱导一些与增殖有关的原癌基因的表达,例如 c-fos和 c-myc等[13]。PDGF还可以引起气道平滑肌细胞表型的改变,促进气道重塑的发生。
本课题组在前期系列实验中建立了PDGF诱导气道平滑肌细胞增殖的模型,在本实验中我们用20 μg/L PDGF成功诱导了ASMCs增殖,并确认了TRPC6在ASMCs上有广泛表达,可能主要存在于细胞浆。在此基础上,我们的实验结果显示PDGF作用后TRPC6 mRNA和蛋白在ASMCs的表达明显增加。这一结果与Yu等[2]在大鼠肺血管平滑肌上的研究结果一致,他们用PDGF诱导原代培养的大鼠肺血管平滑肌增殖,检测到PDGF上调了TRPC6 mRNA和蛋白的表达,进一步用针对TRPC6设计的寡核苷酸链抑制TRPC6的表达后PDGF介导的肺血管平滑肌的增殖明显被抑制,从而证明 TRPC6参与了PDGF诱导肺血管平滑肌细胞增殖的过程。本实验发现PDGF作用后,被认为参与构成ROCs的TRPC6的表达明显增加,这说明ROCE有可能参与PDGF诱导的大鼠ASMCs增殖。Mukherjee等[14]发现 PDGF作用在肺成纤维细胞上,通过IP3引发的钙离子释放引起胞浆内钙离子浓度的升高,这个过程中生成的DAG可直接激活TRPC6,所以推测TRPC6可能在PDGF诱导ASMCs的增殖中发挥了重要作用。
为了进一步证实这个推论,我们用不同剂量的TRPC6阻断剂与PDGF共同作用于ASMCs后,检测PDGF诱导ASMCs增殖的作用是否发生改变。实验结果显示:25μmol/L的TRPC6阻断剂SKF96365单独作用于ASMCs时未对ASMCs的增殖产生影响,但与PDGF共同处理细胞时,15μmol/L和25μmol/L SKF96365在24 h和48 h显著降低了PDGF诱导的ASMCs增殖,5μmol/L SKF96365亦在作用48 h时显著抑制了ASMCs的增殖。SKF96365作为TRPC阻 断 剂,可 影 响 细 胞 内 钙 离 子 的 浓 度[2,15]。SKF96365阻断了TRPC,使胞浆内钙离子浓度降低,从而导致增殖抑制,这提示TRPC6参与了PDGF诱导的气道平滑肌细胞增殖过程。
本研究结果表明,PDGF上调TRPC6的表达,TRPC6阻断剂SKF96365可引起PDGF诱导的ASMCs增殖减弱,提示 TRPC6参与了 PDGF诱导ASMCs增殖的过程,且这种过程可能与其影响胞浆内钙离子浓度有关。尚需深入研究以进一步明确TRPC6参与PDGF诱导的ASMCs增殖与胞浆内钙离子浓度这两者之间的关系。
