左旋门冬酰胺酶与盐霉素联合作用对急性T淋巴细胞白血病Jurkat细胞株增殖凋亡的影响*
2013-12-01朱锦灿陈小宇刘成成祝爱珍刘革修曾慧兰
朱锦灿, 陈小宇, 刘成成, 祝爱珍, 刘革修, 曾慧兰
(暨南大学1附属第一医院血液科,2医学院血液病研究所,广东广州510632)
近年来,急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)的治疗虽然有了较多的进展,出现了多种诱导缓解方案,包括经典的诱导方案:糖皮质激素、长春新碱及门冬酰胺酶,在儿童中治愈率接近90%,但是在成人中仅仅为40%[1]。所以,进一步研究提高疗效、减少耐药的治疗方案具有临床意义。
左旋门冬酰胺酶(L-asparaginase,L-ASP)是治疗急性淋巴细胞白血病以及非霍奇金淋巴瘤的常用药。它能水解门冬酰胺,使肿瘤细胞缺乏其生长必要的、但又不能自身合成的氨基酸——门冬酰胺,从而起到抑制肿瘤细胞生长的作用[2],并且有研究发现L-ASP还能诱导细胞凋亡[3-4]。盐霉素(salinomycin,Sal)是一种能杀死癌症干细胞的一元羧酸聚醚类抗生素[5],能高效杀灭小鼠乳腺癌细胞[6]和慢性淋巴细胞性白血病细胞[7],并且能起到克服耐药的作用[8]。本研究通过观察左旋门冬酰胺酶与盐霉素联合作用对急性T淋巴细胞白血病Jurkat细胞株增殖和凋亡的影响及其机制,为临床急性T淋巴细胞白血病治疗研究提供基础依据。
材料和方法
1 材料
RPMI-1640培养液和胎牛血清购自Gibco;CCK-8试剂盒购自碧云天生物技术有限公司;L-ASP购自常州千红生化制药股份公司(每支10 000 U);盐霉素和PI染料购自Sigma;Fluo-3AM荧光染料购自Biotium;Epics XL型流式细胞仪购自Beckman Coulter。人白血病细胞株Jurkat由本实验室保存。
2 方法
2.1 CCK-8法检测细胞增殖活性 Jurkat细胞接种于含10%胎牛血清的RPMI-1640培养基中,于37℃、5%CO2、饱和湿度培养箱中培养,约3 d传代1次。取对数生长期Jurkat细胞,以5×108/L接种于96孔板中,置于培养箱培养24 h,接着分别做如下处理:(1)加入 Sal(0.1、0.2、0.4、0.8、1.6、3.2 mmol/L);(2)加入 L-ASP(1、2.5、10、25 IU/L);(3)加入 Sal(0.1、0.2、0.4、0.8、1.6、3.2 mmol/L),LASP(2.5 IU/L)联合。每个浓度设5个复孔。同时设空白对照组、仅含有DMSO作对照组。孵育48 h后,每孔加入CCK-8 10μL,37℃继续培养2 h,在酶标仪450 nm处读取吸光度(A)值,并按以下公式计算细胞生长抑制率:抑制率(%)=(对照孔A值-实验孔A值)/对照孔A值×100%。重复3次。采用直线回归方法计算药物的半数抑制浓度(IC50),并描绘细胞生长曲线。
2.2 盐霉素和左旋门冬酰胺酶联合作用计算 根据Chou-Talalay联用指数法判定2种药物的联合作用。按中效方程式计算出不同抑制率时两药单用和联用浓度,计算公式如下:D=Dm[fa/(1-fa)]1/m(D:药物浓度;Dm:中效浓度;fa:细胞增殖抑制率;m:斜率)。2种药物的联用指数(combination index,CI)计算公式:CI=(D)1/(Dx)1+(D)2/(Dx)2+a(D)1(D)2/(Dx)1(Dx)2;其中(Dx)1和(Dx)2分别指2种药物单用时产生某一效应值fa时的浓度;(D)1和(D)2指2种药物联用时产生相同效应fa时各自所需要的浓度。当2种药物的相互作用为非排斥性时,a=1;当2种药物的相互作用为排斥性时,a=0。求出CI值,当CI<1时,表示两药物联用为协同作用;CI=1时,表示两药联用为相加作用;CI>1,表示两药联用为拮抗作用。
2.3 细胞凋亡检测 Annexin V-PI双染观察经不同处理后的Jurkat细胞凋亡情况。取对数生长的Jurkat细胞,以2×105cells/well的密度接种于6孔板。设Sal(0.5μmol/L)单独处理组L-ASP(2.5 IU/L)单独处理组、Sal(0.5 μmol/L)与 L-ASP(2.5 IU/L)联合处理组以及DMSO对照组,作用48 h后,消化收集细胞,调整待测细胞浓度为5×108~1×109cells/L,PBS洗涤3次,弃上清,加入200μL试剂盒提供的结合缓冲液,重悬细胞后,加入10μL Annexin V-FITC和5μL PI,轻轻混匀,避光4℃反应30 min,加入300μL结合缓冲液,在1 h内上机检测。
2.4 Western blotting检测 将 Sal(0.5 μmol/L)、L-ASP(2.5 IU/L)单用及联合使用处理Jurkat细胞48 h后,收集并PBS洗2遍,加入蛋白抽提液抽提总蛋白。经10%SDS-PAGE电泳分离后,常规转移至PVDF膜,用含5%脱脂牛奶的 TBST封闭液(20 mmol/L Tris pH 7.6,0.1%Tween-20)封闭过夜。加入鼠抗人细胞色素C抗体、Bcl-2抗体、caspase-3抗体、caspase-8抗体、caspase-9抗体和 β-actin抗体,4℃过夜,1∶2 000稀释的HRP标记的Ⅱ抗室温孵育1 h,用TBST洗3次,ECL显色液显色。
3 统计学处理
采用SPSS 13.0统计软件处理,计量资料以均数±标准差(mean±SD)表示,各组间比较采用单因素方差分析(ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 盐霉素与L-ASP单独及联合作用对Jurkat细胞增殖的抑制作用
CCK-8结果显示,不同浓度的L-ASP及Sal单独处理Jurkat细胞均显现出抑制增殖的作用,与Sal联合L-ASP使用时的抑制率比较差异有统计学意义(P<0.05),且在一定浓度范围内呈现剂量依赖性,见图 1。Sal的 IC50为(0.75 ±0.07)μmol/L,而L-ASP的 IC50为(8.12 ±0.24)IU/L。
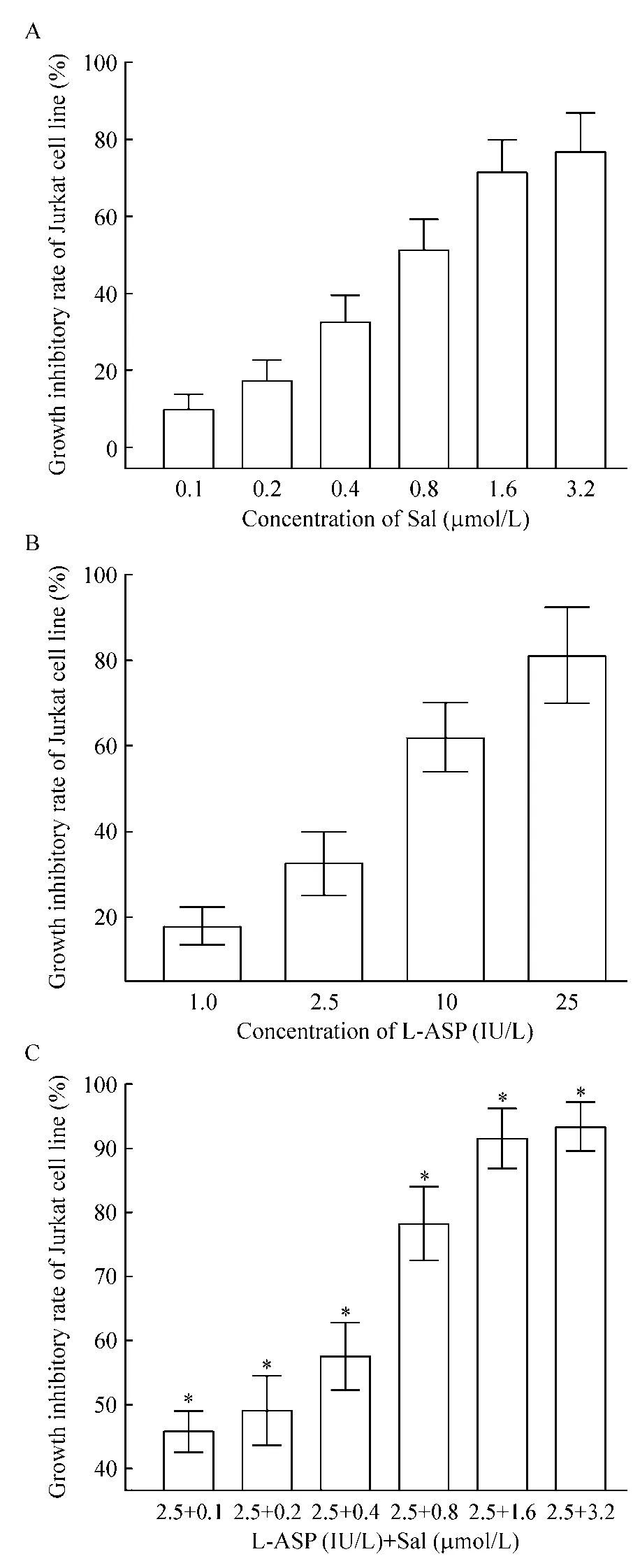
Figure 1.Growth inhibitory rates of Jurkat cell line treated with Sal and L-ASP at different concentrations,alone or in combination.A:Sal;B:L-ASP;C:L-ASP+Sal.Mean±SD.n=3.*P <0.05 vs the same concentration of Sal alone in A.图1 不同浓度盐霉素与L-ASP单用或联合使用对Jurkat细胞生长抑制率
2 联合作用效果计算
经合用指数计算公式计算,显示L-ASP和盐霉素合用在不同效应(0.90、0.80、0.75、0.70、0.65、0.60、0.50 和 0.40)时的 CI分别为 0.512、0.535、0.561、0.673、0.767、0.879、0.947 和 0.952,即当 fa为 0.90、0.80、0.75、0.65、0.60、0.50 和 0.40 时两药为协同作用。
3 Annexin V-PI双标记检测Jurkat细胞凋亡
Sal(0.5 μmol/L)或 L-ASP(2.5 IU/L)单独作用Jurkat细胞48 h后,细胞凋亡率分别为(25.43±0.47)%和(7.11±0.23)%,Sal组凋亡率显著高于DMSO 对照组[(6.67±0.13)%],差异有统计学意义(P <0.05);而 Sal(0.5 μmol/L)和 L-ASP(2.5 IU/L)联合作用 Jurkat细胞的凋亡率为(39.12±1.97)%,高于两药单独处理组,差异有统计学意义(P <0.05),见图2。

Figure 2.Effects of salinomycin and L-ASPalone or in combination on apoptosis of Jurkat cells.Mean ±SD.n=3.*P <0.05 vs control;#P <0.05 vs Sal+L-ASP.图2 盐霉素与L-ASP单独作用及联合作用对Jurkat细胞凋亡的影响
4 Sal与L-ASP单独及联合作用对Jurkat细胞Bcl-2、胞浆细胞色素 C、caspase-3、caspase-8 或caspase-9蛋白表达水平的影响
Sal(0.5μmol/L)单独作用 Jurkat细胞,Bcl-2表达下调,胞浆细胞色素C显著增加,caspase-3和caspase-9蛋白水平均明显增加;L-ASP(2.5 IU/L)单独作用 Jurkat细胞,Bcl-2、caspase-3、caspase-8和caspase-9蛋白水平无明显变化,胞浆细胞色素C增加量少;Sal与L-ASP联合作用,则Bcl-2蛋白水平进一步下降,而且胞浆细胞色素 C上升更高,caspase-3、caspase-8和caspase-9蛋白水平表达显著增加,见图3。
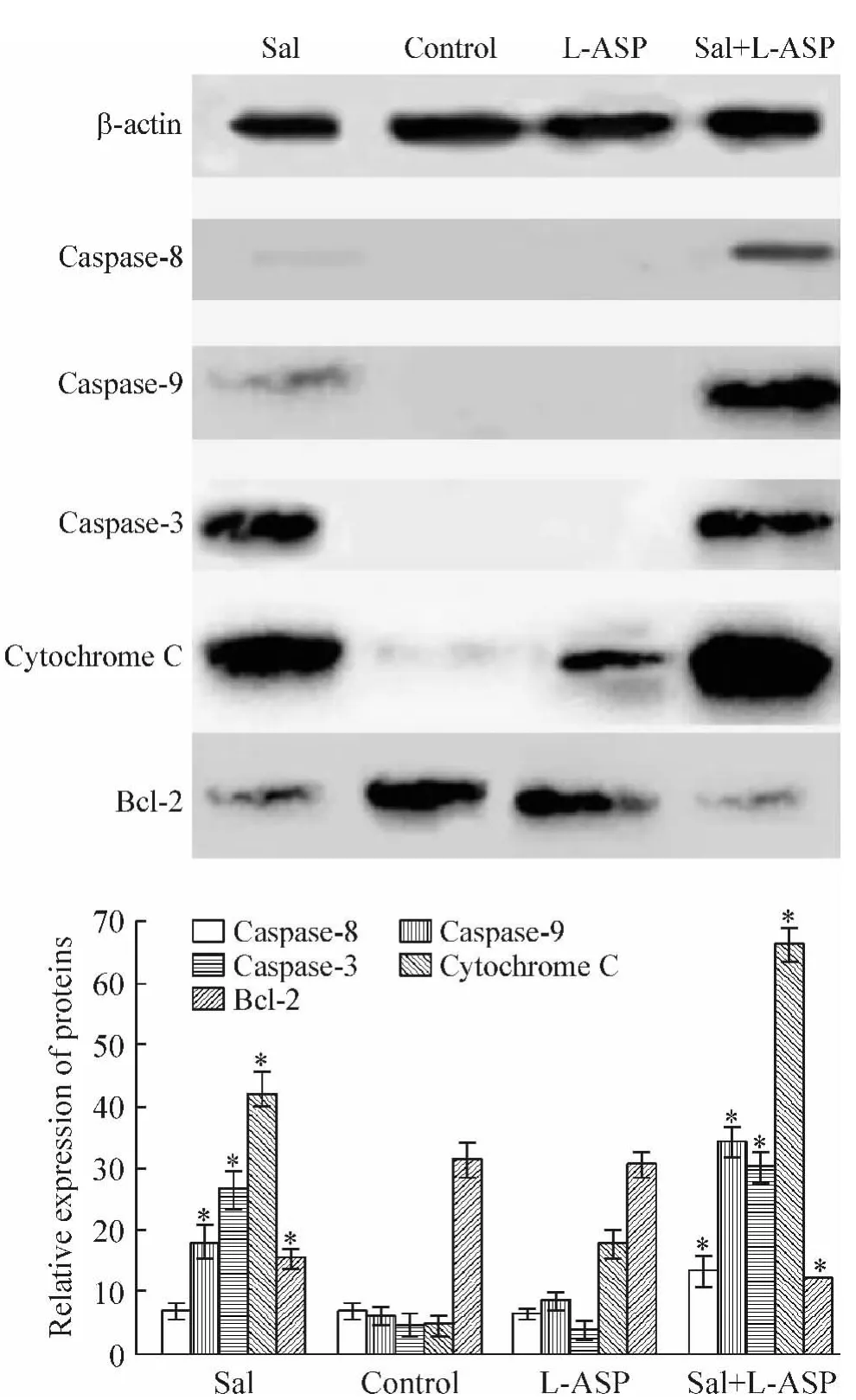
Figure 3.Effects of salinomycin and L-ASPalone or in combination on expression of caspase-3,caspase-8,caspase-9,Bcl-2 and cytochrome C in Jurkat cells.Mean ± SD.n=3.*P <0.05 vs control.图3 Sal与L-ASP单独作用及联合作用对Jurkat细胞中caspase-3、caspase-8、caspase-9、Bcl-2 和细胞色素 C 总蛋白水平的影响
讨 论
本研究发现,盐霉素与左旋门冬酰胺酶两者联合使用时,能起到协同作用的效果,盐霉素不仅增强左旋门冬酰胺酶对 Jurkat细胞增殖的抑制作用,而且显著诱导细胞凋亡。盐霉素提高左旋门冬酰胺酶诱导Jurkat细胞凋亡的作用与左旋门冬酰胺酶及盐霉素的药理学作用有关。左旋门冬酰胺酶作为一种有效的抗肿瘤细胞蛋白质合成抑制剂,在治疗恶性淋巴系统肿瘤,特别是低危B细胞ALL、T细胞ALL和高危淋巴瘤作用显著。恶性淋巴系统肿瘤细胞生长需要L-门冬酰胺,然而其不能自身合成。左旋门冬酰胺酶主要通过催化血液中的门冬酰胺水解为门冬氨酸和氨,快速降低血浆中L-门冬酰胺的含量,导致L-门冬酰胺缺乏,从而选择性杀灭白血病细胞[9]。盐霉素是一种聚醚类脂溶性离子载体抗生素,主要用于防治白色链霉菌引起的鸡球虫病。当前有报道称其不仅能有效抑制、杀死小鼠体内的人乳腺癌成体肿瘤细胞而且还能高效抑制其肿瘤干细胞,而且抑制乳腺癌干细胞的效力比普通抗癌药物泰克索高100倍[10]。盐霉素还能增强肿瘤细胞对细胞生长抑制剂的敏感性,例如阿霉素[11],且可通过激活特异的凋亡通路逆转由ABC转运蛋白介导的急性髓系白血病化疗耐药[4]等能力。它对细胞中的阳离子,特别是K+、Na+、Ca2+和Rb+的亲和力特别强,增强阳离子通过细胞膜上脂质屏障的能力,同时能妨碍细胞内外阳离子的传递,达到改变细胞内外离子浓度,从而影响细胞内生命活动,还可以诱导氧化应激和线粒体凋亡途径[7,12-13]。盐霉素通过提高细胞内Na+浓度,接着通过细胞内外Ca2+与Na+的交换,提高细胞内Ca2+的浓度。提高细胞内Ca2+浓度可激活Ca2+依赖性蛋白酶的活性,从而激活caspase-12,接着激活其下游的caspase-9及caspase-3的活性。盐霉素还通过促进线粒体细胞色素 C释放,使caspase-9酶激活,通过线粒体凋亡途径加强L-ASP对Jurkat细胞的诱导凋亡作用。本研究显示盐霉素通过改变胞浆细胞色素C、caspase-3、8和9活性,增强左旋门冬酰胺酶对Jurkat细胞的作用。该结果与文献报道的盐霉素机制一致。
综上所述,左旋门冬酰胺酶与盐霉素联合作用于Jurkat细胞具有协同抑制增殖和诱导凋亡的作用。本研究结果为今后临床急性T淋巴细胞白血病治疗研究提供基础依据。在以后的实验中,我们将继续研究其能否减少ALL病人对左旋门冬酰胺酶的耐药性。
