红细胞生成素对慢性肾衰竭大鼠外周血内皮祖细胞SDF-1及其受体表达的影响*
2013-12-01万建新李镇洲邹臻寰尤丹瑜
万建新, 崔 炯, 高 娜, 杨 霞, 李镇洲, 陈 俊, 邹臻寰, 尤丹瑜
(福建医科大学附属第一医院肾内科,福建福州350005)
血管内皮祖细胞(endothelial progenitor cells,EPCs)是成熟血管内皮细胞的前体细胞。我们前期的研究表明红细胞生成素(erythropoietin,EPO)能促进5/6肾大部切除大鼠外周血EPCs的动员和增殖,改善外周血EPCs黏附能力和形成血管腔样结构的能力,促进肾小球毛细血管内皮功能的修复、减轻肾脏的病理改变和改善肾功能[1-2]。但外周血EPCs如何被动员的确切机制尚不清楚。有研究表明EPO可显著提高健康人群和肾衰竭患者EPCs的数量与功能,并可能与提高EPCs中Akt蛋白激酶的活性有关[3]。最近我们的研究表明EPO可激活5/6肾大部切除大鼠残肾组织归巢因子及其受体的表达,这可能也是EPCs参与损伤肾脏修复的重要机制之一[4]。本文观察EPO干预慢性肾衰竭(chronic renal failure,CRF)大鼠后,外周血EPCs归巢因子——基质细胞衍生因子1(stromal cell-derived factor 1,SDF-1)及其受体CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)的表达是否受到影响。
材料和方法
1 材料
1.1 动物 成年雄性6周龄SD大鼠(体重200~250 g),购自吴氏动物中心(编号为2007000521321)。
1.2 主要试剂 M199培养基和胎牛血清(Gibco),血管内皮生长因子(vascular epithelial growth factor,VEGF;PeproTech),重组牛碱性成纤维细胞生长因子(珠海亿胜生物制药),人纤维连接蛋白(Chemicon),FITC标记的荆豆凝集素1(Ulex europaeus agglutinin 1,UEA1;Sigma),DiI标记乙酰化低密度脂蛋白(acetylated DiI-labeled low density lipoproteins,acLDL-DiI;Molecular Probe),人重组EPO(益比奥,三生制药),PE标记的血管内皮生长因子受体2(vascular epithelial growth factor receptor 2,VEGFR2;R&D),PE标记的CD133单克隆抗体(BD),PE标记的CD34单克隆抗体(Miltenyi Biotec),FITC标记的抗大鼠Ⅱ抗(北京中山),Trizol(Invitrogen),PCR试剂盒(TaKaRa),EPO抗体(Santa Cruz),红细胞生成素受体(erythropoietin receptor,EPOR)抗体(Santa Cruz),SDF-1α抗体和CXCR4抗体(Abcam)。
2 方法
2.1 动物模型制备及分组 采用分阶段5/6肾切除制备大鼠慢性肾衰竭模型:10%水合氯醛腹腔麻醉后,经侧腹部切口,暴露左侧肾脏,分离肾动脉及其分支,结扎其中的左上支和中支并剪断,使左肾梗死约2/3,3 d后再将大鼠右肾摘除。21只SD大鼠随机分为3组(每组7只):假手术组、CRF模型组和EPO治疗组。假手术组仅分离肾动脉及其分支,不予结扎;EPO治疗组于第2次手术后3周开始皮下注射30 U/kg EPO,每周3次,连用6周。所有大鼠均于造模后8周处死。
2.2 外周血EPCs分离、培养与鉴定 SD大鼠处死后心脏采血5 mL,采用Ficoll密度梯度离心法分离出单核细胞,并进行细胞培养。EPCs鉴定采用DiIAcLDL和FITC-UEA1双荧光染色法。EPCs培养和鉴定的方法参见本课题组前期工作[1]。
2.3 实时荧光定量PCR 各组大鼠外周血EPCs总RNA的提取和cDNA的合成按试剂盒的说明书进行。所用的引物序列及扩增长度见表1(由TaKaRa公司协助设计并合成)。定量扩增用 ABI PRISM 7500 Fast荧光PCR仪,采用SYBR Green PCR方法进行。PCR反应条件为:95℃预变性30 s,95℃ 5 s,60℃ 30 s,72 ℃ 30 s,共30个循环。反应结束后确认PCR扩增曲线和融解曲线。以GAPDH为内参照,采用比较Ct法相对定量,结果以两组间目的基因拷贝数比值(relative quantification,RQ)表示。每个cDNA模板标本重复检测3次,结果取平均值,每次反应3个基因各设阴性空白对照1个。
2.4 Western blotting检测 各组大鼠外周血EPCs用裂解缓冲液处理,按Bradford蛋白定量试剂盒说明书测定蛋白含量。并按经典方法配制10%SDSPAGE分离胶和5%浓缩胶进行蛋白电泳。将电泳的凝胶以相同大小的NC膜进行转膜。将封闭好的NC膜分别放入用封闭液稀释的Ⅰ抗中孵育,用增强化学发光使胶片显影,扫描后用 White/Ultraviolet Transilluminator系统软件分析,蛋白表达量用积分吸光度(integrated absorbance,IA)值来表示。以β-actin为内参照,进行半定量分析,比值表示其相对含量。
3 统计学处理
数据用均数±标准差(mean±SD)表示,经方差齐性检验和组内的方差分析。用 SPSS 15.0统计软件包分析,以P<0.05为差异有统计学意义。

表1 引物序列Table 1.Sequences of the primers
结 果
1 EPO对外周血EPCs归巢因子及其受体表达影响
实时荧光定量PCR结果显示,与CRF组比较,治疗组外周血EPCs SDF-1和CXCR4 mRNA表达显著增高(均P <0.05),见图1。Western blotting结果显示,与模型组比较,治疗组外周血EPCs SDF-1和CXCR4蛋白表达显著增高(均P<0.05),见图2。
2 EPO对外周血EPCs EPO及EPOR的影响
实时荧光定量PCR结果显示,与CRF组比较,治疗组外周血EPCs EPO及EPOR mRNA表达显著增高(均 P <0.05),见图 3。Western blotting结果显示,与模型组比较,治疗组外周血 EPCs EPO及EPOR蛋白表达显著增高(均P<0.05),见图4。
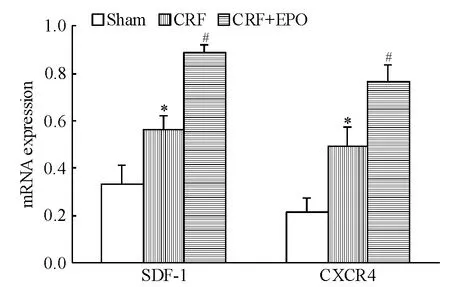
Figure 1.Effects of EPOon mRNA expression of SDF-1 and CXCR4 in peripheral blood endothelial progenitor cells from rats.Mean ± SD.n=7.*P < 0.05 vs sham group;#P <0.05 vs CRF group.图1 SDF-1和CXCR4 mRNA在各组大鼠外周血EPCs中的表达
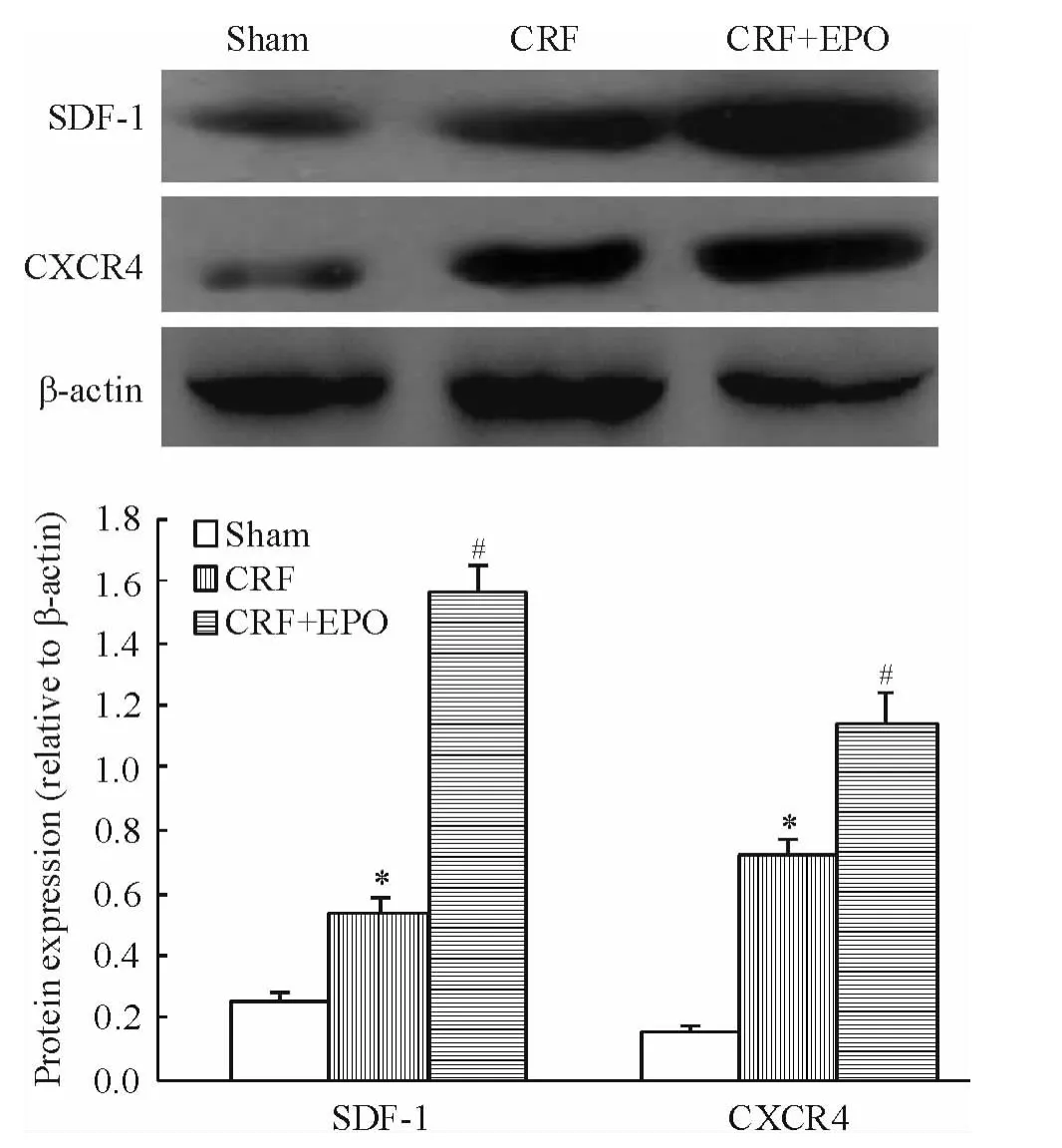
Figure 2.Effects of EPOon protein expression of SDF-1 and CXCR4 in peripheral blood endothelial progenitor cells from rats.Mean ± SD.n=7.*P < 0.05 vs sham group;#P <0.05 vs CRF group.图2 SDF-1和CXCR4蛋白在各组大鼠外周血EPCs中的表达
讨 论
EPCs是成熟血管内皮细胞的前体细胞,起源于骨髓的原始细胞。骨髓中的EPCs增殖后进入血液循环,参与血管新生和器官修复。近年的研究发现,刺激骨髓动员EPCs,使循环EPCs数量增加,可能是促进慢性肾脏病修复的一种有效手段[5-6]。EPCs通过自身分化、增殖而形成的新生血管不受原有血管内皮细胞功能的影响,且受损的内皮层可由循环EPCs重生。这一现象为EPCs在肾缺血、缺氧导致进行性肾损害中的治疗作用提供了新的理论依据。慢性肾衰竭患者体内EPCs数量、迁移和融合能力都有所下降[7-8]。外周血 EPCs数量主要决定于骨髓中EPCs的动员,在EPCs动员过程中,EPO是一个重要的细胞因子[9]。但EPCs的动员过程有哪些因素参与目前尚不清楚。
近年的研究表明靶组织中某些与归巢相关的因子表达上调与EPCs的动员与归巢有关[10]。SDF-1是CXC趋化因子家族成员,CXCR4是其特异性受体。有研究表明CXCR4在EPCs表面高度表达[5]。SDF-1通过与 CXCR4结合,促进 CD34+造血干/祖细胞逆SDF-1浓度梯度移行和增殖,抑制CD34+造血干/祖细胞凋亡,诱导新生血管形成[11]。SDF-1还能促进内皮细胞和EPCs的存活与增殖,诱导EPCs的定向迁移并参与新血管形成[12-14]。Yin等[15]发现在动脉损伤后,SDF-1可作为独立因素动员和归巢EPCs参与损伤血管的再内皮化。Kuliszewski等[16]发现在应用通过超声破坏微泡技术联合SDF-1基因质粒转染治疗肌肉缺血动物模型后,移植的EPCs能特异归巢到SDF-1表达的损伤组织。国内近年的研究发现中药当归补血汤可能通过提高循环VEGF和SDF-1水平来促进兔动脉粥样硬化模型外周血EPCs的活性[17]。
近年的研究发现EPOR广泛表达于许多非造血组织细胞中[18]。EPO本身就是一种低氧诱导因子,在低氧和红细胞生成素的协同作用下可诱导EPOR的表达[19]。Lin 等[20]研究证实在低氧条件下,EPO/EPOR可通过增强SDF-1表达,加强干/祖细胞的动员。
综上所述,我们的研究初步表明EPO对慢性肾衰竭大鼠外周血EPCs的动员可能与其上调外周血内皮祖细胞SDF-1及其受体表达有关。
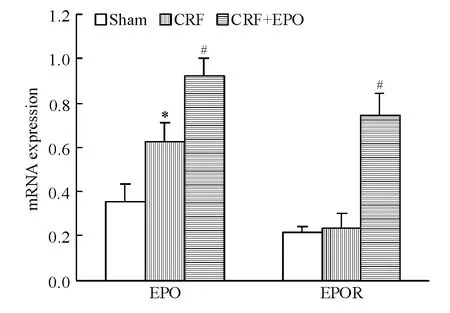
Figure 3.Effects of EPO on mRNA expression of EPO and EPOR in peripheral blood endothelial progenitor cells from rats.Mean ± SD.n=7.*P < 0.05 vs sham group;#P <0.05 vs CRF group.图3 EPO和EPOR mRNA在各组大鼠外周血EPCs中的表达
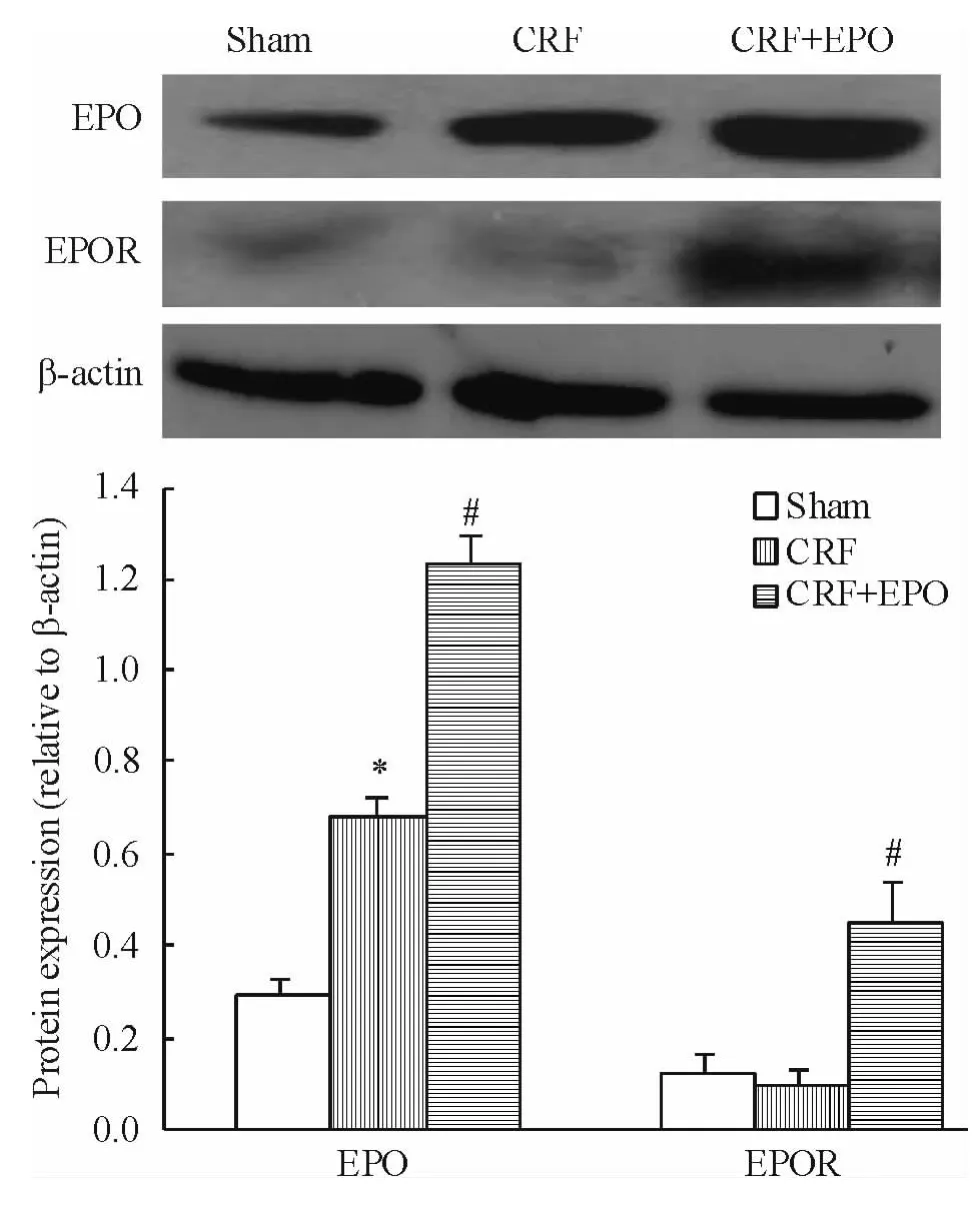
Figure 4.Effects of EPO on protein expression of EPO and EPOR in peripheral blood endothelial progenitor cells from rats.Mean ± SD.n=7.*P < 0.05 vs sham group;#P <0.05 vs CRF group.图4 EPO和EPOR蛋白在各组大鼠外周血EPCs中的表达
