葛根素注射液对糖尿病KKAy小鼠肾小管上皮细胞的影响*
2013-12-01易月娥聂彦娜李姝玉李玉杰柴欣楼贾德贤
易月娥, 聂彦娜, 李姝玉, 李玉杰, 柴欣楼, 贾德贤, 王 谦△
(1北京中医药大学,北京100029;2山东大学医学院,山东济南250012)
糖尿病肾病是糖尿病最典型的微血管并发症之一,属中医学“消渴病”继发的“水肿”、“关格”等病证的范畴,已成为糖尿病患者致死的主要原因。糖尿病肾病的进展过程中炎症和纤维化是很重要的一个病理改变,主要包括肾小球和肾小管的炎症和纤维化,而肾小管的病变出现在肾小球病变之前,且对于疾病预后更具有指导意义[1]。在肾小管上皮细胞慢性病变过程中,肾小管上皮-间质转化(epithelialmesenchymal transition,EMT)是炎症和纤维化的关键机制[2-3],即肾小管上皮细胞激活后成为具有分泌和收缩能力的肌成纤维细胞(myofibroblast,MyoF)。MyoF分泌胶原的能力是成纤维细胞4~5倍,大量细胞外基质的生成和累积,导致肾间质纤维化的发生。而转化生长因子 β1(transforming growth factor β1,TGF-β1)是最常见的诱导肾小管上皮细胞发生EMT的细胞因子之一[4-6],它与转分化标志物 α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)的表达呈正相关。因此,我们通过观察葛根素注射液对KKAy糖尿病小鼠肾间质纤维化的治疗过程中TGF-β1、转化生长因子 βI型受体(transforming growth factor β type I receptor,TGF-β-RI)和 α-SMA表达的影响,探讨中药葛根素治疗肾间质纤维化的机制,为中医药防治肾间质纤维化提供实验依据。
材料和方法
1 材料
1.1 动物 SPF级KKAy小鼠16只,雄性,9~11周龄,25~28 g,购自中国医学科学院动物中心,KKAy小鼠许可证编号为SCXK(京)2005-0013,随机血糖≥13.9 mmol/L确定为糖尿病小鼠。C57BL/6J小鼠10只,雄性,9~11周龄,23~25 g,C57BL/6J小鼠许可证编号为SCXK(京)2002-0003,购自北京维通利华实验动物技术有限公司。动物饲养于中日友好医院临床研究所实验动物中心屏障系统,KKAy小鼠给予高脂饲料(购自中国医学科学院动物中心),普通饮水;C57BL/6J小鼠给予小鼠生长维持颗粒饲料(购自北京科澳协力饲料有限公司),普通饮水。
1.2 药物和主要试剂 葛根素注射液购自浙江康恩贝制药股份有限公司;α-SMA抗体(Ⅰ抗)为兔抗大鼠、小鼠、人多克隆抗体(北京博奥森生物技术有限公司);TGF-β1抗体(Ⅰ抗)为人多克隆抗体(北京中杉金桥生物技术有限公司;TGF-β-R1抗体(Ⅰ抗)为人多克隆抗体(北京中杉金桥生物技术有限公司);含HRP标记山羊抗兔IgG(Ⅱ抗)及高敏过氧化物酶复合物的免疫组化试剂盒购自武汉博士德生物工程有限公司,浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司。抗原修复液(0.01 mol/L、pH 6.0 柠檬酸-柠檬酸钠缓冲液)和 PBS(0.01 mol/L,pH 7.2)。
1.3 主要仪器 微量加样器(Eppendorf)、保湿盒、37℃温箱、冰箱(海尔)、Image-Pro Plus 5.1 图像分析软件、摇床、电漩涡混合器、普通冰箱、电动玻璃匀浆器、精密pH计、电子天平、电磁炉等。
2 方法
2.1 实验模型及分组 KKAy小鼠高脂饲养至14周龄时,将KKAy小鼠按随机血糖分组,将随机血糖≥13.9 mmol/L的 KKAy小鼠确定为糖尿病小鼠。动物分笼饲养,每天观察小鼠一般状态。将动物分为模型组(8只),高脂饲料喂养;治疗组(8只),高脂饲料喂养,另外每日腹腔注射葛根素注射液(1.3 mL·kg-1·d-1);C57BL/6J小鼠 8 只作正常组。以上各组动物均自由饮食,饮水,于24周龄处死动物,所取组织立即浸入液氮,取材结束后转入液氮罐。
2.2 小鼠血糖检测 剪尾取血检测16周龄、20周龄和24周龄各组小鼠空腹血糖。
2.3 肾组织形态学观察 将所取的小鼠肾组织用4%多聚甲醛溶液固定,2周后进行石蜡包埋切片。将组织切片按常规方法进行HE染色,光镜观察。
2.4 免疫组化法检测KKAy小鼠肾脏组织α-SMA、TGF-β1和 TGF-β-RI表达改变 常规制作的 KKAy小鼠肾组织石蜡切片,采用二步法免疫组化染色,按照即用型SABC法免疫组化试剂盒说明书步骤操作,Ⅰ抗分别为 α-SMA(1∶500)、TGF-β1(1∶200)和 TGF-β-RI(1∶400),用 PBS(0.01 mol/L)代替Ⅰ抗作为阴性对照。中性树胶封片,显微镜观察;照相,保存。
3 统计学处理
采用SPSS 17.0统计软件分析,数据以均数±标准差(mean±SD)表示。多组均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 小鼠一般状态
除正常组小鼠外,其余组小鼠均有精神不振,活动迟缓,尿量明显增多,体毛缺乏光泽,而且随着周龄增加症状加重。治疗组以上情况得到不同程度的改善。
2 空腹血糖
从16周龄开始模型组及治疗组小鼠血糖比正常组高,治疗组小鼠血糖较模型组血糖明显降低;比较有统计学差异(P <0.05或 P <0.01),见表1。

表1 小鼠空腹血糖检测结果Table 1.The change of blood glucose in each group(Mean±SD)
3 肾组织形态学观察
普通光镜观察可见24周龄正常组小鼠肾小管和肾小球结构完整清晰,无间质纤维化。24周龄模型组小鼠肾小球系膜细胞及系膜基质增多,肾小管上皮细胞胞浆出现明显空泡,肾间质可见炎细胞增多。治疗组24周龄KKAy小鼠肾小管上皮细胞胞浆少量空泡,间质纤维化不明显,见图1。
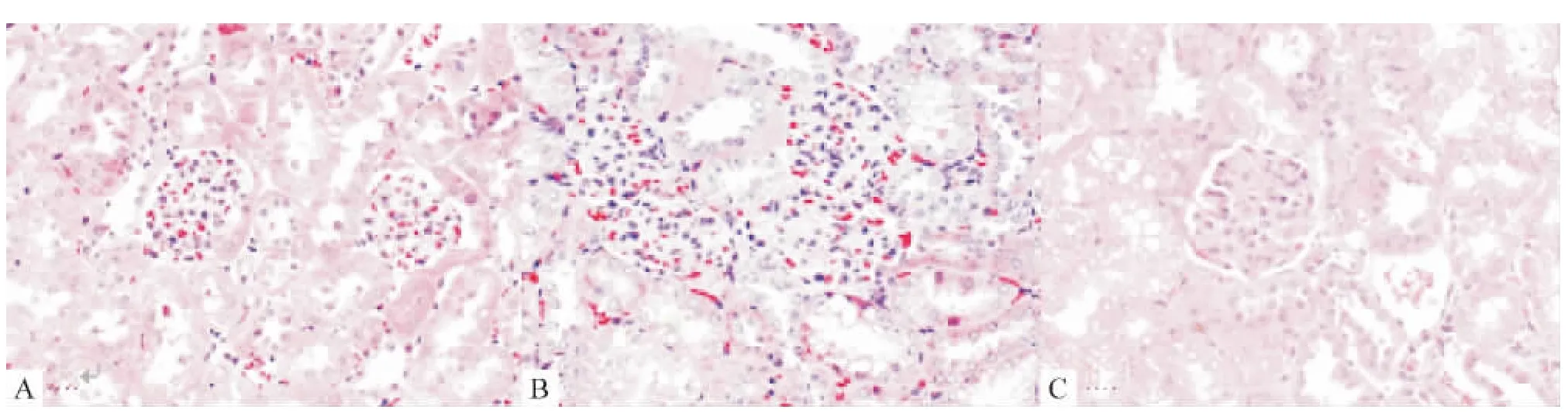
Figure 1.Pathological changes of the kidney tissues from24-week-old KKAy mice and C57BL/6Jmice(HE staining,×400).A:normal group C57BL/6Jmice;B:model group KKAy mice;C:treatment group KKAy mice.图1 24周小鼠正常组、模型组及治疗组的病理组织学改变
4 免疫组化实验结果
4.1 α-SMA蛋白表达情况 普通光镜观察小鼠肾脏组织,免疫组化染色显示:模型组肾小管上皮细胞胞质内α-SMA的表达较正常组和治疗组明显增多。治疗组肾小管上皮细胞胞质内α-SMA的表达也有增多,但不如模型组明显,见图2、表2。

Figure 2.The expression ofα-SMA in the kidney tissues of KKAy mice and C57BL/6J mice(immunohistochemical saining,×400).A:normal group C57BL/6J mice;B:model group KKAy mice;C:treatment group KKAy mice.图2 24周小鼠肾脏α-SMA免疫组化观察
4.2 TGF-β1蛋白和TGF-β-RI蛋白的表达 普通光镜观察小鼠肾脏组织TGF-β1蛋白和TGF-β-RI蛋白表达显示,正常组和治疗组肾小管上皮细胞胞质内均有较弱的表达;模型组与正常组和治疗组相比,肾小管上皮细胞胞质内表达呈强阳性,图3、4和表2。
讨 论
葛根素注射液为传统中药葛根的提取物的灭菌水溶液(2 mL相当于药材0.1 g),主要成分为葛根素,是由豆科植物野葛的干燥根中提取的一种黄酮苷,葛根素为临床证明有效的单味中药提取物。近年多项研究表明葛根素可通过对抗肾上腺素的升血糖作用、减少血清晚期糖基化终产物(advanced glycation end products,AGEs)的形成、下调 AGEs受体的过度表达、对抗蛋白糖基化的发展等机制来有效调节血糖,具有一定程度地预防和治疗糖尿病发生血管并发症的效果[7-10]。此外,葛根素还可降低糖尿病大鼠肾组织中TGF-β1的表达及活性[11]。而本实验运用葛根素注射液对KKAy糖尿病小鼠进行干预,观察小鼠血糖的动态变化及形态学表现,并研究贯穿于整个EMT过程中的重要指标α-SMA、TGF-β1及其受体的变化,以探索葛根素对肾间质纤维化的治疗作用。我们的实验结果显示,随着KKAy小鼠病情的进展,模型组小鼠较正常组表现精神不振,活动迟缓,尿量明显增多,体毛缺乏光泽,治疗组类似情况则得到相应改善。形态学观察也进一步表明,相较于治疗组,模型组肾组织发生了明显的纤维化病变,治疗组也有轻微的细胞间基质增多,但较模型组轻。结合各组小鼠的血糖水平的检测结果,可以发现,我们运用葛根素注射液治疗可改善糖尿病小鼠的血糖水平,有效地抑制KKAy小鼠肾纤维化的进程。
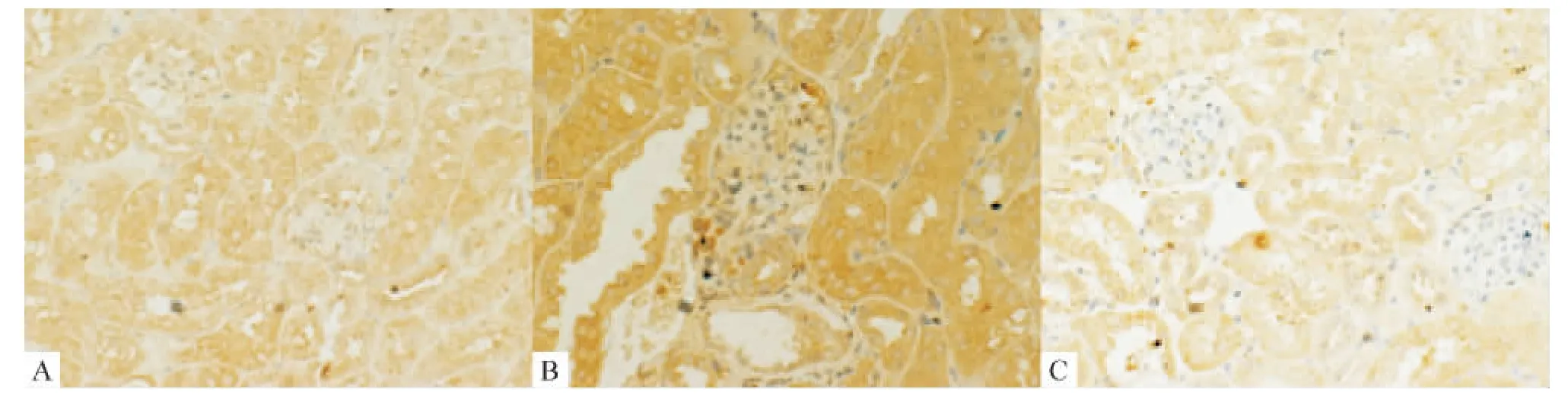
Figure 3.The expression of TGF-β1 in the kidney tissues of KKAy mice and C57BL/6Jmice(immunohistochemical staining,×400).A:normal group C57BL/6Jmice;B:model group KKAy mice;C:treatment group KKAy mice.图3 24周小鼠肾脏TGF-β1免疫组化观察
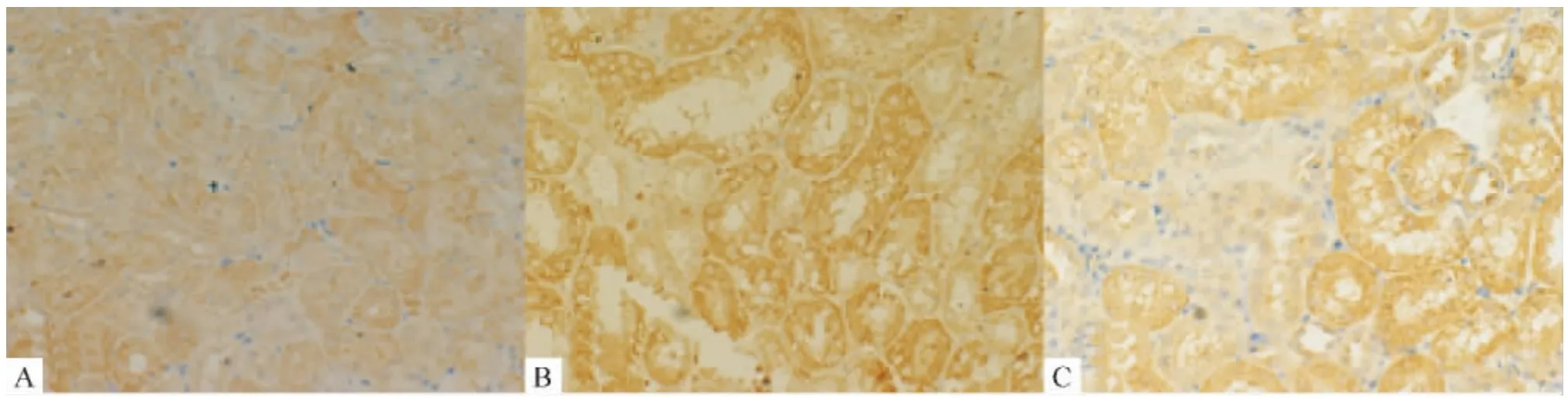
Figure 4.The expression of TGF-β-R1 in the kidney tissues of KKAy mice and C57BL/6J mice(immunohistochemical staining,×400).A:normal group C57BL/6J mice;B:model group KKAy mice;C:treatment group KKAy mice.图4 24周小鼠肾脏TGF-β-RI免疫组化观察

表2 免疫组化结果Table 2.The results of immunohistochemical staining(Mean±SD)
RIF是糖尿病肾病的严重病变,大量研究表明,在各种原因引起的慢性肾脏疾病中,肾间质纤维化都可作为肾功能恶化的一个十分准确的预测指标。而在肾纤维化发生过程中,肾小管上皮细胞激活成为MyoF(即EMT)是其中心环节。EMT是一个有序的调节过程,有4个关键步骤:(1)上皮细胞失去黏附能力;(2)α-SMA的表达和肌动蛋白细胞骨架重新排列;(3)肾小管基底膜损伤;(4)细胞迁移和侵袭能力增强[12]。而在EMT发生发展的过程中,TGF-β1是最为重要的作用因子之一。TGF-β1是一种分泌蛋白质,对细胞生长、增殖、分化和凋亡都有调控作用[13]。研究发现,TGF-β1的上调是所有人类和实验动物肾间质纤维化的特征,并且TGF-β1能抑制基质降解酶,吸引成纤维细胞和单核细胞等[14],并且能使肾小管上皮细胞发生上皮-间充质转分化过程,促使正常的肾小管上皮细胞转化为不能行使肾小管功能的成纤维细胞[15]。同时抑制肾小管上皮细胞的增殖,进一步使肾脏丧失功能,从而引发一系列炎症和纤维化的活动。TGF-β1的这些生物学作用需要通过与其受体结合而得以发挥,大多数细胞表面存在3种TGF-β1受体,分别为Ⅰ型、Ⅱ型和Ⅲ型受体。一般认为Ⅰ型受体决定TGF-β1反应特异性,也决定了它的多种生物学功能[16]。TGF-β1与其受体结合后参与了TGF-β1介导的信号通路的激活,引起肾间质纤维化。
在肾小管上皮转分化的进程中,肾小管上皮细胞可表达间充质细胞的标志蛋白:α-SMA。α-SMA在静止状态的成纤维细胞中无表达,但在转分化后α-SMA阳性的肌成纤维细胞是主要的基质合成细胞[17-18],是肾脏固有细胞转分化成MyoF后合成的一种特征性蛋白,其在肾脏局部的表达高低可间接反映MyoF的数量及肾脏纤维化程度[19]。α-SMA的出现不仅为转分化细胞提供形态学的界定,也为转分化细胞的迁移、浸润以及收缩能力的获取提供了结构基础。
本研究中,我们用免疫组化技术观察不同组别间α-SMA、TGF-β1及其受体表达的差异,结果显示模型组α-SMA颗粒远多于正常组和治疗组,而TGF-β1及其受体在正常组和治疗组中有少量表达,在模型组中大量表达,说明葛根素注射液可有效抑制α-SMA、TGF-β1及其受体的表达。
综上所述,在糖尿病肾病肾纤维化的发生和发展过程中,葛根素注射液治疗可抑制α-SMA、TGF-β1和TGF-β-RI的表达,有效改善糖尿病小鼠的症状,降低小鼠血糖,可有效地抑制肾间质纤维化的发生发展,为葛根素注射液治疗DN提供了实验依据,但其更深入调控机制及更广泛的临床应用,仍需要进一步探索和研究。
