马兜铃酸诱导大鼠肾小管上皮细胞表型转化和胶原累积及垂盆草提取物的作用*
2013-12-01胡丽萍洪炜龙林成成王斯璐陈必成白永恒
陆 红, 胡丽萍, 洪 丹, 洪炜龙, 林成成, 王斯璐, 陈必成, 白永恒△
(温州医科大学附属第一医院1医学检验中心,3外科实验室,浙江 温州325000;2温州医科大学生命科学学院,浙江 温州325035)
马兜铃酸肾病(aristolochic acid nephropathy,AAN)是服用马兜铃酸(aristolochic acid,AA)类中草药(如马兜铃、天仙藤、关木通等)引起的一类特殊的肾小管间质损害,进而导致急、慢性肾功能衰竭[1]。体内AAN主要病理表现为进行性肾间质纤维化[2],但AA如何引起间质纤维化,其机制尚不清楚,且临床上也无确实有效的治疗药物。垂盆草(Sedum sarmentosum Bunge,SSB)是一种景天科景天属多年生草本植物,其提取物具有抑制炎性渗出和免疫调节的作用,可抵抗肝纤维化的发生发展[3]。本文从体外实验角度,观察SSB提取物是否具有抗AA所致的肾小管间质纤维化作用,并初步探讨其可能的分子机制。
材料和方法
1 材料
1.1 试剂 马兜铃酸 I,购自 Sigma,纯度97%,25 mg用50μL二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,再用DMEM细胞培养液(12.45 mL)稀释成2 g/L原溶液;垂盆草提取物购自安徽宣城百草植物工贸公司,规格50∶1,1 g先用 DMSO 溶解(50 μL),再用DMEM(9.95 mL)配成100 g/L原溶液;DMEM细胞培养液购自HyClone;胎牛血清购自杭州四季青生物公司;胰蛋白酶和TRIzol提取液购自Gibco;转化生长因子 β1(transforming growth factor β1,TGF-β1)ELISA检测试剂盒购自上海西唐生物;兔抗鼠E-cadherin多克隆抗体购自Abcam;α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)单克隆抗体购自 Santa Cruz;III型胶原多克隆抗体购自Bioworld;Dylight 488或594标记山羊抗兔IgG购自北京康位生物公司;实时荧光定量PCR试剂购自Promega。
1.2 细胞 大鼠肾小管上皮细胞系NRK-52E购于中科院上海生命科学研究院细胞资源中心。
1.3 仪器 MyCycler梯度 PCR仪,Bio-Rad产品;7500定量 PCR仪,Applied Biosystems产品;Varioskan Flash全波长多功能扫描仪,Thermo Scientific产品;DM4000 B LED荧光正置显微镜,Leica产品。
2 方法
2.1 大鼠肾小管上皮细胞的培养和处理 NRK-52E细胞置于含5%胎牛血清的DMEM培养液,37℃、5%CO2培养箱内培养。实验时,将细胞按适当浓度接种于6孔板中,待细胞70% ~80%融合时,换成无血清DMEM培养液并开始正式实验。
2.2 对照溶剂实验 实验中药物AA和SSB提取物均用溶剂DMSO溶解,故先评价DMSO对细胞外基质(extracellular matrix,ECM)累积和TGF-β1的影响。AA浓度为1~100 mg/L时DMSO使用体积为0.001~0.1 mL/L体系,而SSB提取物浓度为10~2 000 mg/L时DMSO体积为0.0005~0.1 mL/L体系。因此,DMSO 损伤实验分为 0.001、0.01 和 0.1 mL/L 3组。对照溶剂实验结果证实在本研究使用的不同浓度范围内DMSO对NRK-52E细胞的ECM累积和TGF-β1生成的影响并无显著差异。
2.3 干预实验分组 将实验分成3组,分别为(1)溶剂对照组:不加 SSB和 AA,只加0.1μL DMSO;(2)AA损伤组:只加AA,浓度为1~100 mg/L;(3)SSB提取物干预组:在加入10 mg/L AA基础上,同时加入SSB提取物(10~2 000 mg/L)。按照上述分组方案,加入相应药物,置37℃、5%CO2的培养箱中培养24 h后,用倒置相差显微镜观察细胞形态学变化。
2.4 ELISA检测促纤维化因子TGF-β1含量 取对数生长期的NRK-52E细胞,以不同浓度AA(1~10 mg/L)和SSB提取物(10~2 000 mg/L)作用24 h,收集培养液。TGF-β1含量检测采用双抗体夹心ABCELISA法,即用抗大鼠 TGF-β1单抗包被于酶标板上,标准品和样品中的TGF-β1与单抗结合,加入生物素化的抗大鼠TGF-β1,形成免疫复合物连接在板上,辣根过氧化物酶标记的streptavidin与生物素结合,加入底物工作液显蓝色,最后加终止液硫酸,于450 nm处测吸光度(A),通过绘制标准曲线求出浓度。
2.5 实时荧光定量PCR检测E-cadherin、α-SMA、骨形成蛋白7(bone morphogenetic protein 7,BMP-7)和I型胶原mRNA的表达 采用TRIzol试剂提取已处理细胞中的RNA,于260和280 nm测定吸光度值以确定样本纯度和浓度。根据试剂说明书将RNA逆转录成 cDNA。应用 Primer 5.0软件设计针对 E-cadherin、α-SMA、BMP-7和I型胶原mRNA特异性引物,以β-actin作为内参照,采用相对定量法计算获得结果。引物序列见表1,由上海捷瑞公司合成。取逆转录产物1μL进行PCR扩增,PCR扩增体系:5 μL 2×SYBR Green荧光定量试剂、2μL引物(上、下游各1μL,终浓度200 nmol/L)、2μL反应缓冲液和1μL cDNA。扩增程序为:95℃ 5 min;95℃ 10 s,60℃ 35 s,40个循环。以熔解曲线评价PCR结果可靠性,2-ΔΔCt法计算相对 mRNA 表达量。ΔΔCt=[Ct目的基因(待测样品)- Ct内参照(待测样品)]-[Ct目的基因(校正样品)-Ct内参照(校正样品)]。

表1 实时荧光定量PCR引物序列Table 1.Primer sequences for real-time fluorescence quantitative PCR
2.6 细胞免疫荧光染色检测E-cadherin、α-SMA和III型胶原蛋白的表达 将细胞经胰酶消化收集后,分别以2×105个细胞接种于含载玻片的6孔板中,常规培养。培养细胞至80% ~90%融合后,分别用AA和AA联用SSB提取物进行处理24 h,弃去培养基,PBS清洗细胞3次,用4%多聚甲醛固定30 min,0.3%Triton X-100(1 mL/well)破膜,室温20 min。0.5%正常山羊血清封闭。在各细胞爬片上滴加Ⅰ抗工作液,4℃孵育过夜,PBS冲洗3次。滴加Dylight 488(绿色)或594(红色)标记的Ⅱ抗工作液,37℃孵育60 min,同上洗涤。细胞胞质绿色或红色为阳性着色。每组取3张片,每张片子取20个高倍视野(×400),运用Image-Pro Plus 6.0软件分析IA值。
3 统计学处理
采用SPSS 13.0软件包分析,数据以均数±标准差(mean±SD)表示,均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 倒置相差显微镜观察损伤与干预前后NRK-52E细胞形态学的影响
如图1所示,正常情况下,NRK-52E细胞培养24 h后,细胞密度极高,细胞间接触紧密;由于接触抑制,细胞形态小、排列成铺路石状。用不同浓度的AA作用后,细胞数量下降,细胞损伤表现明显,失去贴壁作用,细胞漂浮在培养液中;细胞形态变大,出现纤维细胞样改变(梭状)。用SSB提取物干预后,AA所致的损伤作用大幅减轻,细胞数量下降不明显,且细胞形态逐渐恢复正常。
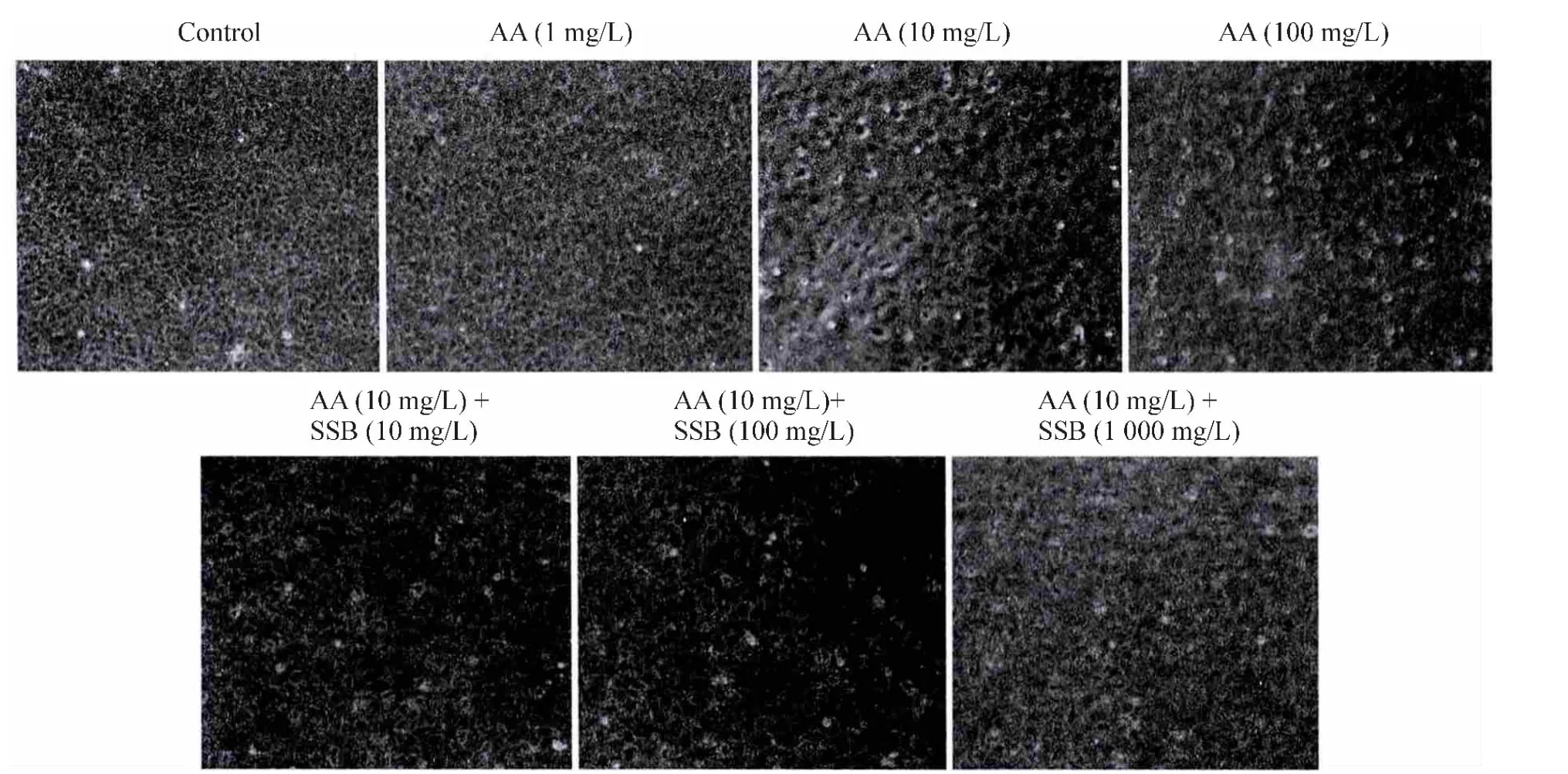
Figure 1.Morphological changes of NRK-52E cells observed under inverted phase-contrast microscope(×200).图1 倒置相差显微镜观察NRK-52E细胞的形态改变
2 SSB提取物对AA诱导的ECM累积的影响
纤维化的病理表现为大量ECM成分如I型和III型胶原在损伤局部的累积过程。我们通过细胞免疫荧光染色发现,DMSO损伤组中各浓度之间表达I型和III型胶原无明显差异;10 mg/L AA作用NRK-52E细胞后,其表达的III型胶原明显增多,见图2。同样,实时荧光定量PCR结果也显示I型胶原mRNA的表达随着AA浓度的增加而增高,见图3A。在10 mg/L AA基础上用SSB提取物进行干预,结果发现,低浓度的SSB提取物(10 mg/L)对胶原形成的影响不明显,但中高浓度的SSB提取物(100和1 000 mg/L)能明显降低I型胶原mRNA和III型胶原蛋白的表达水平,见图2、3B。这些结果提示一定浓度的SSB提取物能抑制AA所致的纤维化样效应。
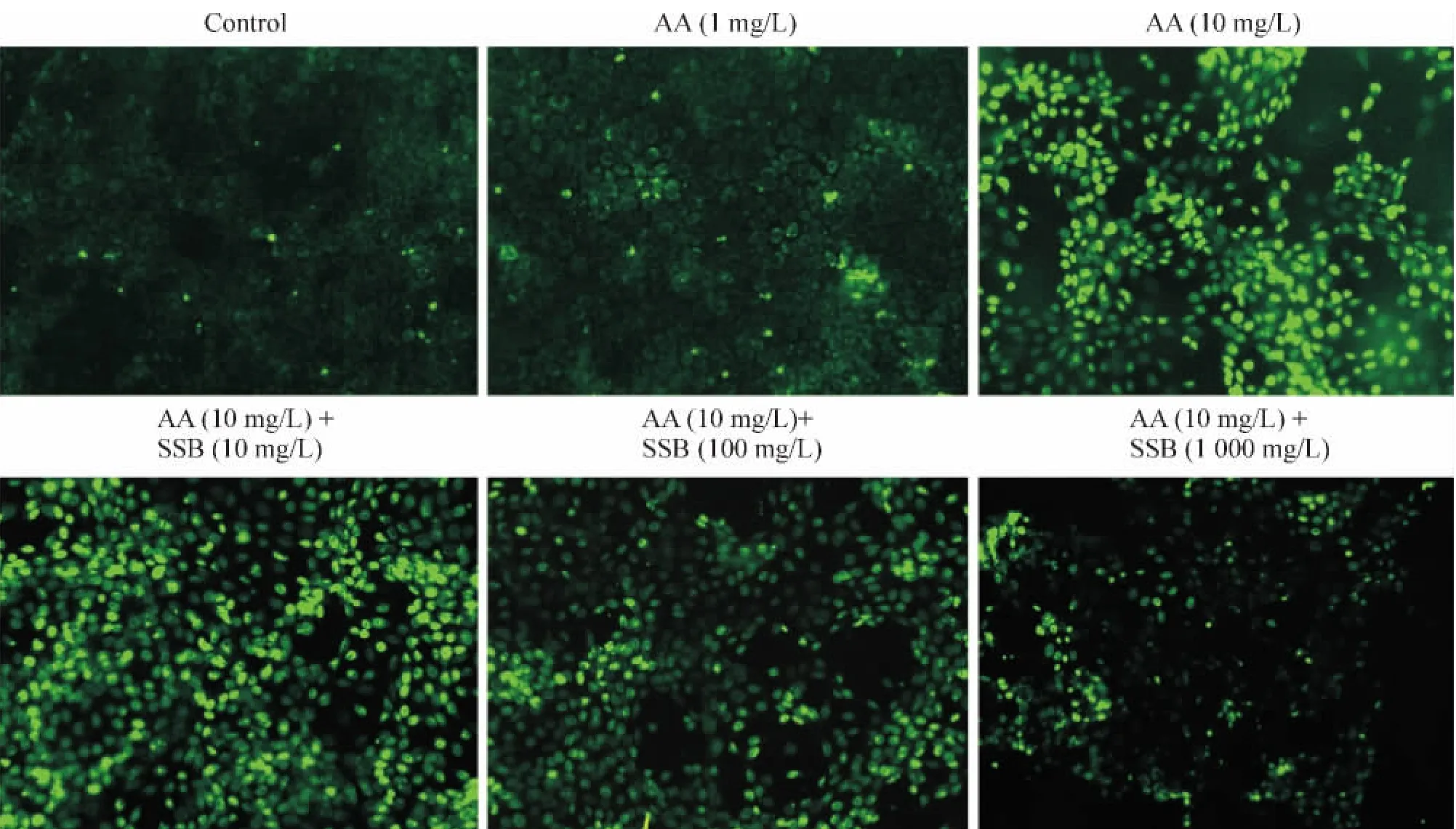
Figure 2.Expression of type III collagen in NRK-52E cells induced by AA with or without SSB extract treatment(×200).图2 AA对NRK-52E细胞中III型胶原蛋白表达的影响及SSB提取物的干预作用
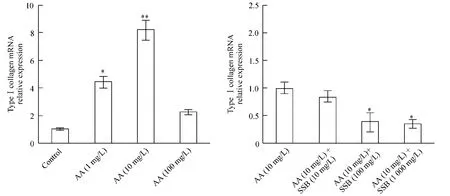
Figure 3.The mRNA expression of type I collagen in NRK-52E cells induced by AA with or without SSB extract treatment.Mean ±SD.n=10.*P <0.05,**P <0.01 vs control;#P <0.05 vs AA(10 mg/L).图3 AA对NRK-52E细胞I型胶原mRNA表达的影响及SSB提取物的干预作用
3 SSB对AA诱导的肾小管上皮细胞表型转化的影响
细胞免疫荧光染色发现,10 mg/L AA作用于NRK-52E细胞,E-cadherin蛋白表达下调,而α-SMA蛋白表达上调,见图4。此外,实时荧光定量PCR结果同样显示E-cadherin mRNA表达明显下降,α-SMA mRNA表达明显增加,且上皮-间充质转化(epithelial-mesenchymal transition,EMT)抑制分子 BMP-7 mRNA表达也下调(P<0.05),见图5。这些结果提示AA诱导小管上皮细胞胶原累积过程中出现EMT效应。通过SSB提取物的干预作用,上述改变呈现相反的趋势,见图4、5,说明SSB提取物可抑制AA诱导的EMT进程。

Figure 4.Expression of E-cadherin andα-SMA in NRK-52E cells induced by AA with or without SSB extract treatment(×200).图4 AA对NRK-52E细胞E-cadherin和α-SMA表达的影响及SSB提取物的干预作用

Figure 5.Effects of SSB extract on mRNA expression of EMT-related genes in NRK-52E cells induced by AA.Mean±SD.n=6.*P <0.05,**P <0.01 vs control.图5 SSB提取物对AA诱导的NRK-52E细胞EMT相关基因mRNA表达的影响
4 SSB提取物影响TGF-β1的表达水平
DMSO损伤实验中,各组细胞间产生TGF-β1量无明显差异。在低于10 mg/L AA作用NRK-52E细胞后,细胞分泌TGF-β1量呈现浓度依赖性,即随着AA浓度增高,TGF-β1表达量逐渐增多,到AA浓度为10 mg/L 时达峰值[(603.4 ±30.1)ng/L]。应用SSB提取物干预10 mg/L AA后,随着SSB提取物浓度从10 mg/L增加到2 000 mg/L,TGF-β1分泌量下降到(257.9 ±19.8)ng/L,见图 6,提示 SSB 提取物具有抑制TGF-β1表达的作用。
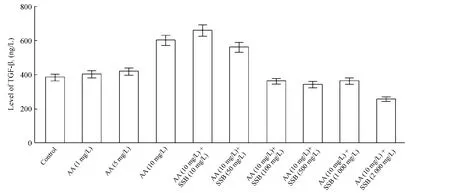
Figure 6.The level of TGF-β1 in NRK-52E cells determined by ELISA.图6 ELISA检测NRK-52E细胞中TGF-β1水平改变
讨 论
在体内,AAN主要表现为广泛的间质纤维化,同时伴有肾小管萎缩及肾小管消失等病理改变[2]。临床上AA引起的肾纤维化具有不可逆性,同时缺乏有效的治疗药物,病人常常以肾衰竭和尿毒症为结局。因此,积极探索AA所致肾纤维化的分子机制,并给予有效的早期干预,对于AAN病人具有十分重要的意义。我们前期研究显示,AA可诱导肾小管上皮细胞凋亡,并活化Sonic hedgehog信号,促使ECM成分(如I型和III型胶原)在损伤局部广泛累积,从而导致纤维化的发生[4]。本研究中,AA促进了 α-SMA表达,抑制E-cadherin表达,并下调了BMP-7 mRNA的表达。这些结果提示肾小管上皮细胞遭受AA损伤后,形成了对损伤微环境更为耐受的肌成纤维细胞,即EMT效应。此外,研究也发现,在AA损伤肾小管上皮细胞过程中,TGF-β1的表达明显升高。TGF-β1是目前公认的较强的促纤维化因子,同时也是EMT过程重要的调节分子。Yang等[5]研究显示,AA损伤细胞DNA,导致细胞生长阻滞在G2/M期,进而引起JNK信号的活化,促进了TGF-β1的表达。TGF-β1的高表达不仅促进EMT进程,也促进了胶原的累积,最终引起纤维化[6]。
垂盆草又名地蜈蚣草,其化学成分有N-甲基异石榴皮碱(N-methylisopelletierine)、二氢-N-甲基异石榴皮碱、景天庚酮糖(sedoheptulose)、葡萄糖、果糖、蔗糖等。此药性凉,味甘、淡,新鲜或干燥全草入药,主要用于治疗湿热黄疽、小便不利、痈肿疮疡。有研究表明,垂盆草的提取物能抑制炎性渗出、减少肝细胞损伤、降低血清丙基酸氨基转移酶水平,具有治疗急、慢性肝炎和抗癌等功效[7-8]。然而目前尚不清楚SSB提取物能否抑制AA所致的肾小管上皮细胞损伤。本研究结果发现:浓度为100~1 000 mg/L SSB提取物能明显降低I型和III型胶原的表达水平,提示一定浓度的SSB提取物具有潜在的抗纤维化作用。此外,我们还观察到SSB提取物能下调α-SMA的表达,并促进E-cadherin表达。这些结果提示SSB提取物可抑制小管上皮细胞的EMT进程。同时,SSB提取物也抑制了小管上皮细胞分泌和表达TGF-β1,通过下调TGF-β1表达,进而延缓肾小管上皮细胞产生胶原的进程。
综上所述,我们通过体外实验初步阐明AA可促进TGF-β1表达、肾小管上皮细胞EMT进程以及胶原累积,并且AA所致的上述这些纤维化效应可被SSB提取物拮抗。因此,SSB提取物可能具有潜在的抗纤维化作用。但SSB提取物如何发挥抗肾间质纤维化作用,其确实的效应尚需体内实验和更深入的分子机制研究加以证实和明确。
