对虾黄头病液相基因芯片检测技术研究*
2013-11-30苗春柳吴德峰谢明星
苗春柳 ,吴德峰*,谢明星
(1.福建农林大学 动物科学学院,福建 福州 350002;2.厦门出入境检验检疫技术中 心微生物实验室,福建 厦门 361026)
对虾黄头病是由黄头病毒(Yellow head virus, YHV)引起的一种对虾传染性疾病,濒死对虾因为肝胰腺发黄而使头部和胸部外观呈黄色而起名[1],我国将其列为二类疫病,世界动物卫生组织(International office of Epizootic Disease,OIE)将其列为必须申报的疫病[2]。黄头病从对虾感染到死亡经历的时间只有几天时间,而且传染率很高,对虾养殖业的损害很严重。从1990年泰国报道该病以来,黄头病对世界各地的对虾养殖业都造成了不小的损失。本病在亚洲,美洲,澳大利亚都有发生,2005年我国也在泰国进境的草虾中检出了黄头病毒[3-4]。
病毒学研究证明,黄头病毒(Yellow head virus, YHV)是一种杆状病毒,病毒大小为150~170×40~50 nm,在感染细胞的细胞质和细胞之间有包涵体形成。黄头病毒的基因组为单股正链RNA[5],长约26 000核苷酸,主要编码四种结构蛋白(22,67,135和170 kDa),基因序列分析发现其核酸结构与腮联病毒(Gill-associated virus,GAV)相似。病毒颗粒是由3种结构蛋白构成的,包括核蛋白p24和囊膜蛋白gp64、gp116[6]。核衣壳呈螺旋型对称。
黄头病毒所在的属中目前已知的病毒有6种基因型[6]。本病毒离开虾体后在25 ℃~28 ℃海水中至少还可以存活72 h,在60 ℃ 15 min条件下,0.03 mg/mL氯即可灭活黄头病毒(Yellow head virus,YHV)。黄头病毒可以侵袭草虾的初代淋巴细胞并附着生长。
由于目前黄头病的治疗手段还比较缺乏,所以疾病的检测和预防就显得颇为重要。本研究通过建立液相基因芯片检测对虾黄头病的体系,使疾病的检测更加快速、有效,为疾病的进一步研究和防治提供了良好的保障。
1 材料和方法
1.1 材料
1.1.1 病毒材料 本试验所涉及的对虾病毒样本来自于广东。
1.1.2 仪器设备 高速离心机购自Sigma公司;WB22型数控水浴锅购自Memmert公司;冷冻离心机购自Biofuge Primo R公司;高电流电泳仪购自Bio-Rad公司;凝胶成像系统(Alphamager,EP)Alpha公司;梯度核酸扩增仪(PCR仪)购自Bio-Rad公司;液相芯片检测系统(Liquichip 100) 购自Qiagen公司;电子天平BL610购自Sartorius公司。
1.1.3 主要试剂 TMAC(Tetramethylammonium chloride solution,5M) ,Sarkosyl(N-Lauroylsarcosine sodium salt),Tween-20,EDC[N-(3dimethylaminopro-pyl)-N-ethylcarbodimidehydrochloride]购自Sigma公司;Agarose(LE, Analytical Grade)购自Promega公司;SDS (Biotechnology Grade)购自厦门泰京生物技术有限公司;RNA反转录试剂盒购自宝生物工程有限公司(大连)。
1.2 方法
1.2.1 引物与探针的设计与合成 根据对虾黄头病病毒编码结构蛋白GP116的基因,找出基因中最保守的23~24个寡核苷酸(oligo nucleotide, nt)作为液相芯片的检测探针,在探针的5'端标记-NH2。分别在探针的上下游设计特异性的扩增引物。引物和探针送invitrogen公司合成,下游引物XmapR的5'端标记生物素,探针Probe 的5' C6端用氨基标记,探针的反向互补序列RC-Probe的5'端标记生物素,全部HPLC纯化。
1.2.2 病毒DNA的获取和检测 用Trizol法提取病毒RNA;按照反转录试剂盒的操作要求得到病毒的cDNA;利用PCR方法获得目的片段进行凝胶电泳检测;90 V电压下电泳30 min;电泳结束后,取出含有EB的凝胶,直接放入凝胶成像系统中观察,并拍照记录结果。
1.2.3 YHV液相基因芯片检测方法的建立
1.2.3.1 寡核苷酸探针与羧基化的荧光编码微球偶联 按照Luminex的推荐,选择荧光编码微球之间荧光信号之间误读率最低的2个荧光编码微球,分别与YHV GP116基因的特异性寡核苷酸探针偶联。荧光编码微球与探针的偶联方法参照Luminex推荐的操作进行。偶联后检测偶联的效率,看探针是否有效地偶联到微球上,分别去偶联各自特征的微球与标记了生物素的探针的反向互补序列(RC-Probe)进行杂交反应,观察能否检测到信号,以确定是否有效偶联。
1.2.3.2 黄头病毒液相芯片检测体系的建立 为了验证核酸探针偶联过的荧光编码微球与相应核酸引物的PCR产物之间的杂交否正确,按照Luminex公司推荐的液相基因芯片检测方法,建立75 μL检测体系。具体杂交步骤如下:将所有溶液恢复至室温,所有有关偶联荧光编码微球的操作应避光进行;用新合成的引物XmapF和XmapR以cDNA PCR产物为模板进行新的PCR反应,具体剂量和条件不变。所得产物用于液相芯片检测;用震荡或超声波法将各个偶联好探针的荧光编码微球重悬混匀;取荧光编码微球10 μL,再次用1.5×TMAC杂交液进一步稀释各种编码的荧光编码微球,终浓度为200个荧光编码微球/μL;在每个样品孔和背景孔,加入33 μL混合荧光编码微球工作液;对每个背景孔,加入17 μL TE(pH8.0)作为空白对照;对每个样品孔,加入纯化的PCR产物5 μL和17 μL TE(pH8.0),轻轻反复吹打混匀后盖上盖子;将上述混合液放入PCR仪中进行如下反应:95 ℃ 5 min,52 ℃ 15 min,10000 r/min离心3 min;在离心期间,用1×TMAC杂交液将SA-PE稀释至2 μg/mL,制成报告混合液;离心结束后,弃上清,加入75 μL的报告混合液,轻轻吹打几次混匀,于PCR仪上52 ℃孵育5 min。
按照Luminex公司推荐的仪器检测步骤,设置仪器每次只检测相应编码的微球,将陶瓷底板预先加热至52℃后取样品上机进行检测。再根据Luminex推荐的判定标准,当检测结果中每种荧光编码微球个数不少于20个,并且背景空白对照的荧光强度不高于500,表明试验成立,可以进行结果判定。
1.2.3.3 液相芯片检测方法灵敏性试验 为了确定液相基因芯片的检测灵敏度,将YHV模板进行10倍梯度稀释,连续稀释10-9。按所建立液相基因芯片快速高通量检测方法,确定液相芯片检测基因的灵敏度。
1.2.3.4 特异性试验 分别用各毒株探针与其他毒株的阳性扩增产物进行杂交,检测所设计的各个毒株的探针与各个毒株做选择的片段是否逐渐有非特异性杂交反应。
2 结果与分析
2.1 病毒RT-PCR扩增检测结果
图1中1、2、3为同一RNA样本的3个重复,从感染黄头病的对虾组织病料中提取RNA,利用GP116基因的引物进行RT-PCR扩增得到核酸进行电泳检测出一条特异性的条带,电泳结果如图1所示,长度与预期的128 bp相符。
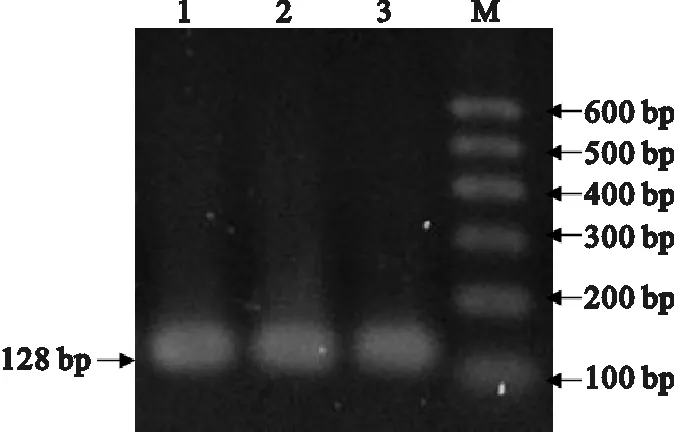
图1 RT-PCR电泳图片Fig.1 Electrophoresis images of RT-RCR
2.2 黄头病毒液相芯片检测体系的检测结果
液相芯片定性比值结果(Luminex qualitative ratio result, LQRR)等于样品的校正后的荧光强度中位值(Median florescence intensity,MFI)与空白对照MFI的平均值(MFIB)的比值,即LQRR=MFI / MFIB。比值结果大于等于3,则判定为阳性样本;结果在2到3之间,则判定为可疑样本;比值结果小于2,则判定为阴性样本。
检测结果显示,每种参与计数的荧光编码微球数都大于20个,检测结果有效并且所产生的MFI值可信;空白对照组的每种荧光编码微球的MFI值都小于500,表明检测结果有效,收集的数据可用于结果判定;病毒基因的RT-PCR反应扩增产物检测的MFI值 明显大于阴性样本和空白对照样本的值。核酸探针与相应引物的RT-PCR反应扩增产物之间均有特异性的杂交,液相芯片定性比值结果(LQRR)都大于3,表明结果均为阳性(见表1)。
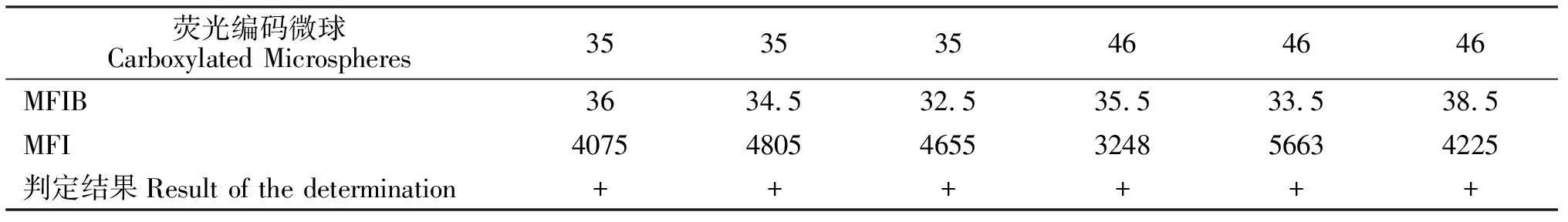
表1 液相基因芯片检测MFI值Table 1 The MFI value of liquid gene chip detection
2.3 液相芯片检测方法灵敏性试验结果
病料提取RNA,然后进行RT-PCR反应,扩增后的产物进行纯化,然后10倍梯度稀释用于液相芯片的灵敏性检测。检测结果表明:液相基因芯片检测方法检测YHV基因的灵敏度为10-6,LQRR值约为3.38(数据见表2)。
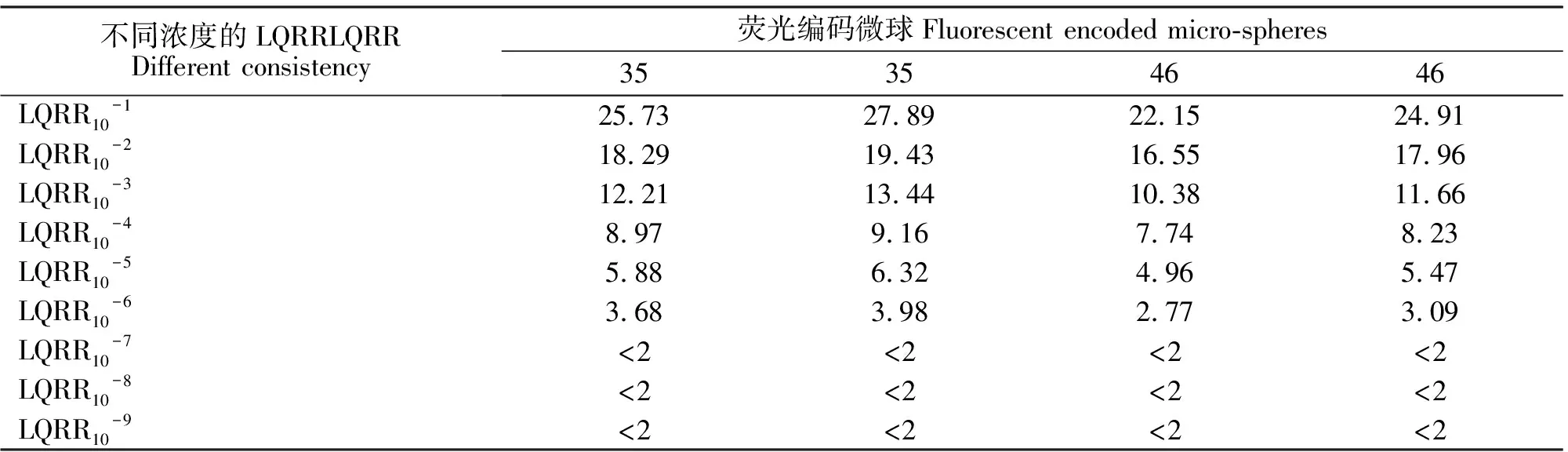
表2 液相基因芯片检测灵敏度的试验结果Table 2 The sensitive result of liquid gene chip
2.4 液相芯片检测方法特异性试验结果
对YHV,TSV,IHNNV三种不同病毒的基因作为样品,检测结果显示核酸探针与相应引物的RT-PCR反应扩增产物之间均有特异性的杂交,YHV的液相芯片定性比值结果都大于3,表明检测结果均为阳性,而TSV,IHNNV的液相芯片定性比值结果都小于2,并且空白对照的值都很低,证明了试验所建立的液相基因芯片检测方法的特异性显著,检测方法成立(结果见表3)。

表3 液相芯片检测特异性的试验结果Table 3 The specific result of of liquid gene chip
3 讨 论
3.1 液相芯片技术检测对虾黄头病的现实意义
对虾黄头病作为威胁对虾养殖业的一个重要疾病,迄今为止,尚没有特异的治疗方案和药剂,只能在源头上控制疾病的发生,这就需要特异、灵敏的技术对疾病进行检测,本试验采用液相芯片技术检测对虾黄头病,成功建立了以GP116基因与荧光微球的偶联为基础的液相芯片检测体系。从特异性和灵敏度方面都说明了此种方法对检测对虾黄头病是行之有效的。
3.2 影响PCR结果的因素
引物优劣程度直接关系到PCR反应的特异性和扩增是否成功。变性温度一般选择90 ℃~95 ℃。引物退火温度决定着PCR扩增反应的特异性和扩增产量。延伸温度的选择取决于Taq DNA聚合酶的反应最适温度,一般取70 ℃~75 ℃。常规PCR一次反应一般为25~40个循环周期。DNA聚合酶在PCR扩增反应中起着举足轻重的作用。
3.3 液相基因芯片反应体系的建立
Luminex液相芯片技术的基础是聚苯乙烯微球,这些微球标记不同荧光染料。每种微球因为各自荧光比例不同,具有不同光谱特征,可被激光特异性识别[7]。分析过程中,不同编号的微球先与不同的探针分子偶联,然后与检测样品中的目的分子和带有荧光的报告分子结合。检测时,Luninex100检测系统将微球依次单个送入检测通道,每个微球单独进行检测。由于每种编码微球可被特异性地识别出来,所以可将不同的编码微球与相应的核酸探针分子偶联并混合在一个反应体系中。
液相芯片技术的优势在于:高通量;灵敏性高;样本用量少,反应时间短;操作简单,准确度高;特异性强,检测灵活;成本较低。同时,这种检测方法也存在一些不足之处,如偶联条件的最优化、多种反应混合在一起交叉反应的避免、输出数据的统计分析的优化等,还需要进一步地提高。
液相芯片技术的应用主要包括两方面:基因液相芯片和蛋白质液相芯片,前者是基于核酸杂交建立起来的,而后者反应基础是抗原抗体结合反应[8]。目前, 对于液相基因芯片的开发已经比较成熟,而且实际应用也比较多。由于液相芯片技术的高通量、灵敏度高等优点,在将来的核酸和蛋白质科研和临床检测方面必定会有很大的发展空间[9]。随着科学技术的深入,计算机软件功能的逐渐完善和检测技术实际操作经验日益丰富,液相芯片技术必将会更广泛的用于各种科学研究和临床检测中[10]。
3.4 液相芯片技术的应用和发展前景
液相芯片技术的应用主要包括两方面:基因液相芯片和蛋白质液相芯片,前者是基于核酸杂交建立起来的,而后者反应基础是抗原抗体结合反应[11]。带有羧基的荧光微球可以和核酸探针偶联,再结合需要检测的DNA片段,最后包被报告荧光试剂,就可以检测样本中是否有目的核酸分子。此外,聚苯乙烯微球在NHS和EDC活化后可以和氨基以共价键结合,然后就可以偶联蛋白质探针,检测样本中是否有目的蛋白[12]。
目前, 对于液相基因芯片的开发已经比较成熟,而且实际操作也比较多。科学研究方面,该技术在基因序列分析和SNP分析等方面运用比较广泛;临床应用上,该技术已被制作成试剂盒用来检测多种病原体[13]。由于液相芯片技术的高通量、灵敏度高等优点,在将来的核酸和蛋白质科研和临床检测方面必定会有很大的发展空间[14]。随着科学技术的深入,计算机软件功能的逐渐完善和检测技术实际操作经验日益丰富,液相芯片技术必将会更广泛地用于各种科学研究和临床检测中[15]。
4 结 论
通过国内外最新研究成果,设计了一对特异性引物。优化了PCR反应的退火温度、Mg2+浓度、循环数等参数,得到了需要的DNA片段。
选择两种高效的荧光编码微球,通过与探针的偶联和目的基因片段的检测,证明了试验的可行性。
建立了对虾黄头病液相基因芯片检测体系,成功检测出黄头病毒的GP116基因,对各个条件的进一步优化,以便将来用于实践操作检测对虾黄头病毒。
参考文献:
[1] 刘荭译.斑节对虾黄头病[J].鱼类病害研究,1994,12(4):35.
[2] 世界动物卫生组织, 水生动物疾病诊断手册[M].3版. 国家质量监督检验检疫总局译, 北京:中国农业出版社, 2000:165-171.
[3] Walker P J, Bonami J R, Boonsaeng V,et al. Roniviridae Vi-rus Taxonomy VIIIth Report of the ICTV Fauquet C M Mayo M A Maniloff J Desselberger U and Ball L A eds[J]. Elsevier Academic Press London, 2004:973-977.
[4] Flegel T W. Special topic review: Major viral diseases of the black tiger prawn (Penaeus monodon) in Thailand[J]. World J Microbiol Biotechnol,1997,13:433-442.
[5] Anantasomboon G, Sriurairatana S, Flegel T W,et al. U-nique lesions and virallike particles found in growth retarded black tiger shrimp Penaeus monodon from East Africa[J]. Aquaculture , 2006,253:197-203.
[6] Hasson K W,Hasson J, Aubert H,et al. A new RNA friendly fixative for the preservation of penaeid shrimp samples for virological assay using cDNA probes[J].Virol J Methods, 1997, 66:227-236.
[7] 陈 玮.液相芯片技术的原理与应用进展[J].成都医学院学报,2008,3(3):225-231.
[8] Dunbar S A,Vander Zee C A, Oliver K G, et al.Quantitative multiplexed detection of bacterial pathogens:DNA and protein applications of the Luminex LabMAP system[J]. J Microbiol Methods, 2003, 53(2):245-252.
[9] Linkov F, Yurkovetsky Z, Lokshin A. Hormones as biomarkers: practical guide to utilizing Luminex technologies for biomarker research[J]. Methods Mol Biol , 2009, 520:129-141.
[10] 谢 冲,王国民.Luminex液相芯片的发展及应用[J].复旦学报,2010,37(2):241-244.
[11] 朱海红,蒋汉梁,陈 智,等.基于悬浮芯片技术的56 种病原微生物的高通量检测[J].浙江大学学报(医学版),2007,36(6):524.
[12] 贺晓恒,陈士岭,孙 玲,等.Luminex液相芯片技术测定人早孕滋养层细胞及蜕膜细胞中基质金属蛋白酶的表达[J].南方医科大学学报, 2006,26 (8):1 136-1 139.
[13] Hulse R E, Kunkler P E, Fedynyshyn J P,et al.Optimization of multiplexed bead-based cytokine immunoassays for rat serum and brain tissue[J]. J Neurosci Methods, 2004,136 (1):87-98.
[14] Wong S J, Demarest V L, Boyle R H, et al. Detection of human anti-flavivirus with a West Nile virus recombinant antigen microsphere immune-oassay[J]. J Clin Microbiol, 2004, 42(1):67-72.
[15] 孙 凯,汪 谦.液相芯片技术研究应用进展[J].中华试验外科杂志,2005,22(5): 639-640.
