支原体PCR检测方法的建立及初步应用
2013-11-23邱文英方鹏飞郭建宝向丕元胥燕芳
徐 静,邱文英,方鹏飞,郭建宝,向丕元,胥燕芳
(四川省华派生物制药有限公司,四川简阳641400)
支原体介于病毒和细菌之间,多形性,可通过0.22 μm滤膜。动物疫苗常因有支原体污染导致不安全因素,比如鸡滑液支原体引起火鸡呼吸道疾病,猪肺炎支原体和猪鼻支原体引起猪呼吸道疾病,因此支原体检测是兽用疫苗必检项目。疫苗支原体污染的主要来源是培养疫苗用的培养介质[1-2],细胞是增殖病毒的主要介质,血清是细胞培养的主要成分[3],必须采取特别的控制措施防止原辅材料造成疫苗支原体污染。预防和控制细胞、血清等被支原体污染必须有良好的检测方法。目前支原体检测方法有荧光染色法、培养法、核酸扩增法。培养法是支原体检验的金标准,但耗时,至少需要29 d;并且不是所有支原体都能在同一培养基中生长。商品PCR试剂较为昂贵,对于大批量样品检测成本太高。在动物疫苗生产中需要快速检测批量的原辅材料、细胞、半成品,因此有必要建立一种快捷、简便、经济的方法检测血清、疫苗、细胞中的支原体,PCR方法是其方法之一[4-6]。商品PCR试剂较为昂贵,对于大批量样品检测成本太高。因此建立该PCR用于检测动物疫苗相关产品的支原体污染,保证动物疫苗的纯净性。
1 材料
1.1 阳性对照、细胞、菌种及被检样品 猪肺炎支原体MY-99,由四川农业大学熊焰教授馈赠,猪鼻支原体(NCTC10130,BTS-7)、鸡滑液支原体(WVU 1853)和口腔支原体(CH19299,ATCC23714),中国兽医药品监察所提供;阴性对照:水。细胞:Vero、ST(中国典型培养物保藏中心)、Marc-145(中国动物疫病预防控制中心)、BHK-21(由四川农业大学馈赠)、PK15-ZJU(浙江大学馈赠)、MDBK(中国兽医药品监察所)、SP2/0(由中国农科院馈赠)。细菌:大肠杆菌(C83549)购自中国兽医药品监察所;巴氏杆菌(C51-17)、副猪嗜血杆菌(HU-SP1)由四川省华派生物制药有限公司分离保存。检测样品:毒种:PCV2(ZJ/C,浙江大学馈赠);PPV SC1株和 PRV SE株(四川农业大学馈赠),Barhta-k61(哈尔滨兽医研究所馈赠),PRRSV(CH-1R由哈尔滨兽医研究所和JXA1-R由中国动物疫病预防控制中心馈赠);疫苗:猪瘟活疫苗(细胞源)、伪狂犬病活疫苗(Bartha-k61)、猪繁殖与呼吸综合征活疫苗(CH-1R,由四川华派生物制药有限公司生产和购自某公司)、鸡新城疫活疫苗(Ⅳ系,购自某公司)、鸭瘟活疫苗(购自某公司);血清:新生小牛血清(草原绿野、内蒙金源康、杭州四季青、山东劲牛)。
1.2 主要试剂 酚、氯仿和Mastermixture等购自成都博瑞克生物科技有限公司;支原体PCR检测试剂盒购自北京天之泰生物科技有限公司;支原体固体培养基、支原体液体培养基、改良Frey氏培养基购自中国兽医药品监察所。
1.3 主要设备 PCR仪器(BIO-RAD S1000)购自成都百乐,凝胶成像分析仪(WD-9413B)及电泳仪(DYY-6C)购自北京六一仪器厂,台式冷冻离心机(TGL-16S)购自成都蜀科仪器有限公司。
2 方法
2.1 支原体引物 参照J.Timenetsky等[5-7]的报道进行设计。将设计的引物输入Genebank进行比对。设计上游引物 P116 RNA 5’GGCAGCAAACTCGATAGATACCCA 3’,下游引物 P216 RNA 5’TGGACGATCTGTCACTCTGTTAACCTG3’,上下游引物由英潍捷基公司合成。
2.2 PCR方法
2.2.1 DNA模板提取 采用酚氯仿抽提法[8]。
2.2.2 PCR PCR循环:94℃ 4 min,(94℃ 30 sec;55℃ 30 sec;72℃ 30 sec;35个循环),72℃10 min。点样电泳90 V,40 min电泳,紫外线下观察目的片段应为255~275 bp。
2.2.3 敏感性测定 将107.0CCU/mL猪肺炎支原体菌液和105.0CCU/mL鸡滑液支原体菌液分别进行 10 倍系列稀释,分别取 10-5、10-6、10-7、10-8、10-9、10-10和 10-3、10-4、10-5、10-6、10-7、10-8稀释度的菌液,采用2.2.1项抽提DNA模板,进行PCR扩增,电泳检测。
2.2.4 特异性测定 将猪肺炎支原体、猪鼻支原体、鸡滑液支原体、口腔支原体、大肠杆菌、兔巴氏杆菌、副猪嗜血杆菌液采用酚氯仿方法抽提,进行PCR扩增,电泳检测。
2.2.5 与支原体PCR商品检测试剂盒对比试验
将Vero、ST、Marc-145、BHK-21、PK15、MDBK、SP2/0细胞、猪肺炎支原体、猪鼻支原体、鸡滑液支原体、口腔支原体、猪细小病毒种毒、猪瘟活疫苗(细胞源)、鸡新城疫活疫苗(Ⅳ系)、新生牛血清、大肠杆菌、巴氏杆菌、副猪嗜血杆菌液体采用酚氯仿抽提DNA,然后用两种PCR方法进行同时检测。
2.3 与培养法[9]对比试验 支原体培养按《中华人民国和国兽药典》二○一○年版附录进行。选猪肺炎支原体、鸡滑液支原体、口腔支原体、BHK-21细胞、猪细小病毒种毒、购自某公司的猪繁殖与呼吸综合征病毒活疫苗(CH-1R)、购自某公司的鸡新城疫活疫苗(Ⅳ系),采用支原体培养法和自建的PCR进行比较。
2.4 应用检测
2.4.1 细胞 ST细胞、VERO细胞、Marc-145细胞、BHK-21细胞和PK15:将上述培养72~96 h长至单层的细胞反复冻融3次作为样品,按2.2项方法进行检测。
2.4.2 毒种 湿毒直接取液体抽提DNA模板,冻干毒用无菌MEM稀释作为样品,按2.2项方法进行检测。
2.4.3 疫苗 将冻干苗用PBS稀释成10头份(羽份)/mL作为样品,按2.2项方法进行检测。
2.4.4 血清 取血清进行5倍稀释作为样品,按2.2项方法进行检测。
3 结果
3.1 PCR方法检测结果 该方法扩增出猪肺炎支原体、猪鼻支原体、鸡滑液支原体和口腔支原体特异性260 bp左右条带,(支原体菌株不同,其目的条带不同,在255~275 bp之间),阴性对照没扩增出特异性条带(图1)。
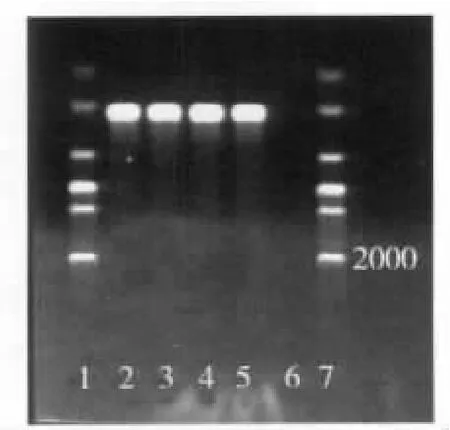
图1 PCR方法检测阳性及阴性对照
3.2 敏感性测定结果 猪肺炎支原体稀释到10-9可检测到明显的条带(图2)。鸡滑液支原体稀释到10-7可见明显条带(图3)。
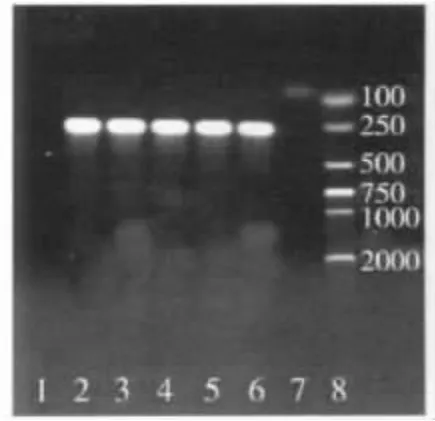
图2 用猪肺炎支原体检测PCR方法敏感性试验结果

图3 用鸡滑液支原体检测PCR方法敏感性试验结果
3.3 特异性结果 检测结果表明猪肺炎支原体、猪鼻支原体、鸡滑液支原体和口腔支原体可见特异性条带,而大肠杆菌、兔巴氏杆菌和副猪嗜血杆菌无特异性条带(图4)。

图4 PCR方法特异性试验结果
3.4 与商品支原体PCR试剂盒对比试验结果两种PCR方法检测BHK-21、猪肺炎支原体、猪鼻支原体、鸡滑液支原体、口腔支原体和保存的猪细小病毒种毒都为阳性,其它细胞、疫苗、血清和细菌都为阴性。
3.5 与培养法的对比结果 支原体培养基能培养出BHK-21细胞悬液和某公司生产的猪繁殖与呼吸综合征疫苗的支原体、猪鼻支原体、猪肺炎支原体、口腔支原体,但不能培养出鸡滑液支原体和猪细小病毒种毒悬液中的支原体。用改良Frey氏培养基能培养出鸡滑液支原体,但不能培养出猪鼻支原体、猪肺炎支原体和口腔支原体。PCR和培养法检测鸡新城疫活疫苗都为阴性(表1)。
3.6 应用检测结果 应用该PCR进行检测,结果表明 BHK-21、Vero、PK15受支原体污染、PPV、PCV2、PRV种毒受支原体污染、购自某公司的猪繁殖与呼吸综合征活疫苗受支原体污染。其他细胞及疫苗未受支原体污染。应用检测结果见表2。

表1 培养法与PCR方法的对比检测结果
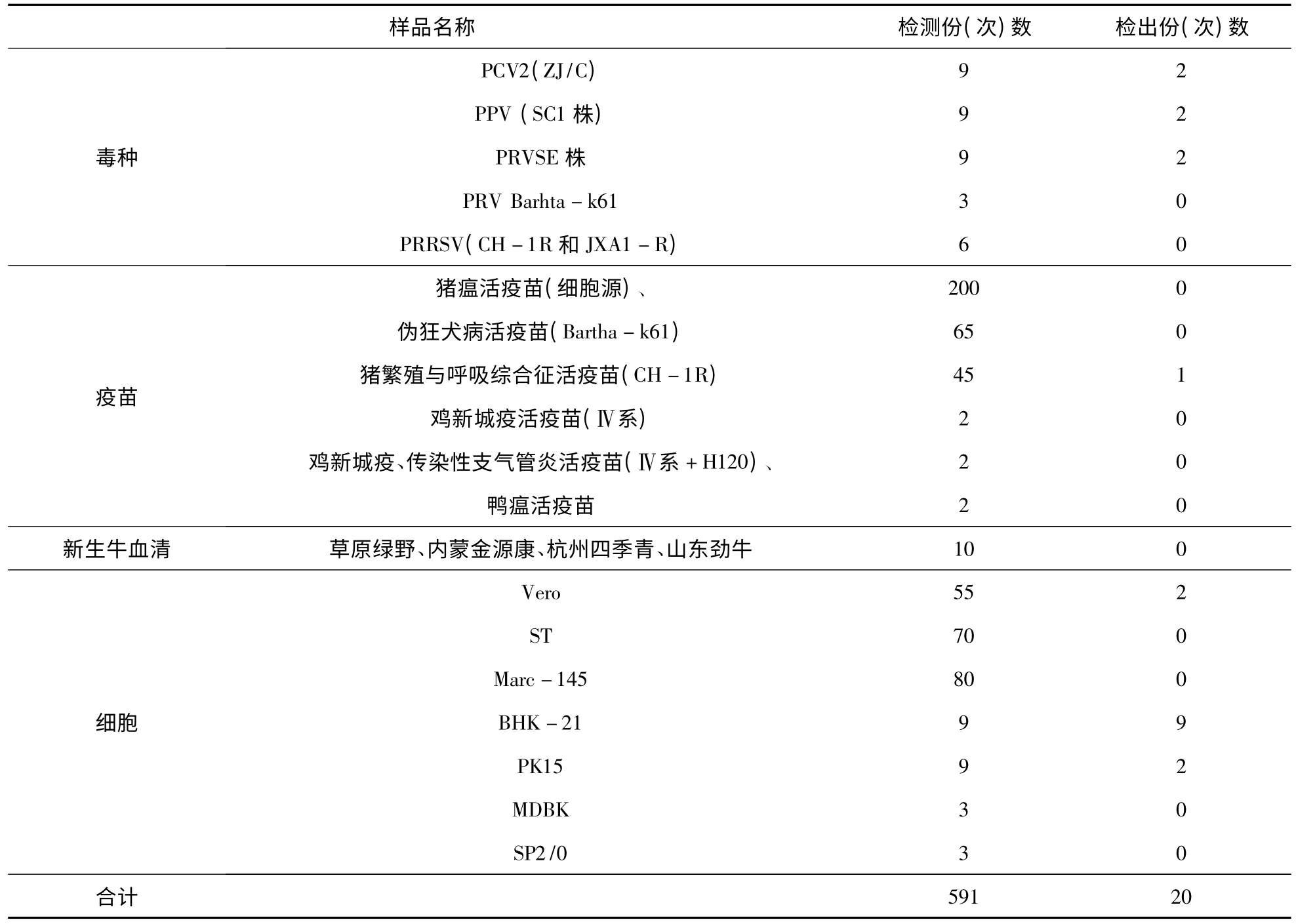
表2 PCR方法应用检测结果
4 讨论
支原体检测方法有荧光染色法、培养法、核酸扩增法。PCR方法是一种快速、敏感、特异的方法。将设计的引物输入Genbank进行比对,该引物序列对支原体属的所有支原体都具有特异性,扩增出的片段在255~275 bp之间,从而能检出猪肺炎支原体、猪鼻支原体、鸡滑液支原体和口腔支原体的结果印证Genbank比对结果。将检测BHK-21污染的支原体片段测序,表明该细胞系污染了猪鼻支原体,片段大小为271 bp,与预期分析结果符合。敏感性试验表明该方法能检测出0.01CCU的猪肺炎支原体和鸡滑液支原体。与现有商品PCR检测试剂盒对比,两种方法符合率达100%。但该方法比商品PCR试剂盒更为经济。支原体培养法既是传统又是是动物疫苗产品支原体检验的参考方法。该方法比较敏感,但相对耗时。同时一种支原体培养基并不能培养出支原体属的所有种。比如用支原体培养基不能培养出鸡滑液支原体,但用改良Frey氏培养基可培养出;但改良Frey氏培养基不能培养出猪肺炎支原体、口腔支原体和猪鼻支原体。另外,支原体培养需要液体和固体两种培养基。需要特殊的营养成分才能培养出,比如常规的支原体培养基中含醋酸铊。PCR方法是一种快速的检测方法,从样品到获得检测结果仅需3~4 h左右,因此采用PCR非常适合用于评价原辅材料、半成品和成品中污染的支原体。与培养基培养方法相比,PCR检测率高14.3%(PCR 7/7阳性,培养方法6/7阳性)。据 Spaepen和 Hopert等报道[10-11]PCR 与培养基培养法符合率为100%或高于90%。这主要是因为单一的支原体培养基培养方法并不适于所有支原体生长。运用该PCR检测样品的结果表明:来自科研院所的细胞、毒种被支原体污染相对严重。我们的检测结果表明有(50%)(6/12)细胞被支原体污染,这与报道的60%的细胞被支原体污染较低,主要是由于一些细胞株来自生产动物疫苗监管部门,这些部门在控制支原体方面更为严格、规范。
建立的PCR方法比培养法是更为快速、敏感、特异、经济的支原体检测方法,建议在疫苗生产过程中采用PCR方法检测细胞、血清、半成品和成品。
[1]宁宜宝,冀锡霖.细胞培养的活疫苗种支原体污染[J].中国兽医杂志,1992,18(4):44-45.
[2]宁宜宝,冀锡霖.国内活疫苗中支原体污染报道[J].中国兽药杂志,1993,27(1):34-36.
[3]H Dvorakova,L Valicek,M Reichelova.Detection of mycoplasma contamination in cell cultures and bovine sera[J].Vet Med–Czech,2005,50(6):262-268.
[4]赖小敏,方国源,李彩霞.用PCR和培养法检测细胞中支原体污染[J].中山医科大学学报,1999,20(2):151-154.
[5]G Rawadi,O Dussurget.Advances in PCR based Detection of Mycoplasmas Contaminating Cell Cultures[J].Genome Res,1995,4:199-208.
[6]OIE Avian Mycoplasmosis.Manual of Diagnostic Tests and Vaccinesfor Terrestrial Animals 2013(on-line English version)[Z].
[7]J Timenetsky,L M Santos,M Buzinhani,et al.Mettifogo Detection of multiple mycoplasma infection in cell cultures by PCR[J].Braz J Med Biol Res,2006,39(7):907-914.
[8]J萨姆布鲁克,(美)D.W.拉塞尔.分子克隆实验指南第3版[M].北京:科学出版社,2002:1686-1687.
[9]中国兽药典委员会.中华人民共和国兽药典2010年版三部[M].北京:中国农业出版社,2010:49.
[10]Spaepen M,Angulo A E,Ma~Tnen R,et al.Detection of bacterial and mycoplasma contamination in cell cultures by polymerase chain reaction[J].FEMS Microbiol Lett,1992,78(1):89-94.
[11]Hopert A,Uphoff C C,Wirth M,et al.Specificity and sensitivity of polymerase chain reaction(PCR)in comparison with other methods for the detection of mycoplasma contamination in cell lines[J].J hnmunol Methods,1993,164:91-100.
